家兔失血性休克死后肝脏CT影像学变化与死亡时间的关系
郑吉龙,倪首涛,章彪,霍德民,赵开放,刘夏,杨森
(中国刑事警察学院法医系法医病理教研室,沈阳 110035)
死亡时间 (postmortem interval,PMI) 在法医学上是指死后经历时间,即发现、检查尸体时距死亡发生的时间间隔[1-2],是法医学研究的重要领域之一。 在传统的实践工作中,法医工作者经常结合早晚期尸体现象、客观环境因素和工作经验,对PMI进行综合推断。也有学者利用免疫组织化学和体液的生化检测等技术手段,以期更加准确的推断PMI[3]。但是,上述方法中影响PMI推断的因素众多,使其准确性受到一定的限制。随着现代影像学诊断技术的发展、成熟,计算机断层扫描 (computed tomography,CT) 、磁共振、X线等数字化检查手段在法医学领域逐渐得以推广运用,尤其是在尸检方面,具有无创、快速、客观、数据易保存的特点,国外学者称其为“虚拟尸检”或无创伤解剖[4]。本研究运用CT影像学技术分析家兔肝脏组织随PMI推移所产生的影像学变化,并探讨利用死后肝脏面积/腰椎面积和肝脏组织平均CT值的变化与死后经过时间的关系,进行PMI的推断。
1 材料与方法
1.1 材料
1.1.1 动物:健康成年家兔25只 (由中国医科大学动物实验中心提供) ,雌雄不限,体质量2.0~2.5 kg。
1.1.2 主要仪器设备:NeuViz双层螺旋CT机 (中国东软公司生产,2×10 mm高速陶瓷稀土探测器,快速获得360度双层影像) ;Max Viewer (Version:1.0.0131,CT影像专用处理器) 。
1.2 方法
1.2.1 动物分组:家兔处死后随机分为尸检对照组和CT扫描实验组,实验组扫描完成后即为尸检对照组。实验组分别在死后即刻、3 h、9 h、15 h、21 h、27 h、33 h、39 h、45 h、51 h、57 h、63 h、69 h、75 h、81 h、87 h、93 h、99 h、105 h、111 h、117 h、123 h、129 h进行肝脏区域CT扫描检查。扫描完后立即随机选取1只进行解剖观察。其余家兔全部至下一时间点进行螺旋CT全身扫描,直到实验结束。
1.2.2 动物死亡模型的建立与死后保存方法:动物麻醉后,分离左颈外动脉,剪断其动脉致死亡,构建失血性动物死亡模型[5]。处死后手术线缝合颈外伤口,以家兔标准解剖学体位进行固定,充分暴露胸腹部,以便行肝脏CT扫描[6]。处死后的家兔于室温(25~27℃) 、相对湿度75%的密闭实验室中保存,避免嗜尸性昆虫的侵扰。
1.2.3 肝脏 CT扫描方法:在不同死后经过时间,应用螺旋CT机 (薄层平扫层厚0.75 mm、层距2 mm,管电压120 kV、电流250 mA、时间1.0 s[7-8]) 连续对仰卧位家兔肝脏部位进行薄层平扫。扫描之后将获取的影像储存于硬盘中。
1.2.4 图像选取方法:用东软CT影像Max Viewer阅读软件对拷贝扫描所得的CT影像进行观察与测量。选取位于第一腰椎(L1)平面的肝脏CT影像,以避开肝内胆管、骨骼等结构的干扰。
1.2.5 图像分析及统计学处理方法:分别测量此平面中肝脏组织近腹侧和近背侧一定面积 (5 mm2) 内的CT值,求得2处的均值。同时测量肝脏组织面积和L1(包括髓腔) 的面积,并计算肝脏面积/L1面积。然后用EXCEL软件对测量出来的肝脏组织平均CT值、肝脏面积/腰椎面积参数进行分析处理。
1.2.6 尸体解剖检验方法:在CT检查后,随机选取1只家兔并按照传统方法进行尸检 (死后0 h除外) ,剖开腹腔后观察肝脏大体改变,并记录[9]。
2 结果
2.1 家兔死亡后不同时间肝脏CT影像所见
家兔死亡后短时间内,肝组织质地较均匀,肝脏内无明显低密度影。至死后39 h内,肝脏前缘与腹壁贴合仍然较为紧密,肝脏后缘与后腹壁之间逐渐填充少量气体,肝脏中胆管充气扩张不明显;之后随着PMI的延长,死后45 h时可发现肝脏与腹壁分离,肝脏实质区域不断缩小,四周充满气体;死后69~123 h,肝脏各叶已分辨不清,肝脏实质密度增加且密度不均匀,肝脏组织呈散在的点斑片状。死后129 h的CT影像表现为肝脏基本消失,肝脏所在区域由于气体充盈,仅有少量结缔组织影存在,见图1。
2.2 家兔死亡后不同时间肝脏面积/腰椎面积、肝脏平均CT值参数( 表1)
死后39 h内肝脏面积/腰椎面积比值变化不显著,39~87 h之间显著下降,87 h以后比值减小又趋于缓慢。肝脏平均CT值在死后逐渐升高,至27~39 h达到高峰,随后逐渐下降。
2.3 家兔死亡后肝脏组织的尸检所见
尸检的结果与基于螺旋CT获得的肝脏检查结果基本一致。在死后早期阶段 (0~27 h) ,肝脏大小基本无变化,肝内胆管正常,肝脏的颜色由红褐色逐渐转变为黑色;随后,肝内胆管扩张、肝脏实质发生自溶、液化,肝脏体积逐渐减小,最初速度较慢,以后加快。此时,肝脏中可见大小不等的腐败气泡,肝脏实质呈泥状。死亡80 h以后,肝脏因腐败致体积减小速度有所减慢,仅剩下少量结缔组织。
2.4 回归分析
死后129 h内,家兔肝脏组织面积/腰椎面积和平均CT值均随着PMI的延长而呈下降趋势,两者间存在着较强的负相关,对死后肝脏组织面积/腰椎面积和平均CT值与PMI的关系进行曲线拟合( 见图2、3) ,建立回归方程。肝脏组织面积/腰椎面积:y=0.000 5x2-0.140 0x+14.477( y/%,x/h,r = -0.918,P < 0.001,R2=0.872 9) ,CT值:y=-0.002 1x2-0.085 9x+55.432( y/HU,x/h,r = -0.868,P < 0.001,R2=0.786) 。
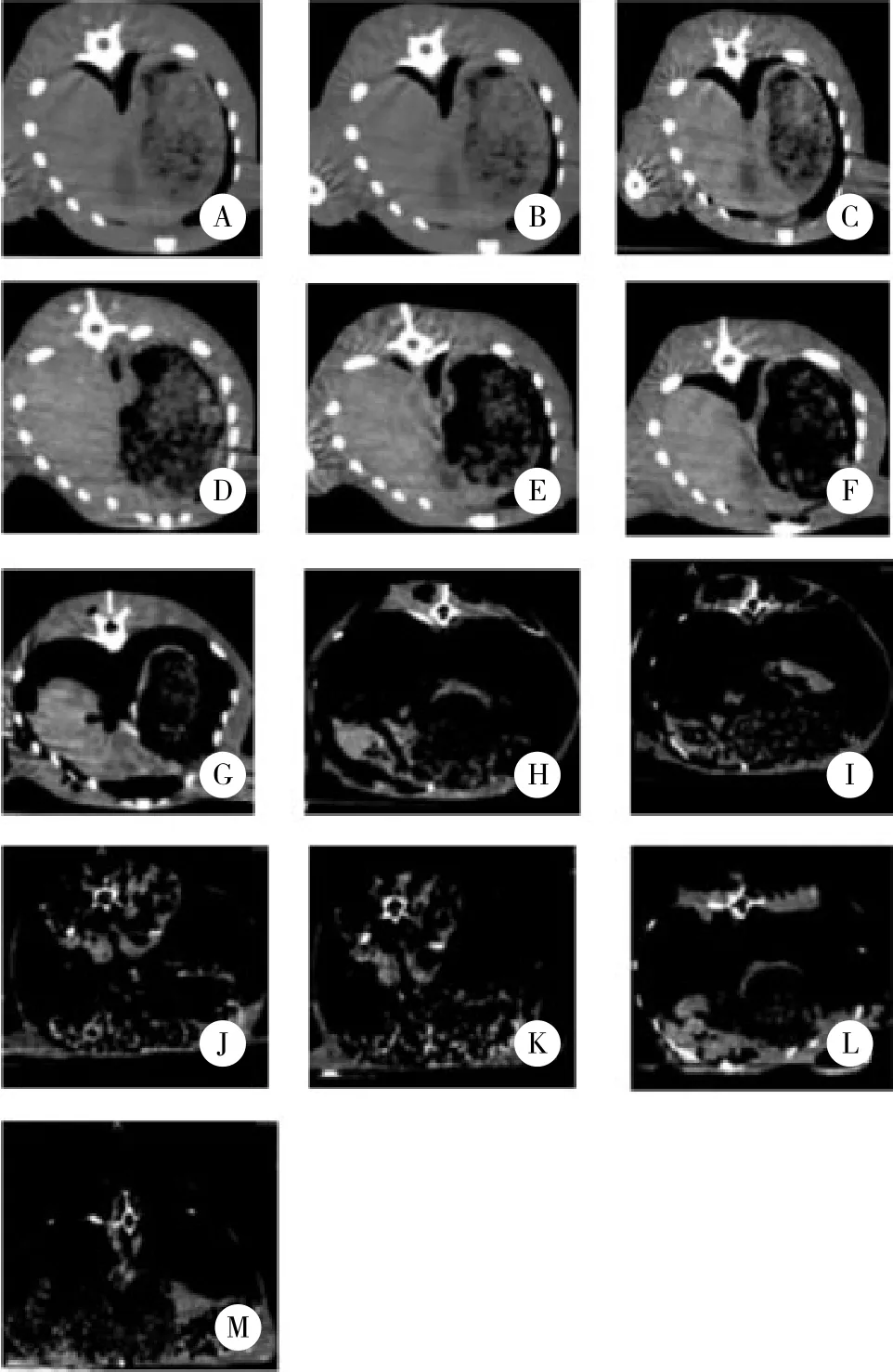
图1 家兔失血性休克死后肝脏组织CT扫描影像Fig.1 Rabbits liver CT images changes after death caused by hemorrhagic shock
3 讨论
PMI推断一直是法医学研究的重点。传统上法医学家可根据尸体征象 (如尸温、尸僵、胃内容消化程度等) 对PMI进行快速的推断,但由于这仅仅是经验法则的运用,而且尸体征象的表现受外界环境因素影响较大,推断结果偏差往往较大。随着各种学科的交叉融合与发展进步,众多全新的生物化学方法与技术逐渐应用到PMI推断中,如利用组织DNA及蛋白质降解程度[10-11]、体液离子含量变化[12-13]、机体酶代谢水平[14]等等。上述众多方法将之前的PMI推测从经验性、模糊性的估计,逐渐提升到依据某特定指标随时间的变化规律而进行的客观性、量化性的判断,在一定程度上提高了PMI推断的准确性和技术性,但其操作技术的繁琐性和对尸体的破坏性,也限制了这些方法的发展与运用。

表1 家兔死亡后肝脏面积/腰椎面积及平均CT值的变化Tab.1 Postmortem change of the liver CT value and liver area/lumbar area ratio in rabbits
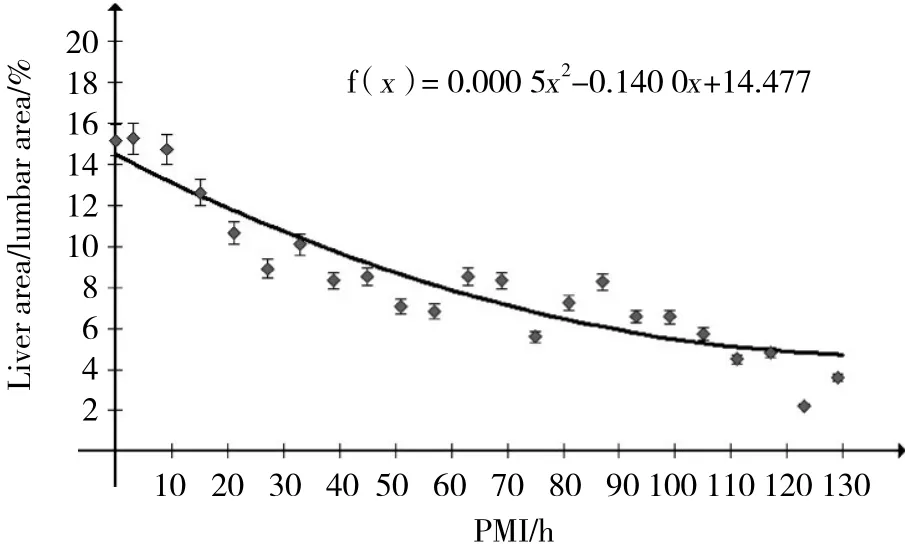
图2 家兔失血性休克死亡后肝脏面积/腰椎面积变化趋势图Fig.2 Regression analysis of the liver area/lumbar area ratio versus PMI
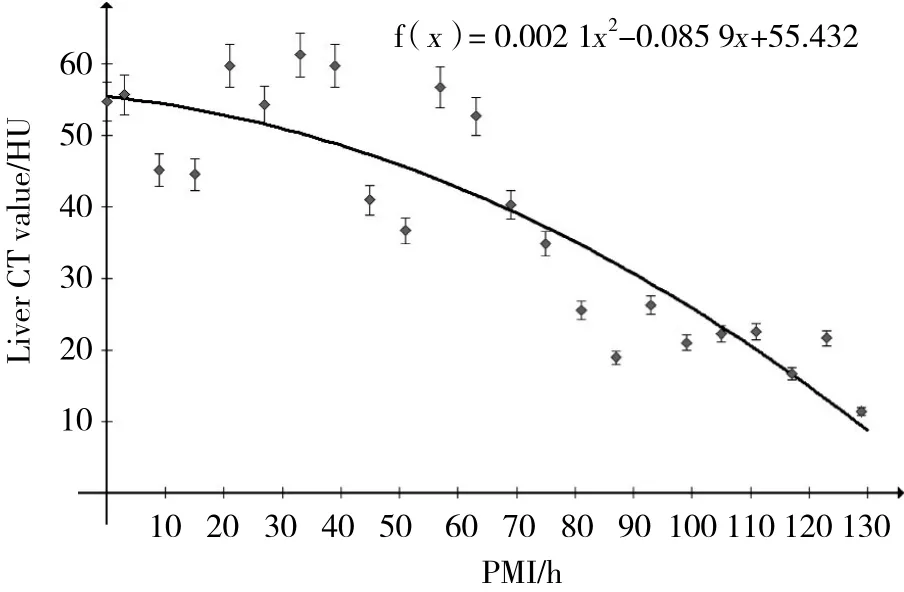
图3 家兔失血性休克死亡后129 h内肝脏平均CT值变化趋势图Fig.3 Regression analysis of the postmortem liver CT value versus PMI
虚拟解剖技术的发展与进步为法医学PMI推断提供了新的途径与方法。虚拟解剖主要借助于影像学的方法,CT便是目前影像学检查应用最为广泛且准确性较高的手段之一。CT检查可以按照各正常组织器官CT检查的影像学指标,选取任意层面、任意时间段的客观数据,过程简单迅速,结果稳定可靠,且不会对尸体造成任何毁坏[15],具有广泛的应用前景。肖坚等[16]最早采用CT影像学技术,对死亡后 0~120 h内新西兰白兔脑组织进行动态扫描,选取两冠状断层不同区域CT值平均值和脑组织/颅腔面积比作为研究数据,经数据分析,分别建立了CT值平均值和脑组织/颅腔面积比与PMI的回归方程,以用于早期PMI推断,同时也证明了CT用于PMI推断的可行性。BAYAT等[17]运用CT对61例尸体颅脑进行扫描,并实时观测上颌窦、左右眼球玻璃体液及左右侧脑室CT值随死后经过时间的变化趋势,结果表明,目标区域CT值均随PMI的延长而增高,认为此方法对于PMI的推断具有重要价值。KOOPMANSCHAP等[18]通过使用CT对6名尸体捐献者死后36 h内脑脊液和玻璃体液的放射密度每隔1 h进行检测,应用多元回归模型将相关影响因素 (温度) 计算在内后,得出了适用于PMI推断的线性回归方程,并用此方法对100例医院病死者及12例案件尸体 (具体死亡时间已知) 进行检测,证实PMI推断结果与已知具体死亡时间接近 (置信水平95%) 。
本研究正是在上述研究的基础上,借助CT优势,选择位于肝门区、相当于L1层面的肝脏影像作为研究对象,以避免动物个体差异及腹腔其他脏器对影像学观察及测量的影响。应用Max Viewer影像学分析软件分别测量L1层面肝脏面积及L1层面的腰椎 (包括髓腔) 的面积,并计算肝脏面积/腰椎面积;在所选取的L1层面肝脏区域 (用相互垂直2条直线分成4等分) 肝脏近腹侧和近背测量一定面积( 5 mm2)的CT值,并计算平均值。应用以上2项客观指标,研究其变化规律与PMI的关系。结果发现,家兔死亡后129 h内肝脏面积/腰椎面积随着PMI的延长呈现“相对不变-快速减小-缓慢减小”特征性变化趋势。此趋势可大致划分为以下3个阶段:家兔失血性休克死亡后39 h内肝脏各肝叶质地均匀,肝脏内无低密度影,肝脏前缘与腹壁紧贴,肝脏后缘与后腹壁之间有少量气体,肝脏中未见扩张充气的胆管,肝脏面积/腰椎面积无显著变化,即相对不变阶段;死后39 h~87 h之间,肝脏与胸腹分离,其四周充满气体,肝脏面积/腰椎面积显著下降,即快速下降阶段;87 h~129 h,肝脏各叶已分辨不清,肝脏组织呈散在的点斑片状,肝脏面积/腰椎面积缩小相对比较缓慢,即缓慢下降阶段。分析认为个体死后27 h内,肝组织自溶、腐败,但腐败气体还没有大量产生,肝脏面积并没有太大的变化,27 h以后肠道腐败细菌的大量繁殖,腹腔中腐败气体不断增加,肝脏在腐败细菌的作用下不断分解,肝脏面积/腰椎面积下降。肝脏中残存结缔组织不易分解,所以在死亡后87 h后,肝脏面积/腰椎面积下降又相对较慢。研究[19]表明肝脏面积/腰椎面积呈非线性变化,通过建立二项式回归方程发现肝脏面积/腰椎面积随PMI的变化趋势在快速下降阶段和缓慢下降阶段更加明显,相关性更高,提示肝脏面积/腰椎面积更适用于推断死后39~129 h的PMI。
本研究表明,家兔失血性休克死后129 h内肝脏组织平均CT值随着PMI的延长存在一定变化规律,总体呈现“先升高后降低”的变化趋势。此趋势可以概括为上升阶段和下降阶段2部分。通过统计学分析肝脏组织平均CT值相关系数r比较高,变化趋势体现在死亡后肝脏组织平均CT值一直升高,至死后27~39 h达到高峰,然后其平均CT值逐渐小。分析CT值上升阶段,可能是由于死亡后肝组织中蛋白质变性和水分丢失造成。而随着死后间隔时间延长,肝组织出现腐败区域、腐败气性区域增多,肝脏的CT值随之呈不断下降趋势。结合传统尸检结果,分析肝脏发生死后自溶、液化,肠道及肝脏胆道系统腐败细菌的大量繁殖,肝组织不断被腐败细菌吞噬,肝组织面积不断减小。利用肝脏CT值建立非线性回归方程发现,在曲线上升阶段,CT值随PMI变化趋势更加明显,相关性较高,提示平均CT值可以准确进行死后39 h内的PMI推断。
本研究还发现,CT值和肝脏面积/腰椎面积这2个参数对于死后经过时间推断准确性的适应阶段有所不同。前者在早期的PMI推断中更加准确,而后者对于中晚期的PMI推断则更加适用。由此可见,利用单一的1种指标推断PMI是存在缺陷的。因此,将两者相互结合、综合运用,可以弥补存在的缺陷,使PMI推断更具科学性、准确性和可操作性。
本研究在腐败进展较快的夏季 8月份( 25~32 ℃) 进行,主要反映了高温对尸体腐败的影响。CT影像学技术在国内医疗界已经广泛应用,也奠定了其在法医学实践中便于推广的应用基础[20]。今后的研究将致力于全面发挥放射影像学技术的优势,积极开展针对不同死因、不同环境条件下、不同组织器官的研究,为后续开展尸体研究积累丰富的经验和建立适用的客观指标。。
[1] 赵子琴. 法医病理学[M]. 3版. 北京:人民卫生出版社,2004:38-63.
[2] FLIGNER CL. Review of forensic medicine:fundamentals and perspectives [J]. J Forensic Sci,2015,59 (6) :1688. DOI:10.1111/1556-4029.12600.
[3] TAKATA T,KITAO T,MIYAISHI S. Relationship between post-mortem interval and creatine concentration in vitreous humour and cerebrospinal fluid [J]. Aust J Forensic Sci,2014,46 (2) :160-165. DOI:10.1080/00450618.2013.824027.
[4] THALI M. Virtual autopsy (virtopsy) in forensic science [J]. Pathologe,2011,32 (2) :292-295. DOI:10.1007/s00292-011-1520-5.
[5] 余艳红,赵克森,龚时鹏. 孕兔失血性休克动物模型的建立[J]. 中华围产医学杂志,2007 (3) :162-165. DOI:10.3760/cma.j.issn.1007-9408.2007.03.005.
[6] GRIMM H. Ethics in laboratory animal science [M]. Vienna:Springer,2014. DOI 10.1007/978-3-7091-1559-6_15.
[7] NABAVI DG,CENIC A,HENDERSON S,et al. Perfusion mapping using computed tomography allows accurate prediction of cerebral infarction in experimental brain ischemia [J]. Stroke,2001 32 (1) :175-183. DOI:10.1161/01.STR.32.1.175.
[8] RHEA JT,NOVELLINE RA. How to simplify the CT diagnosis of Le Fort fractures[ J]. AJR Am J Roentgenol,2005,184( 5) :1700-1705.DOI:10.2214/ajr.184.5.01841700.
[9] 杨安峰. 兔的解剖[M]. 北京:科学出版社,1979.
[10] WILLIMAS T,SONI S,WHITE J,et al. Evaluation of DNA degradation using flow cytometry:promising tool for postmortem interval determination[ J]. Am J Forensic Med Pathol,2015,36( 2) :104.DOI:10.1097/PAF.0000000000000146.
[11] PITTNER S,MONTICELLI FC,PFISTERER A,et al. Postmortem degradation of skeletal muscle proteins:a novel approach to determine the time since death[ J]. Dtsch Z Gesamte Gerichtl Med,2015,130( 2) :1-11. DOI:10.1007/s00414-015-1210-6.
[12] 赵伟,张敏,刘旭丹,等. 尸体心血红细胞ATP降解规律与早期死亡时间的相关性[J]. 中国法医学杂志,2014,29( 1) :1-3. DOI:10.13618/j.issn.1001-5728.2014.01.001.
[13] TAKATA T,KITAO T,MIYAISHI S. Relationship between post-mortem interval and creatine concentration in vitreous humour and cerebrospinal fluid[ J]. Aust J Forensic Sci,2014,46( 2) :160-165. DOI:10.1080/00450618.2013.824027.
[14] COSTA I,CARVALHO F,MAGALHAES T,et al. Promising blood-derived biomarkers for estimation of the postmortem interval[ J]. Toxicol Res,2015,4( 6) :1443-1452. DOI:10.1039/C5TX00209E.
[15] VILLA C,OLSEN K B,HANSEN SH. Virtual animation of victim-specific 3D models obtained from CT scans for forensic reconstructions:living and dead subjects[ J]. Forensic Sci Int,2017( 278) :e27-e33. DOI:10.1016/j.forsciint.2017.06.033.
[16] 肖坚,张会霞,骆昌政,等. 新西兰白兔死亡后颅脑CT检查与死亡时间关系的研究[J]. 中国法医学杂志,2006,21( 2) :82-84.DOI:10.13618/j.issn.1001-5728.2006.02.007.
[17] BAYAT AR,KOOPMANSCHAP D,KLEIN WM. Postmortem interval estimation:value of postmortem cerebral CT[ J]. J Forensic Radio Imaging,2014,2( 2) :98. DOI:10.1016/j.jofri.2014.02.013.
[18] KOOPMANSCHAP D,BAYAT AR,KUBAT B,et al. The radiodensity of cerebrospinal fluid and vitreous humor as indicator of the time since death[ J]. Forensic Sci Med Pathol,2016,12( 3) :248-256.DOI:10.1007/s12024-016-9778-9.
[19] 吴玉锋,祝志伟,潘莲莲,等. 晚期尸体现象推断死亡时间49例分析[J]. 法医学杂志,2012,28( 6) :435-437. DOI:10.3969/j.issn.l004-5619.2012.06.009.
[20] WILLEMINK MJ,DAN HARDER AM,DE JONG PA,et al. The future of the CT scan:will CT replace conventional radiography?[ J].Nederlands Tijdschrift Voor Geneeskunde,2014,158:A7438.

