轻度子宫内膜异位症患者全胚冷冻后首次冻融胚胎移植助孕结局分析
王芳,柯雪,李敏
(成都市妇女儿童中心医院生殖中心,成都 610073)
子宫内膜异位症(简称内异症,EMs)是生育期妇女不孕症的常见原因,EMs合并不孕的发生率高达40%~50%[1]。据统计,不孕的EMs患者中,仅有32%为中-重度EMs,其余68%为轻度EMs,提示轻度EMs已成为影响育龄期妇女妊娠的一大难题[2]。目前对于EMs合并不孕症的主要治疗方式为手术治疗和助孕治疗,体外受精-胚胎移植(IVF-ET)是EMs腹腔镜术后仍然不孕的重要助孕方法。本研究通过对比我中心7年来全胚冷冻后首次冻融胚胎移植(FET)及新鲜胚胎移植的轻度EMs患者助孕结局,探讨更适于轻度EMs患者的胚胎移植方案。
资料与方法
一、研究对象及分组
回顾性分析2010年1月至2017年7月于成都市妇女儿童中心医院生殖中心因EMs行IVF助孕的521个周期。根据冻胚移植和鲜胚移植的不同分为研究组和对照组,研究组为全胚冷冻后首次行FET的419个周期,FET方案仅纳入降调后人工周期方案,即月经期给予长效促性腺激素释放激素激动剂(GnRH-a,贝依,上海丽珠制药)3.75 mg皮下注射降调后再行人工周期;对照组为同期的102个新鲜胚胎移植周期(简称鲜胚移植周期)。研究组及对照组病例纳入标准:育龄妇女(年龄<38岁),不孕原因为EMs(既往经腹腔镜手术术中证实)且术后1年仍未孕,根据改进后的美国生育协会内异症分期系统(rASRM分期)及Johnson等[3]最新提出的生育指数(EFI)评分系统符合轻度EMs的患者。排除标准:(1)合并多囊卵巢综合征或卵巢储备功能低下;(2)子宫畸形、卵巢非内膜异位囊肿等器质性病变;(3)双方任意一方染色体异常;(4)有抽烟史,或存在高血压、糖尿病等基础疾病者。
二、研究方法
1. 控制性促排方案:控制性促排方案为超长方案(于月经第2~3天以长效GnRH-a 3.75 mg皮下注射,28 d后重复注射第2支GnRH-a 3.75 mg)、改良超长方案(于月经第2~3天以长效GnRH-a 1.875 mg皮下注射,28 d后重复注射第2支GnRH-a 1.5 mg)及长效长方案(月经期或黄体期以长效GnRH-a 1.875 mg皮下注射)。对照组采用同样的控制性促排方案。
2. ET:存在宫腔内膜不利因素,如子宫内膜息肉、粘膜下子宫肌瘤(冻胚移植前均行宫腔镜检查,并病检证实),及停药日血清孕酮(P)值升高、存在卵巢过度刺激风险及其它因素(个人因素、内膜偏厚等)者行FET。FET内膜准备方案:于月经第2~3天以长效GnRH-a 3.75 mg皮下注射,20 d后查血FSH、E2、P、LH并行B超检查,如达到降调节标准[4](FSH≤5 U/L,E2≤183 pmol/L,LH≤5 U/L,双侧卵巢窦卵泡直径5~6 mm,子宫内膜厚度≤5 mm,且未发现直径>10 mm的卵泡),即开始启动人工周期内膜准备。口服戊酸雌二醇(补佳乐,Delpharm Lille SAS公司,德国)2 mg/d或雌二醇/雌二醇地屈孕酮片(芬吗通,Abbott Biologicals B.V.公司,荷兰)红片2 mg/d,根据子宫内膜厚度适当调整药物剂量,最大剂量8 mg/d,平均使用12~16 d,超声监测内膜厚度≥8 mm时转化内膜,4 d后行FET。
对照组当B超提示至少3个主导卵泡直径≥18 mm时,予HCG 5 000~10 000 U肌肉注射,36~38 h后取卵,并于3 d后移植。
3. 胚胎评级及冻融胚胎移植标准:入组胚胎均为卵裂期胚胎,排除囊胚复苏后移植。胚胎评级标准[5]:Ⅰ级胚胎:7~10个细胞,大小均一,碎片<5%;Ⅱ级胚胎:7~10个细胞,大小均一,碎片5%~20%;Ⅲ级胚胎:5~10个细胞,碎片21%~49%;Ⅳ级胚胎:碎片>50%。FET移植标准:Ⅰ~Ⅲ级为可移植胚胎。
4. 主要观察指标:助孕前癌胚抗原(CA-125)下降幅度(术前CA-125与术后应用GnRH-a治疗后CA-125之差);临床妊娠率(临床妊娠周期数/移植周期数×100%);活胎分娩率(活胎分娩周期数/移植周期数×100%)。
三、统计学分析
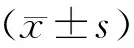
结 果
一、两组患者一般资料比较
研究组及对照组的年龄、不孕年限、不孕类型、窦卵泡数目(AFC)、腹腔镜术前CA-125值、体重指数(BMI)、抗苗勒氏管激素(AMH)及临床病理类型比较均无显著性差异(P>0.05),组间具有可比性。研究组助孕前CA-125下降幅度显著低于对照组(P<0.05);腹腔镜术后GnRH-a治疗周期比例显著高于对照组(P<0.05)(表1)。

表1 研究组及对照组一般资料比较[(-±s),n(%)]
注:与对照组比较,*P<0.05
二、研究组与对照组实验室指标及临床妊娠结局比较
两组患者基础FSH、基础E2比较,均无显著性差异(P>0.05);Gn用量(支)及Gn天数、HCG日E2、HCG日P、移植日子宫内膜厚度、获卵数、卵母细胞成熟率、正常受精率、卵裂率、移植优胚率比较均无显著性差异(P>0.05)。两组间各控制性促排方案比例比较无显著性差异(P>0.05)。研究组优质胚胎率显著低于对照组(P<0.05)。两组间胚胎种植率、临床妊娠率、异位妊娠率、多胎发生率比较均无显著性差异(P>0.05)。研究组早期流产率显著低于对照组,而活胎分娩率显著高于对照组(P均<0.05)(表2)。
三、影响妊娠结局的多因素Logistic回归分析
以EMs患者早期流产率及活胎分娩率为因变量,将研究组和对照组比较具有统计学差异的因素,包括助孕前CA-125下降幅度、术后GnRH-a治疗比例、优质胚胎率作为自变量,进行多因素非条件Logistic逐步回归分析(引入水准为0.05,排除水准为0.10),结果显示,各因素均非早期流产率及活胎分娩率的影响因素(P>0.05)(表3、表4)。

表2 研究组与对照组实验室指标及临床妊娠结局比较[(-±s,%]
注:与对照组比较,*P<0.05
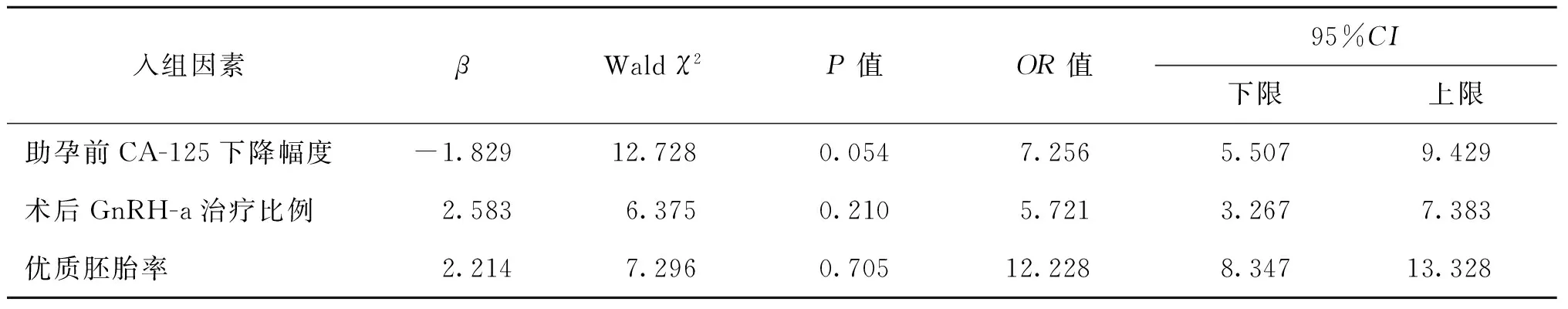
表3 影响早期流产率的多因素Logisitic回归分析

表4 影响活胎分娩率的多因素Logisitic回归分析
讨 论
全胚冷冻后FET与新鲜胚胎移植的妊娠结局比较一直是国内外生殖领域的研究热点,对高龄、多囊卵巢综合征冷冻周期与新鲜周期胚胎移植妊娠结局的对比国内已有文献阐述[6-7],但对于EMs全胚冷冻后首次FET与新鲜胚胎移植的比较国内外还鲜有报道。目前普遍认为,重度EMs可造成卵巢储备功能的下降,或影响卵母细胞质量,因此,本研究并未纳入中重度EMs进行分析。使用rASRM分期及Adamson最新提出的EFI评分系统,两种评分法均对EMs的严重程度进行了划分,但前者缺乏术后生育力的评估,后者可作为预测EMs不孕女性生育结局的有效指标[8],随着EFI评分分数的增加,妊娠率也逐渐增加,EFI评分>5分,即术后可行期待治疗或辅助助孕[9],筛选出符合轻度EMs的患者进行分析,所有周期入组标准均为术后1年仍未妊娠者,以避免因术后试孕时间不足导致的数据偏倚。
对比研究组与对照组的基本资料,两组间助孕前GnRH-a治疗周期比例差异具有统计学意义。2014年欧洲人类生殖与胚胎学会(ESHRE)指南[10]并不建议EMs患者术后使用药物治疗,Surrey等[11]认为鲜胚移植前的GnRH-a应用可能改善妊娠结局,在FET周期前应用GnRH-a可以改善异常子宫内膜整合蛋白的表达,避免过度的卵巢抑制,同样可提高临床妊娠率。但该论著并未进行轻中重度EMs的分层分析。本研究选取的周期均为术后周期,虽发现全胚冷冻后首次FET组术后GnRH-a治疗周期比例高于新鲜胚胎移植组,但两组间生化妊娠率及临床妊娠率并无显著差异,将术后GnRH-a治疗纳入对早期流产率及活胎分娩率差异的多因素Logistic回归进行分析,也并非影响因素,与上述研究结论相反,即术前GnRH-a的应用对提高辅助生殖成功率并不存在显著优势,分析原因:(1)GnRH-a的作用机制包括:减少破碎的内膜异位到盆腔的几率,激活组织细胞损伤后修复(TIAR)[12],降低异位病灶暴露于肝素结合细胞因子及凝血酶的机会。另外,轻度EMs的病灶覆盖面小,且EMs类型并非是影响助孕结局的因素,因此上述GnRH-a抑制作用可能对轻度EMs患者并无明显治疗作用。(2)患者术后均超过1年才选择IVF助孕,此时很有可能病变已复发,且缺乏每位患者具体用药时间和疗程的病例资料,因此,对药物抑制效果的研究有待进一步的大样本研究探讨。
本研究结果发现FET周期的优质胚胎率显著低于鲜胚移植周期,但尚未构成临床妊娠结局的影响因素。这与部分学者认为优质胚胎占比在FET中并不明显影响妊娠结局的观点一致[13],Carvalho等[14]将309个冷冻周期及134个新鲜周期进行对比后发现,新鲜周期组优质胚胎与非优质胚胎比较,胚胎种植率、临床妊娠率、活产率前者均显著高于后者(P<0.05);冷冻周期组中,胚胎种植率优质胚胎组虽然显著低于非优质胚胎组(P<0.05),但临床妊娠率和活产率并无显著性差异(P>0.05)。提示在FET周期中,胚胎的质量及分层对妊娠结局的影响可能是相似的,与本研究结论相似,轻度EMs全胚冷冻组解冻复苏后优质胚胎率低于鲜胚移植组,但临床妊娠率无显著差异,早期流产率更低,活胎分娩率更高,且优质胚胎率并非为早期流产率及活胎分娩率的影响因素。可能的原因有:影响妊娠结局的因素主要是新鲜周期控制性促排卵对子宫内膜容受性的负面影响。Padmanabhan等[15]认为,超生理接受度的类固醇激素对胚胎种植率产生负面影响的原因是胞饮突的升高,种植过程组织学特征的变化,导致胚胎发育与内膜不同步性的发生。孕激素受体的下调在腺体和间质细胞中出现,导致腺体和间质成熟窗开启不同步,继而影响新鲜周期助孕成功率。而未被高雌激素刺激的FET周期内膜适用于任何发展阶段的胚胎,更有利于胚胎发育,降低了早期流产率。但本研究未进行冷冻胚胎解冻前胚胎评分与鲜胚移植胚胎评分的对比,可能存在数据的偏倚。
轻度EMs患者活胎分娩率在鲜胚及冻胚移植中的区别,国内外文献还少有阐述。Toftager等[16]对EMs患者284个IVF周期进行了分析,发现对于新鲜周期而言,如选择拮抗剂方案,临床妊娠率及活胎分娩率均较长方案增高(分别为25% vs. 13%,18% vs. 8%,P<0.05);而对于冻胚移植周期,促排卵方案则不是影响妊娠结局的主要因素,妊娠率及活产率无明显区别。但该研究未对EMs严重程度进行分层分析。本研究两组间控制性促排卵各种方案比例无统计学差异,对于轻度EMs患者冻胚移植似乎活胎分娩率更高,但缺乏各种促排方案妊娠结局的比较,有待扩大样本后进一步分析验证。
目前,多数研究认为使用CA-125单独评判EMs严重程度的敏感性并不准确[17]。本研究两组间术前CA-125对比差异无统计学意义,而助孕前CA-125下降幅度比较有显著差异,虽然鲜胚移植助孕前CA-125下降幅度更大,但二组值均在正常范围内,这种差异并未提升该组的临床妊娠率,因此,我们认为CA-125对妊娠结局是否有影响意义还需更深入的研究证实。
综上所述,本研究认为轻度EMs患者行IVF助孕,全胚冷冻后首次FET助孕与鲜胚移植临床妊娠率无明显差异,早期流产率更低,活胎分娩率更高,不足之处为FET内膜准备方案均为全量降调后人工周期方案,未纳入自然周期,存在一定局限;此外,Gn天数长、用药量偏大,获卵数偏多是我中心的缺陷,需更大样本的回顾性研究进一步深入验证轻度EMs患者的最佳移植方案。
[1] Becker CM,Gattrell WT,Gude K,et al. Reevaluating response and failure of medical treatment of endometriosis:a systematic review[J]. Fetril Stetil,2017,108:125-136.
[2] Haas D,Shebl O,Shamiyeh A,et al. The rASRM score and the Enzian classification for endometriosis:their strengths and weaknesses[J]. Acta Obstet Gynecol Scand,2013,92:3-7.
[3] Johnson NP,Hummelshoj L,Adamson GD,et al. World endometriosis society consensus on the classification of endometriosis[J]. Hum Reprod,2017,32:315-324.
[4] Kolanska K,Cohen J,Bendifallah S,et al. Pregnancy outcomes after controlled ovarian hyperstimulation in women with endometriosis-associated infertility:GnRH-agonist versus GnRH-antagonist[J]. J Gynecol Obstet Hum Reprod,2017,46:681-686.
[5] European IVF-Monitoring Consortium(EIM),European Society of Human Reproduction and Embryology(ESHRE),Kupka MS,et al. Assisted reproductive technology in Europe,2011:results generated from European registers by ESHRE[J]. Hum Reprod,2016,31:233-248.
[6] 李玉梅,桂宝恒,刘冬娥. 高龄患者全胚冷冻后行解冻胚胎移植妊娠结局分析[J]. 生殖医学杂志,2015,24:601-605.
[7] Chen YH,Wang Q,Zhang YN,et al. Cumulative live birth and surplus embryo incidence after frozen-thaw cycles in PCOS:how many oocytes do we need?[J]. J Assist Reprod Genet,2017,34:1153-1159.
[8] Li X,Zeng C,Zhou YF,et al. Endometriosis fertility index for predicting pregnancy after endometriosis surgery[J]. Chin Med J(Engl),2017,130:1932-1937.
[9] Zhang C,Yuan X,Zhang Y. The co-expression of GPER and Gankyrin in ovarian endometriosis and its correlation with the rASRM stages[J].Arch Gynecol Obstet,2016,293:133-141.
[10] Dunselman GA,Vermeulen N,Becker C,et al. ESHRE guideline:management of women with endometriosis[J]. Hum Reprod,2014,29:400-412.
[11] Surrey ES,Katz-Jaffe M,Kondapalli LV,et al. GnRH agonist administration prior to embryo transfer in freeze-all cycles of patients with endometriosis or aberrant endometrial integrin expression[J/OL]. Reprod Biomed Online,2017,35:145-151.
[12] Leyendecker G,Wildt L. A new concept of endometriosis and adenomyosis:tissue injury and repair(TIAR)[J]. Horm Mol Biol Clin Investig,2011,5:125-142.
[13] 王智超,朱亮. 子宫内膜异位症合并不孕患者经体外受精/卵胞质内单精子注射-胚胎移植治疗后妊娠结局及相关因素的分析[J]. 中华生殖与避孕杂志,2017,3:222-226.
[14] Carvalho BR,Barbosa MW,Bonesi H,et al. Embryo stage of development is not decisive for reproductive outcomes in frozen-thawed embryo transfer cycles[J]. JBRA Assist Reprod,2017,21:23-26.
[15] Padmanabhan RA,Laloraya M. Estrogen-initiated protein interactomes during embryo implantation[J]. Am J Reprod Immunol,2016,75:256-262.
[16] Toftager M,Bogstad J,Løssl K,et al. Cumulative live birth rates after one ART cycle including all subsequent frozen-thaw cycles in 1050 women:secondary outcome of an RCT comparing GnRH-antagonist and GnRH-agonist protocols[J]. Hum Reprod,2017,32:556-567.
[17] Hirsch M,Duffy JMN,Deguara CS,et al. Diagnostic accuracy of Cancer Antigen 125(CA125)for endometriosis in symptomatic women:A multi-center study[J]. Eur J Obstet Gynecol Reprod Biol,2017,210:102-107.

