ASCVD患者EB病毒感染与急性心力衰竭发病的相关性
陈明, 熊阿莉, 陈迎春
(1华中科技大学同济医学院附属武汉中心医院,武汉430014;2江汉大学附属医院武汉市第六医院)
动脉粥样硬化性心血管疾病(ASCVD)是心脏疾病中患病率最高的疾病,其继发的急性心力衰竭(AHF)严重威胁生命安全[1]。研究发现,免疫炎症促发的脂代谢紊乱和血栓是ASCVD形成和AHF急性发生的病理基础。单核细胞和抗原呈递细胞是免疫炎症介入ASCVD的病程急性发作的重要执行者[2]。EB病毒(EBV)又名淋巴细胞成瘤[3],其致病性与患者免疫水平密切相关,具体机制与诱发机体急剧的炎症反应有直接关系[4],其中单核细胞增多是EBV感染后机体免疫反应的典型症状之一。在近期的国内临床研究发现,EBV感染与心血管疾病相关[5]。本研究拟探讨ASCVD患者EBV感染与AHF发病的相关性。
1 资料与方法
1.1 临床资料 选取2015年9月~2016年9月华中科技大学同济医学院附属武汉中心医院ASCVD 患者159例,全部为男性,年龄(52.22±13.45)岁,其中EBV阳性79例,EBV阴性80例,AHF 81例。EBV阳性诊断标准按照《EB病毒相关疾病的诊断标准和治疗原则》;AHF诊断标准按照《2005年心血管疾病诊疗指南》。排除细菌及真菌感染性心血管疾病、先天性心脏病、营养缺乏性心脏病、贫血性心脏病、实体瘤和血液病肿瘤、同时排除其他病毒感染(艾滋病病毒、肝炎病毒等)。本研究由华中科技大学附属武汉市中心医院伦理委员会批准。
1.2 研究方法 患者入院后采集静脉全血,离心分离血清和血浆进行分析。采用荧光定量PCR方法检测全血中EBV-DNA载量;免疫比浊法在奥林巴斯AU5432上测定血清C反应蛋白(CRP);采用免疫比浊法在Sysmex CA-7000上检测血浆D二聚体(D-dimer);采用免疫化学发光法在雅培i-2000上检测血浆B型脑钠尿肽(BNP)和血清白细胞介素-6(IL-6)。比较EBV阳性及阴性患者AHF发病率,AHF与未发生AHF患者EBV-DNA载量,AHF与未发生AHF的EBV阳性及阴性患者BNP、IL-6、CRP、D-dimer水平。
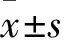
2 结果
2.1 EBV阳性及阴性患者AHF发病率比较 EBV阳性及阴性患者发生AHF分别为 55及26例,EBV阳性患者AHF发病率(69.62%)高于EBV阴性患者(32.50%)。
2.2 AHF与未发生AHF患者EBV-DNA载量比较 AHF发生与AHF未发生的EBV-DNA阳性患者的病毒载量比较发现,AHF患者EBV-DNA载量[Log(5.84±2.60) copy]高于未发生AHF患者[Log(1.92±0.48) copy](P<0.05)。
2.3 AHF与未发生AHF的EBV阳性及阴性患者BNP水平比较 AHF患者EBV阳性的BNP水平[(522.54±232.21)pg/mL]高于EBV阴性患者[(35.66±4.33)pg/mL](P<0.05);而未发生AHF 患者EBV阳性的BNP水平[(121.23±40.22)pg/mL]高于EBV阴性患者[(87.23±15.66)pg/mL](P<0.05)。
2.4 AHF与未发生AHF的EBV阳性及阴性患者IL-6、CRP水平比较 AHF患者EBV阳性的IL6、CRP水平[(75.34±8.99)pg/mL、(123.12±23.22)mg/L]均高于EBV阴性患者[ (35.66±4.33)pg/mL、(45.23±8.34)mg/L](P均<0.05);而未发生AHF 患者EBV阳性的IL-6、CRP水平[(23.67±5.49)pg/mL、(31.00±5.60)mg/L]也高于EBV阴性患者[(11.45±3.43)pg/mL、(4.50±1.02)mg/L] (P均<0.05)。
2.5 AHF与未发生AHF的EBV阳性及阴性患者D-dimer水平比较 AHF患者EBV阳性的D-dimer水平[(15.30±4.54)mg/L]均高于EBV阴性患者[(2.81±0.32)mg/L](P均<0.05);而未发生AHF 患者EBV阳性的D-dimer水平[(1.78±1.29)mg/L]也高于EBV阴性患者[(0.33±0.32)mg/L](P<0.05)。
2.6 相关性分析 相关性分析显示,EBV-DNA载量与BNP、IL-6、CRP、D-dimer水平均呈正相关(r分别为0.76、0.95、0.92、0.77,P均<0.05);D-dimer与IL-6、CRP水平均呈正相关(r分别为0.67、0.76,P均<0.05)。
3 讨论
心脑血管疾病是目前导致人类死亡与残疾的主要疾病之一,严重地危害了人类生命健康。既往对ASCVD病因学研究集中于脂肪代谢紊乱的研究上[6],在临床观察和动物实验研究中发现,低密度脂蛋白堆积和脂质的过氧化在ASCVD病程的发生发展中关系密切,进一步的深入研究发现,免疫炎症的损伤贯穿了ASCVD的发生和发展进程中。EBV又名淋巴细胞成瘤,它是一种条件致病性病毒,即在患者免疫能力低下时由潜伏状态跃变为致病病原体,诱发机体急剧的炎症反应[7]。EBV是人疱疹病毒中引起免疫功能障碍和肿瘤发生的重要病因之一。EBV常期潜伏感染于B淋巴细胞中,引起机体发生传染性单核细胞增多症,严重者引起噬血淋巴细胞增生症,在这些患者发病中过度的炎症反应是EBV造成危害重要病理特征。EBV成人感染的研究,多集中于血液肿瘤和器官移植的预后控制研究中,在近期的病例报道中发现EBV与血栓的形成密切相关[8]。
AHF是ASCVD致死的重要原因之一,目前其有效地治疗策略主要是早期诊断及时干预,所以本研究从AHF的炎症病因角度出发,开展ASCVD患者AHF预防性研究, 以感染EBV的ASCVD患者为研究模型,探讨EBV感染诱发的炎症对于AHF的影响及相关炎症通路的变化。研究发现,EBV-DNA阳性的AHF发病率高于EBV-DNA阴性,提示EBV-DNA与AHF发生相关。由于AHF发生与血栓密切相关,研究发现AHF临床量化诊断指标BNP与血栓预测指标D-dimer正相关。本研究发现EBV-DNA与D-dimer和BNP存在线性正相关,结果提示ASCVD患者EBV感染可能通过诱导血栓形成,最终引发AHF的发生。
EBV启动炎症反应中,可通过炎症因子加重活化的巨噬细胞对内皮细胞的损伤[9]。另外,EBV感染改变“凝血-炎症”复合免疫防御系统平衡,导致凝血功能失常和炎症加重[10],其中动脉粥样硬化(AS)患者EBV感染后炎症效应明显增强[11],弥散性血管内凝血[12]显著增高就是明显证据。在炎症参与ASCVD的发生发展过程的机制研究中,发现炎症反应通路上,单核和巨噬细胞被激活后产生大量的肿瘤坏死因子-α,继而上调IL-6诱导肝脏CRP大量分泌,最终促进血栓形成,另外吞噬细胞积极参与脂代谢,为血管内斑块形成和增大提供足够泡沫,在通过对这条炎症反应通路进行干预,发现可以有效地降低AS进一步恶化[13]。
本研究根据ASCVD发病进程中的炎症通路,分析了炎症因子IL-6和CRP与EBV-DNA载量的关系,发现EBV-DNA载量与炎症因子之间存在密切相关性;炎症因子IL-6、CRP与D-dimer也呈正相关,结果提示了EBV感染诱发炎症因子水平升高,而炎症因子促进机体凝血-炎症调控失衡,同时EBV感染患者较高的炎症反应加重ASCVD患者的血管损伤[14,15],且较高的炎症反应直接加快了血栓的形成和心血管系统组织的损伤坏死,本研究中血栓预测因子D-dimer和AHF预测因子BNP与EBV-DNA的线性正相关提示了这一点。
综上所述,ASCVD患者EBV感染可能提高AHF发生的风险, 具体机制可能是EBV感染诱发的炎症因子上调促进了血栓形成,在临床上ASCVD患者EBV感染时,需要密切观察和控制炎症的进展以及血栓形成的监测,以降低AHF发生等不良心血管事件的发生。
参考文献:
[1] Murray CJ, Vos T, Naghavi M, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet, 2012, 380 (9859 ):2197-223.
[2] Yamashita T, Sasaki N, Kasahara K, et al. Anti-inflammatory and immune-modulatory therapies for preventing atherosclerotic cardiovascular disease[J]. J Cardiol, 2015,66(1):1-8
[3] Wang Y, Zhang X, Chao Y, et al. New variations of Epstein-Barr virus-encoded small RNA genes in nasopharyngeal carcinomas, gastric carcinomas, and healthy donors in northern China[J].J Med Virol, 2010,82(5):829-36.
[4] Worth AJ, Houldcroft CJ, Booth C. Severe Epstein-Barr virus infection in primary immunodeficiency and the normal host[J].Br J Haematol, 2016,175(4):559-576.
[5] 方军, 邓耀, 唐艺加. EBV感染患者心血管疾病发病的临床分析[J].四川医学, 2015,36(8):1102-1105.
[6] Stone GW, Maehara A, Lansky AJ, etal. A prospective natural-history study of coronary atherosclerosis[J]. N Engl J Med, 2011 , 364(3):226-35.
[7] Iwakiri D, Takada K. Role of EBERs in the pathogenesis of EBV infection[J]. Adv Cancer Res, 2010,107:119-36.
[8] Engert A, Balduini C, Brand A, et al. The European Hematology Association Roadmap for European Hematology Research: a consensus document[J]. Haematologica, 2016,101(2):115-208.
[9] Waldman WJ, Williams MV Jr, Lemeshow S, etal. Epstein-Barr virus-encoded dUTPase enhances proinflammatory cytokine production by macrophages in contact with endothelial cells: evidence for depression-induced atherosclerotic risk[J]. Brain Behav Immun, 2008, 22(2):215-23.
[10] Cai Q, Chen K, Young KH. Epstein-Barr virus-positive T/NK-cell lymphoproliferative disorders[J]. Exp Mol Med, 2015,47:e133.
[11] Ucar M, Karakas MS, Bayrak M, et al. Early thrombus formation in patient with Heart Ware left ventricular assist device presenting with acute heart failure[J]. J Saudi Heart Assoc, 2016,28(1):49-51.
[12] O'Connor DS, Elmariah S, Aledort LM, et al. Disseminated intravascular coagulation complicating Epstein-Barr virus infection in a cardiac transplant recipient: a case report[J]. Transplant Proc, 2010,42(5):1973-5.
[13] Everett BM, Pradhan AD, Solomon DH, et al. Rationale and design of the Cardiovascular Inflammation Reduction Trial: a test of the inflammatory hypothesis of atherothrombosis[J]. Am Heart J , 2013, 166:199-207.
[14] Brown WV, Remaley AT, Ridker PM. JCL Roundtable: is inflammation a future target in preventing arteriosclerotic cardiovascular disease[J]. J Clin Lipidol, 2015,9(2):119-28.
[15] Rickinson AB. Co-infections, inflammation and oncogenesis: future directions for EBV research[J]. Semin Cancer Biol, 2014, 26:99-115.

