人参黄芩配伍对多发性脑梗塞性痴呆模型大鼠脑能量的影响*
付 颖,高丽娟,夏 鹏,文跃强,徐世军**
(1.成都中医药大学药学院 成都 611137;2.成都中医药大学中医脑病药物整合转化研究所 成都 611137;3.成都中医药大学基础医学院 成都 61137)
多发性脑梗塞性痴呆(Multi-infarct Dementia,MID)是一种因缺血性或脑血管疾病而造成的认知功能障碍综合征[1],其发病机制涉及兴奋性氨基酸毒性、线粒体功能紊乱、能量代谢障碍、氧化应激、细胞凋亡等[2]。它是继阿尔茨海默症(Alzheimer's disease,AD)后第二大痴呆症型,也被认为是目前唯一可以防治的痴呆类型[3]。血管系统受阻或病变引起脑内尤其是认知区域供血不足是MID患者认知下降的重要原因[4]。脑内能量主要源于葡萄糖的外周摄入,供血不足导致脑内能量低下,线粒体是成直接能源物质三磷酸腺苷(ATP)的主要场所,同时参与细胞分化、信息传递生理活动[5]。当机体线粒体功能障碍时,除可引起产能不足外,它还诱发氧化应激、线粒体自噬、细胞凋亡等[6-7],这些病变反过来加剧了MID病变程度及认知下降。人参黄芩配伍是《外台秘要》黄芩人参汤,原方主治“伤寒吐下后,内外有热,烦渴不安”,二者配伍体现了中医益气解毒治则,且二者临床多以组方形式用于治疗老年痴呆,如:参芪醒脑颗粒,柴胡加龙骨牡蛎汤,黄连解毒汤联合天王补心丹等[8-11]。人参皂苷和黄芩苷具有改善痴呆模型学习记忆的作用,但二者配伍后能否干预多发性脑梗塞性痴呆鲜见报道。
1 材料
1.1 实验动物
SD大鼠,雄性,SPF级,50只,体质量(200±20)g,由成都达硕实验动物有限公司提供,实验动物合格证编号:NO.51203500003215。
1.2 药物与试剂
黄芩、人参等比配伍,加6倍量水浸泡1 h后煎煮3次,每次煎煮1.5 h,合煎液,粗滤后80℃浓缩至0.22 g·mL-1,4℃保存备用。甲磺酸双氢麦角毒碱片(喜得镇),天津华津制药有限公司制造,批号:7C883T;三磷酸腺苷二钠盐、二磷酸腺苷二钠盐、单磷酸腺苷二钠盐均购置自sigma公司。
1.3 主要仪器
Morris水迷宫分析系统(WMT-100,成都泰盟科技有限公司),Agilent高效液相色谱仪(1260,Agilent公司),流式细胞仪(ZE5,Bio-Rad公司),DM1000徕卡显微成像系统(德国,Leica)。
2 方法
2.1 模型制备及分组
取健康SPF级SD大鼠,适应性喂养3 d,采用微血栓栓塞法[12]制备MID模型,假手术组注射等体积的生理盐水。造模2周后,根据体重和“Y”迷宫评价的学习记忆水平将模型大鼠随机分为4组,即模型组(Model)、喜得镇组(Hydergine)(0.7 mg·kg-1)、人参黄芩高剂量组(CRHG,2.22 g·kg-1)和人参黄芩低剂量组(CRHD,1.11 g·kg-1),每组10只,10只假手术大鼠作为对照组,分组后按照10 mL·kg-1每天1次灌胃给予相应药物,假手术组(Sham)和模型组给予等体积的生理盐水,连续灌胃45天。
2.2 Morris水迷宫检测学大鼠习记忆功能
定位航行实验:给药第40天开始进行为期5天的连续定位航行训练,每天训练2次,记录其在60 s内找到平台的时间(逃避潜伏期)。超过60 s找不到平台,引导其找到平台并在平台停留10 s,逃避潜伏期记成60 s。
空间探索实验:定向航行实验结束24 h后,撤除平台,将大鼠从相同位置放入迷宫,系统同步记录60 s内大鼠的运动轨迹,记录穿越平台次数。
2.3 海马病理形态学检测
空间探索结束后处死大鼠,冰浴取脑,左半脑用4%多聚甲醛固定,常规脱水、包埋、切片、HE染色、封片,显微镜观察大鼠海马CA1区神经细胞形态。
2.4 线粒体肿胀度和膜电位检测
采用流式细胞仪检测线粒体肿胀度和膜电位。将适量脑组织制成单细胞悬液并调整为105个/mL;取1 mL的细胞悬液离心,弃上清液后每管加入500 μl的JC-1工作液重悬,37℃孵育15 min后清洗两次并收集沉淀,然后再加入500 μl缓冲液重悬混匀后上机检测检测线粒体肿胀度;取适量脑组织单细胞悬液,调整为106个/mL,加入 5 μl JC-1染液至100 μl样本中,37℃孵育15 min,PBS清洗后收集沉淀物,然后加入300-400 μl JC-1专用稀释液重悬混匀后上机检测线粒体膜电位,采用KALUZA软件分析检测结果。
2.5 海马ATP、ADP、AMP测定
取适量海马组织,加入生理盐水(海马重∶生理盐水体积=1∶10),冰浴匀浆,取0.6 mL匀浆液,加入等体积0.5 mol·L-1高氯酸涡旋仪涡旋混匀,4℃12000xg离心10 min。取上清液0.8 mL,用NaOH(5 mol·L-1)调PH至中性,静置30 min,4℃12000xg离心10 min。取上清液直接进样,HPLC梯度洗脱,测定AMP、ADP、ATP的含量。色谱条件:ODSHYPERSIL C18色谱柱(5 μm,250 mm×4.6 mm),柱温25℃;流动相0.05 mol/L磷酸缓冲盐溶液(pH=6.5);流速1.0 mL·min-1;样品室温10℃;进样体积10 μL;紫外检测波长254 nm。根据公式计算能荷值:EC= ([ATP]+0.5[ADP])/([ATP]+[ADP]+[AMP])。
2.6 数据统计与分析
数据以“均数±标准差”(xˉ± S)表示,Morris水迷宫逃避潜伏期用双因素(two-way ANOVA)Tukey's多重比较分析,符合正态分布的数据采用单因素方差分析(one-way ANOVA),不符合正态分布的数据采用非参数秩和检验。
3 结果
3.1 人参黄芩配伍对模型大鼠学习记忆能力的影响
如图1所示,随着训练时间的增加,各组大鼠逃避潜伏期均有不同程度的缩短。与假手术组比较,模型组大鼠逃避潜伏期明显延长,穿越平台次数则明显减少(P<0.05);与模型组比较,人参黄芩配伍组逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增多(P < 0.05)。
3.2 人参黄芩配伍对模型大鼠海马CA1区病理形态学的影响
与假手术组比较,模型组海马CA1区椎体神经细胞排列稀疏,细胞数目减少,结构不完整,可见明显的神经细胞坏死及细胞变性(P<0.05);与模型组比较,人参黄芩配伍组神经细胞排列稀疏有明显改善,神经细胞坏死和细胞变性明显改减轻(P<0.05)(图2)。

图1 人参黄芩配伍对MID模型大鼠学习记忆能力的影响(n=6)

图2 人参黄芩配伍对MID模型大鼠海马CA1区病理形态学影响(n=6)
3.3 人参黄芩配伍对模型大鼠海马线粒体功能的影响
与假手术组比较,模型组海马线粒体明显肿胀,线粒体膜电位显著下降(P<0.05);与模型组比较,人参黄芩配伍低剂量组线粒体肿胀度明显下降,人参黄芩配伍高低剂量组线粒体膜电位均显著增高(P<0.05)(图3)。
3.4 人参黄芩配伍对MID大鼠脑能量的影响
与假手术相比较,模型组脑组织ATP含量显著降低(P<0.05),但AMP和ADP含量无明显变化(P>0.05),脑能荷值显著降低(P<0.05);与模型组比较,人参黄芩配伍高剂量组大鼠脑组织中ATP含量显著升高(P<0.05),AMP和ADP的含量无显著差异(P>0.05),脑能荷值显著升高(P < 0.05)(图4)。
4 讨论
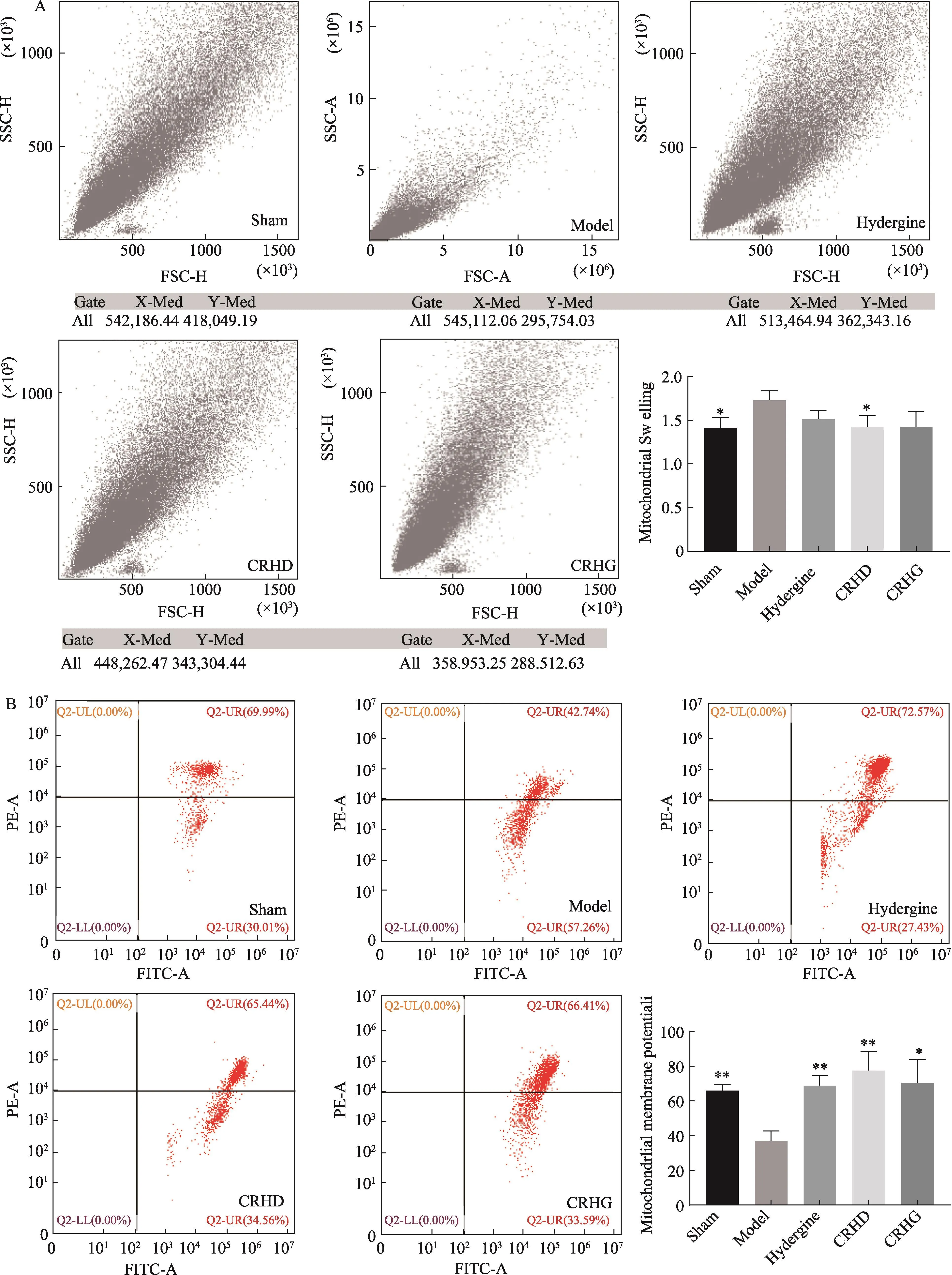
图3 人参黄芩配伍对MID模型大鼠海马线粒体功能的影响(n=3)
慢性脑缺血引起的低灌注导致皮层与海马神经元损伤,破坏空间学习记忆形成过程,被认为是MID认知障碍的病理学基础[13]。MID认知功能的下降与脑组织中广泛的小缺血灶或微梗死灶相关[14],自体血栓栓塞法能更好的模拟脑组织广泛微梗死灶,与临床具有较高的一致性。本次研究发现,微血栓颈总动脉注射后可以导致大鼠逃避潜伏期显著延长,穿越平台次数减少,海马CA1区椎体细胞排列紊乱、细胞稀疏,提示造模成功。人参黄芩配伍干预后,大鼠逃避潜伏期缩短,穿越平台次数增多,海马CA1区病理形态学不同程度减轻,说明人参黄芩配伍具有改善MID学习记忆功能的作用。脑是机体能量代谢最活跃的部位,稳定而协调的脑能量代谢对脑正常状态的保持至关重要。脑,特别是神经元,对缺血缺氧的敏感性在整个机体中最高[15]。多发梗死性痴呆存在多发性局限性脑血流降低或脑血管阻塞,首先影响了神经细胞的能量供应。已有研究表明脑能量代谢障碍是MID病变的中心环节,临床实验也表明线粒体功能下降、能量代谢衰减可能是神经退变病发病的早期信号[16]。能荷是代表总的腺苷酸系统中所负荷的高能磷酸基数量,是反应脑能量水平的最直接指标,本次研究发现,MID模型大鼠海马能荷显著低下,提示脑供能不足或低下,经人参黄芩干预后,模型大鼠海马能荷水平显著提高,说明人参黄芩配伍可以改善因脑梗造成脑供能不足。脑组织供能主要依赖ATP[17],ATP生成场所是线粒体,通过不断进行ADP-ATP再循环完成能量的穿梭转换,但并不能在细胞中储存[18]。因此线粒体供能正常与否与ATP生成和水平密切相关。线粒体肿胀度和膜电位水平可以反应线粒体供能和结构是否正常。已有研究表明MID模型大鼠存在明显的线粒体功能障碍,表现为线粒体肿胀和线粒体膜电位下降[12,16],这与本研究的结果一致,人参黄芩配伍可以改善多发性腔梗所致的脑组织线粒体肿胀度和膜电位的下降,提示其促进脑能荷的提高与线粒体损伤保护有关。综上,保护线粒体功能,改善脑能量进而保护神经细胞损害是人参黄芩配伍改善MID学习记忆功能的主要作用机制之一。

