芒果苷的分离纯化及鉴定研究
邓红梅,陈奕君,林壮辉,郑理文,孙泽峰,郭伟峰
(广东石油化工学院环境与生物工程学院,广东茂名 525000)
药理研究试验表明,芒果苷不仅具有化痰、止咳、平喘、抗炎、镇痛、抗肿瘤、免疫等功效,还对中枢神经系统有兴奋和保护作用,并且能增强心肌收缩功能,保肝利胆[1-4]。芒果皮是芒果生产加工中的主要副产物之一,基本上没有被很好地利用而是被大量废弃,不仅污染环境而且造成资源浪费。芒果皮中富含芒果苷,目前从芒果叶中提取芒果苷的研究较多[5-7],而对于芒果皮中芒果苷的研究却很少。试验利用索氏提取法从芒果皮和芒果叶中分离纯化芒果苷,并利用紫外分光光度法对提取的芒果苷进行定量分析。此外,根据芒果苷的含量利用D101,AB-8,NKA 9型这3种大孔树脂对其纯化效果进行比较。最终利用薄层层析对纯化的芒果苷进行定性分析。为芒果皮和芒果叶的开发利用提供有效途径,同时也为芒果资源的综合利用开发提供理论依据。
1 材料与方法
1.1 材料
金煌芒果,购于当地超市;芒果树叶采摘自校园内,洗净烘干,剪碎备用。
试剂:芒果苷标准对照品,购于上海源叶生物科技有限公司;无水乙醇、石油醚、乙酸乙酯、甲酸、甲醇、磷酸,均为分析纯;D101型大孔树脂、NKA 9型大孔树脂,购于天津市光复精细化工研究所;AB-8型大孔树脂,购于上海润捷化学试剂有限公司;硅胶GF 254板,购于青岛海洋化工厂分厂。
主要仪器:RE-3000型旋转蒸发仪,上海亚荣生化仪器厂产品;UV-5100 B型紫外分光光度计,上海元析仪器有限公司产品;JJ 224 BC型分析天平,常熟市双杰测试仪器厂产品;WD-9413 A型凝胶成像仪,北京市六一仪器厂产品。
1.2 方法
1.2.1 芒果苷提取
分别准确称取10.0 g处理好的芒果皮和叶,分别置于索氏提取器中,按照料液比为1∶10加入70%乙醇加热提取1.5 h,重复提取3次,过滤并合并滤液,浓缩滤液至100 mL。分别将2种浓缩液置于分液漏斗中,加入100 mL石油醚,振荡、静置萃取,倒出石油醚层,反复萃取直至石油醚层无色,弃石油醚层,最后将水层浓缩得到40 mL芒果苷浓缩液。分别精确量取芒果皮和叶浓缩液各1 mL,分别置于100 mL容量瓶,加入50%乙醇定容,摇匀。即得到2种芒果苷样品溶液。
1.2.2 芒果苷含量的测定
(1) 芒果苷标准曲线的建立。参照文献[8]略有改变,配制成12.06 μg/mL芒果苷标准对照品溶液,准确取芒果苷标准品储备液10.0 mL,用50%乙醇定容至100.0 mL,摇匀;分别准确移取1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0 mL,用 50%乙醇定容至10.0 mL, 即 获 得 4.020, 8.040, 12.060, 16.080,
20.100 ,24.120,28.140,32.160,36.180 μg/mL 的芒果苷标准溶液,然后以50%乙醇作为参照,于波长258 nm处测定吸光度,以吸光度对浓度绘制标准曲线并进行线性回归分析。
(2)检验精密度。分别准确吸取6份1 mL的芒果皮芒果苷样品溶液,置于10 mL带塞比色管中,加入50%乙醇至10 mL。于波长258 nm处测定吸光度,计算出芒果苷含量。
(3) 检验重复性。分别量取芒果皮和叶2种芒果苷样品溶液,于波长258 nm处测其吸光度,每份样品测定5次,观察各种样品的测定结果是否一致。
(4) 检验稳定性。取芒果皮和叶2种芒果苷样品溶液置于室温下,每隔15 min取样测定其吸光度,分别测9次,观察溶液中芒果苷是否保持稳定,从而确定其有效测定时间范围。
1.2.3 不同大孔树脂对芒果苷纯化效果的研究
(1) 大孔树脂的预处理。分别称取一定量的D101,AB-8,NKA 9型树脂,用0.5 BV的乙醇浸泡24 h,用2 BV的乙醇以2 BV/h流速通过树脂柱,并浸泡4~5 h,再用水以同样流速洗净,用乙醇洗至流出液加水不呈白色混浊为止,用2 BV的5%HCl溶液以4~6 BV/h的流速通过树脂层,并浸泡树脂2~4 h。而后用水以同样流速洗至出水pH值为中性,用2 BV的2%NaOH溶液以4~6 BV/h的流速通过树脂层,并浸泡树脂2~4 h,而后用水以同样流速洗至出水pH值呈中性。
(2) 不同大孔树脂对芒果苷静态吸附的测定。量取3种经过预处理的大孔树脂(D101,AB-8,NKA9型)各5 g,分别置于3个锥形瓶中,取150 mL芒果皮芒果苷提取液,平均加入各个锥形瓶中振荡吸附24 h,充分吸附后,过滤,分别取3种树脂的滤液1 mL,进行吸光度的分析,测定滤液剩余芒果苷的含量(芒果叶芒果苷提取液做法一样)。按下列公式计算各树脂在室温下的吸附量和吸附率。
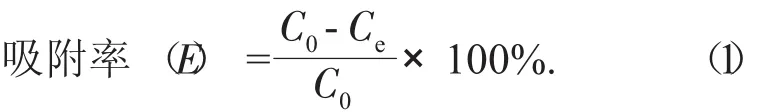
式中:C0——吸附前溶液质量浓度,mg/mL;Ce——吸附后溶液质量浓度,mg/mL。
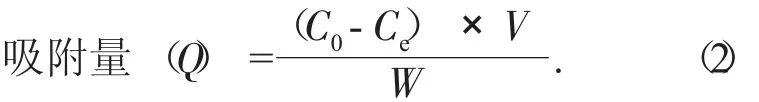
式中:Q——吸附量,mg/g;
W——干树脂质量,g;
V——溶液体积,mL。
用70%的乙醇冲洗树脂,至乙醇洗脱液无色为止,收集乙醇洗脱液,减压浓缩至50 mL。测定其中芒果苷的含量,根据下式计算各树脂在室温下的解析率。
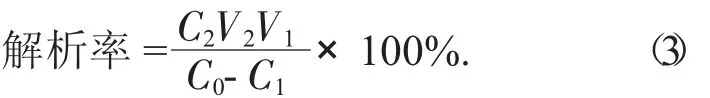
式中:C0——吸附前溶液质量浓度,mg/mL;
C1——吸附后溶液质量浓度,mg/mL;
V1——上样溶液的体积,mL;
C2——解析液质量浓度,mg/mL;
V2——解析液体积,mL。
1.2.4 最佳树脂对芒果苷动态吸附的测定
(1) 吸附阶段的考查。精确吸取5.0 mL芒果皮芒果苷浓缩液于500 mL容量瓶中,加50%乙醇定容、摇匀。
取由1.2.3项下筛选出的最适大孔树脂30.0 mL,湿法装柱。缓慢加入芒果苷提取液350.0 mL,以4 BV/h的流速通过树脂柱,每10.0 mL收集1管,共收集30管,分别测定流出液中芒果苷的浓度,绘制吸附曲线,找出该大孔树脂的泄漏点和饱和点。
(2) 解析阶段的考查。用2~4 BV的蒸馏水流速上述树脂,直至流出液无色为止;依次用10.0%,30.0%,50.0%,70.0%,90.0%乙醇溶液各4.0 mL对树脂进行梯度洗脱,每10.0 mL收集1管,共收集20管。分别测定各管收集液的芒果苷浓度,绘制解析曲线,找出解析芒果苷的最适乙醇体积分数。
1.2.5 纯化后的芒果苷检验
(1)芒果苷样品溶液的制备。分别精密量取经大孔树脂纯化后的芒果皮和叶浓缩液各1.0 mL,分别置于具塞比色管中,加入50.0%乙醇10.0 mL,作为供试液。
另外,取芒果苷标准对照品,加50.0%乙醇制成0.10 mg/mL溶液,作为对照品溶液。
(2) 薄层层析法(TLC) 检测。①画线:用2B以上的铅笔在距硅胶G板下端至少5 mm处画一条线,即点样线;在距硅胶G板上端5 mm处画一条线,为前沿线。画线时要轻而清晰,在点样线上画上竖线形成十字型,用以确定点样位置,2个点样点之间距离一致。②点样:用毛细管分别吸取芒果苷标准对照品溶液、芒果皮和芒果叶样品溶液,从左往右分别点在硅胶G板上的各个点样点。③展开:以乙酸乙酯-甲酸-甲醇-水(10∶1∶1∶1) 为展开剂,将点好样的硅胶板置于层析缸中展开。当展开液展开至接近前沿线时,取出、晾干。④显色:喷以10.0%的硫酸乙醇溶液,晾干,在105℃下加热烘干至显现淡黄色斑点,置于365 nm紫外灯下检视。
2 结果分析
2.1 芒果苷标准曲线的线性考查结果
根据芒果苷标准对照品的测定方法,测定不同质量浓度芒果苷标准品溶液在波长258 nm处的吸光度,以芒果苷的质量浓度对吸光度绘制芒果苷标准曲线,并得到芒果苷标准品的线性回归方程:Y=0.069 3X-0.036 3,R2=0.999。
芒果苷的标准曲线见图1。
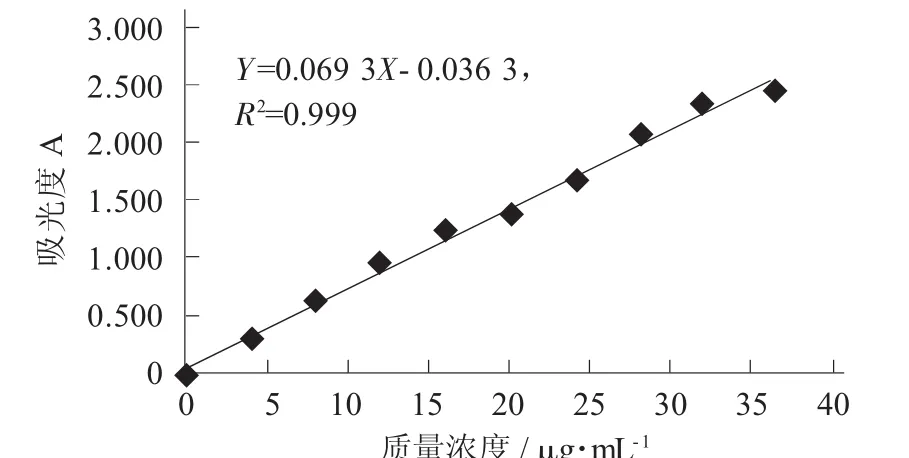
图1 芒果苷的标准曲线
从图1可以看出,芒果苷标准曲线在4.020~36.180 μg/mL范围内具有良好线性关系。
2.2 精密度检验结果分析
芒果皮芒果苷含量精密度试验结果见表1。
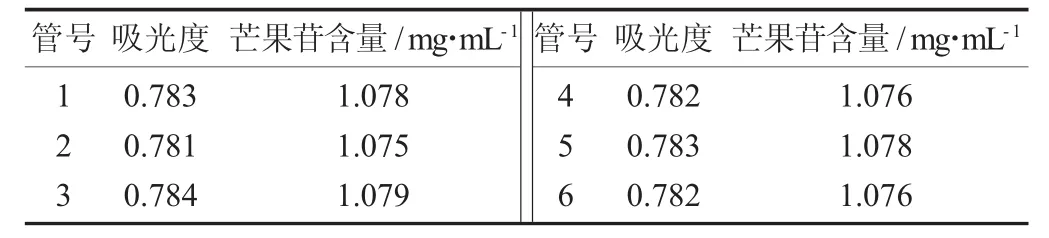
表1 芒果皮芒果苷含量精密度试验结果
表1为在258nm波长处测定芒果皮中芒果苷样品精密度检验结果。结果表明,用紫外分光光度法测定的芒果皮中芒果苷含量变化不大。因此,用紫外分光光度法测定芒果苷含量不仅具有可行性,还具有简便性。
2.3 重复性检验结果分析
芒果皮芒果苷含量重复性试验结果见表2。
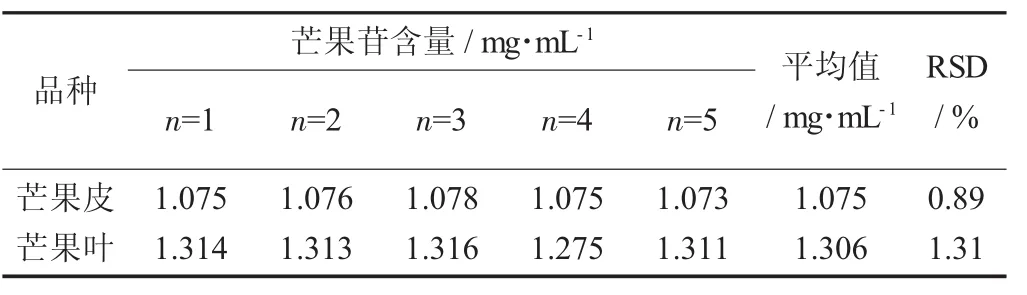
表2 芒果皮芒果苷含量重复性试验结果
表2为芒果皮和芒果叶的芒果苷样品在258 nm波长处测定芒果苷含量的重复性检验的结果,每份供试品测定5次(n=5)。从表2可知,芒果皮的RSD为0.89%,芒果叶的RSD为1.31%,二者的RSD均小于2.00%,一致性程度较高,表明了用紫外分光光度法测定芒果苷含量的方法准确性和重复性比较好。
2.4 稳定性检验结果
芒果皮芒果苷含量精密度试验结果见表3。
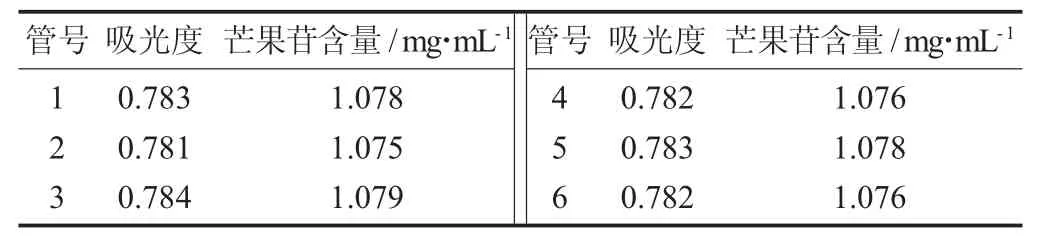
表3 芒果皮芒果苷含量精密度试验结果
表3为芒果皮和叶2种芒果苷样品在258 nm波长处每隔15 min测定一次芒果苷含量的结果。从表3可知,2种芒果苷样品溶液于室温下存放2 h内,同质量浓度的芒果苷供试品的吸光度变化不明显,2种芒果苷样品溶液RSD均在小于2.00%,表明紫外分光光度法在2 h内测定芒果苷的稳定性较好。因此,该试验表明用紫外分光光度计测定样品中芒果苷含量是可行的。
2.5 不同型号大孔树脂对芒果苷静态吸附的结果
不同型号的大孔树脂静态吸附与解析效果见表4。
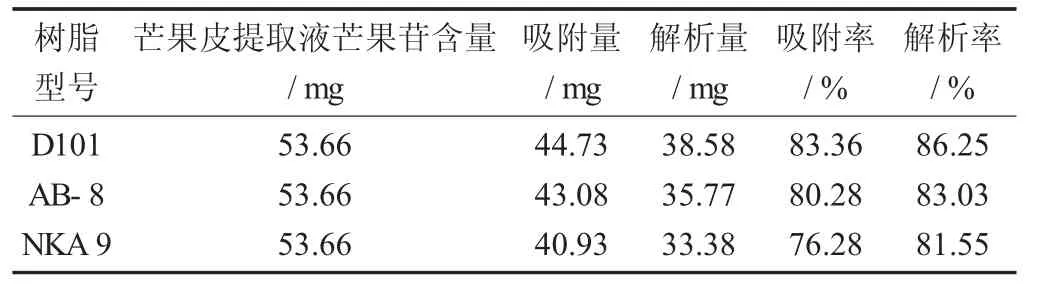
表4 不同型号的大孔树脂静态吸附与解析效果
表4为不同大孔树脂采用静态吸附法吸附芒果皮芒果苷,通过测定吸附残留液和解析液中芒果苷含量来研究其静态吸附和解析效果。由表4可知,D101型大孔树脂的静态吸附和解析效果最佳,AB-8型大孔树脂次之,NKA 9型相对来说较弱。
芒果苷是一种四羟基吡酮的碳酮苷,属双苯吡酮类黄酮类化合物,不溶于非极性溶剂,略溶于甲醇、乙醇、水等。所以,芒果苷具有一定的弱极性和非极性,适合于D101型这类非极性树脂和AB-8型这类弱极性树脂。此外,芒果苷的分子量为422.33,而D101型大孔树脂(孔径为10 nm) 的孔径比AB-8型(孔径为13~14 nm) 和NKA 9型(孔径为15.5~16.5 nm)都小,因此D101型大孔树脂对芒果苷的吸附能力优于AB-8型和NKA 9型大孔树脂。
2.6 D101型大孔树脂对芒果苷动态吸附的测定
D101型大孔树脂对芒果苷的动态吸附曲线见图2,D101型大孔树脂对芒果苷的动态解析曲线见图3。
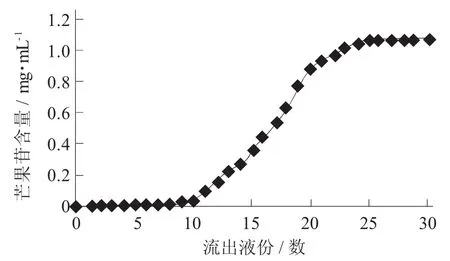
图2 D101型大孔树脂对芒果苷的动态吸附曲线
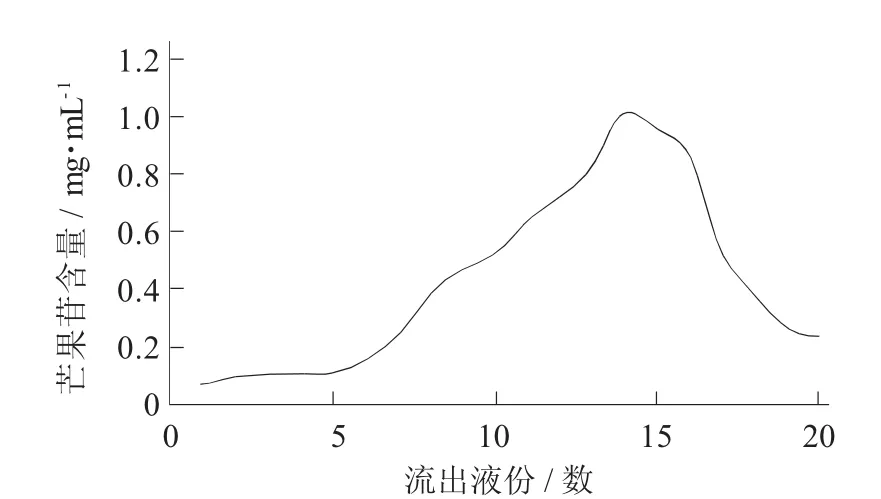
图3 D101大孔树脂对芒果苷的动态解析曲线
由图2可知,从第9份流出液开始,芒果苷出现了较大的泄漏,随着流出液份数增大,芒果苷含量也逐渐增多,从第25份流出液开始芒果苷动态吸附趋于饱和。
由图3可知,10%乙醇洗脱效果最差,用70%乙醇解析液中芒果苷含量最高。说明70%乙醇是最适洗脱浓度。
大孔树脂的吸附作用主要是化合物分子与树脂之间产生的范德华力或氢键而达到的。因此,可以根据有机化合物吸附力及其分子量大小使用一定浓度的溶剂进行洗脱,从而达到分离、纯化、除杂、浓缩等目的。随着乙醇体积分数的增大,一方面可以提高待分离有机物的溶解度和树脂的溶胀;另一方面乙醇能诱导非极性溶剂分子产生一定的极性,根据相似相溶原理,从而使极性与非极性溶液互溶。但是,由于芒果苷微溶于乙醇,溶于热稀乙醇,所以当乙醇体积分数超过90%时,芒果苷的溶解度反而减少,从而导致芒果苷洗脱效果不明显。
不同体积分数乙醇解析液中芒果苷含量比较见表5。
由表5可知,当洗脱剂乙醇的体积分数低于30%或高于90%时,洗脱效果不明显,当乙醇的体积分数为70%,洗脱效果最佳。由表5可知,芒果皮、芒果叶纯化后的芒果苷含量分别是上样前的1.43倍和1.51倍。
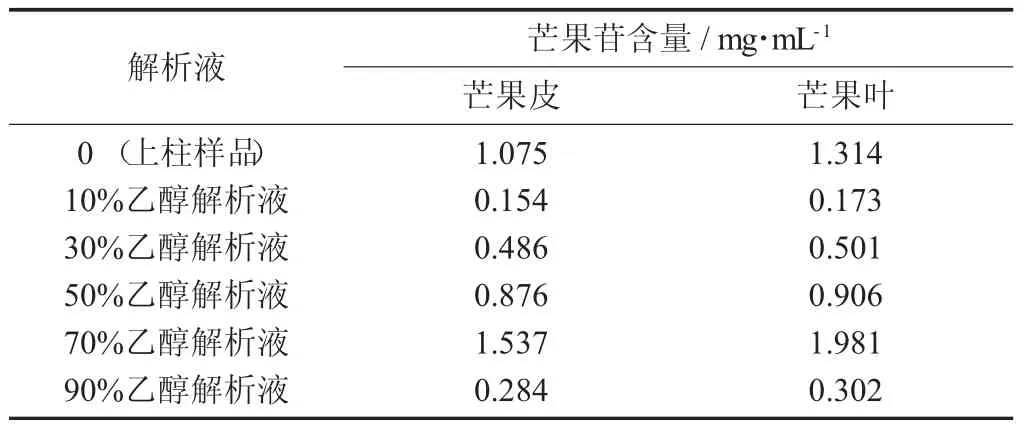
表5 不同体积分数乙醇解析液中芒果苷含量比较
通过D101、AB-8和NKA 9型大孔树脂对芒果苷纯化效果的分析,发现D101型大孔树脂对芒果苷的富集纯化要优于其他2种大孔树脂。这与李学坚等人的试验结果相符合。化合物的极性大小会直接影响大孔树脂的分离纯化效果。一般来说化合物极性较大的分子一般用中极性、极性的树脂进行分离纯化,而极性小的分子一般使用非极性树脂进行分离纯化。
2.7 芒果苷的薄层层析(TLC)鉴别结果
365 nm紫外光下芒果苷薄层色谱见图4。
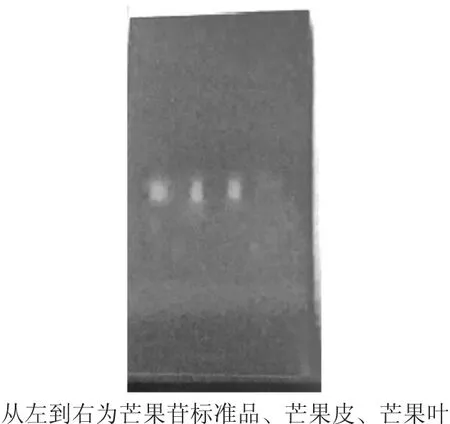
图4 365 nm紫外光下芒果苷薄层色谱
由图4可知,供试样液与芒果苷标准品在色谱的相应位置上,显现出相同颜色的浅蓝色荧光斑点。经过多次试验,薄层色谱的重现性良好。
苷类的溶解性与苷元和糖的结构均有关系。一般来说,苷元具有弱亲水性,而糖具有亲水性。苷类的极性、亲水性往往与糖基有关,由于苷类这类物质存在糖的多羟基结构,而且苷元的活泼氢与糖的端基羟基结合,导致了苷元结构影响变小。展开剂使用极性较大的有机溶剂,如氯仿、乙酸乙酯、正丁醇、甲醇和水。乙酸和甲酸的使用,不仅能增大展开剂的极性,而且还能抑制硅胶羟基的作用,减少拖尾。如果提取物中含有色素或者大分子物质时,展开后显色经常会出现拖尾或扩散,导致显色后的荧光点不集中,甚至出现交联。
3 结论
(1)用紫外分光光度法测定芒果苷含量时基本不会受到芒果皮或象牙芒叶提取物溶液中其他物质的干扰,测定结果的准确性较高、稳定性和重复性都较好,RSD均小于2.00%。同品种的芒果皮与芒果叶相比,芒果叶中的芒果苷含量多于芒果皮。
(2)D101型大孔树脂对芒果苷的富集纯化要优于AB-8和NKA 9型大孔树脂。70%乙醇的洗脱效果比较好,而且用70%乙醇洗脱解析液中芒果苷含量最高,分别是上柱前芒果皮、芒果叶样液芒果苷含量的1.43倍,1.51倍,富集纯化的效果明显。
(3)纯化后的芒果苷的薄层层析(TLC) 色谱带与芒果苷标准品相一致,在365 nm紫外光下显现出相同颜色的浅蓝色荧光斑点。
[1]邓家刚,郑作文,曾春晖.芒果苷的药效学实验研究 [J].中医药学刊,2002(6):802-803.
[2]邓家刚,曾春晖.象牙芒果树叶及芒果苷30年研究概况 [J].广西中医学院学报,2003(2):44-49.
[3]黄敏琪,林忠文,曾宪彪,等.芒果皮提取物止咳化痰和抗炎作用研究 [J].中草药,2007,38(8):1 233-1 234.
[4]姚风艳,孙连娜.芒果苷药理作用及其结构修饰的研究进展 [J].中国实验方剂学杂志,2014(12):248-252.
[5]郭伶伶,张祎,刘二伟,等.芒果叶中芒果苷含量的测定 [J].天津中医药大学,2013,32(1):43-45.
[6]谢宇奇,林翠梧,赖清华,等.紫外-可见吸收光谱法测定芒果叶中的芒果苷和叶绿素 [J].南方农业学报,2014,45(3):463-468.
[7]邓家刚,冯旭,王勤,等.芒果叶与芒果枝条中芒果苷的含量对比研究 [J].广西中医药,2006,29(4):53-55.
[8]黄春萍,罗群,李洁.芒果皮中芒果苷提取工艺优化及其抑菌性分析 [J].南方农业学报,2014,45(8):1 452-1 456.◇

