NIS与甲状腺疾病的关系研究进展
石凌峰 综述,胡 渊,倪银星 审校
(重庆医科大学附属第三医院内分泌疾病中心 401120)
钠-碘同向转运体(NIS)在全身多种组织中均有表达且发挥作用,如NIS凝聚碘离子(I-),通过测量唾液/血浆比例可用于诊断新生儿碘转运缺陷[1];NIS可释放I-到胃液,具有保护和杀菌功能[2];消化道转移癌患者NIS表达下降,提示NIS可作为肿瘤标记物[3];约57%绝经后、60%不孕、20%育龄期女性子宫内膜和部分卵巢中也有NIS表达[4]。在甲状腺中,NIS主要在甲状腺滤泡细胞上皮表达,对甲状腺激素合成、甲状腺疾病的预测及治疗均有重要价值,本文就NIS在甲状腺疾病的作用进行综述。
1 NIS的基因表达调控
NIS是Na+/I-同向转运浆膜糖蛋白,由细胞膜上Na+/K+泵形成的Na+梯度为驱动力,从血浆中主动转运I-。1996年,DAI等[5]研究得知人NIS基因位于第19对染色体的19P12-13.2,为包含15个外显子、编码643个氨基酸、相对分子质量为(70~90)×103的糖蛋白。NIS属于碘依赖转运体家族5A,是一种含13个跨膜区域的膜蛋白,有3个N链接的糖基化位点[6]。其可以转运I-和其他离子半径与I-相似的单价阴离子,如高氯酸盐(ClO4-),硫氰酸盐(SCN-)和硝酸盐(NO3-)[7]。见图1。
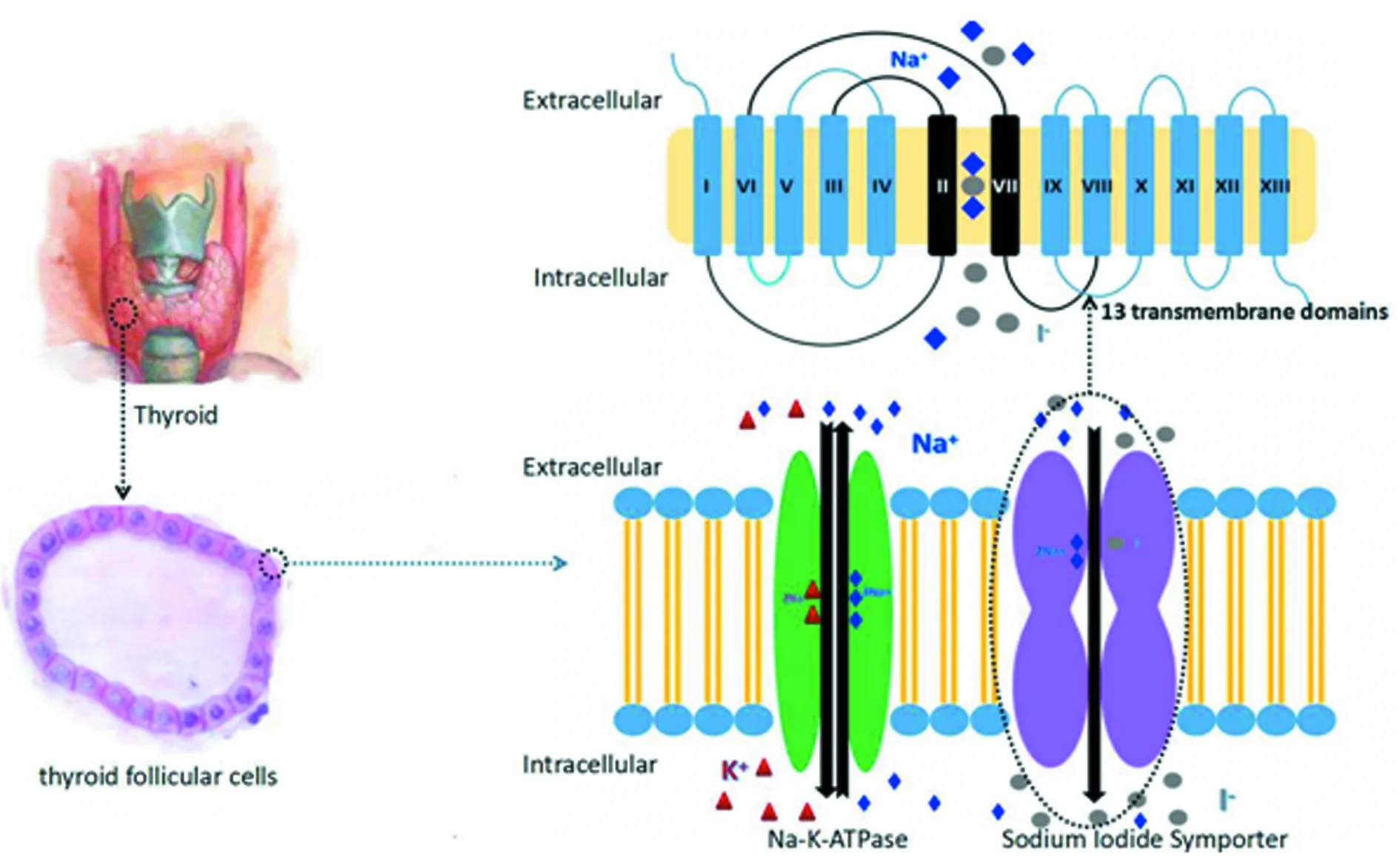
图1 NIS结构简介
可溶性载质转运家族5A5(solute carrier family 5A5,SLC5A5)基因编码NIS,其上游为上游增强子区域(NUE),包含如TTF1,PAX8和CRE等元件,与人NIS近端启动子共同决定人NIS基因的转录[8]。致癌基因激活将致细胞丢失或减少NIS表达,降低摄碘功能。这种改变的经典通路包括RAS-RAF-MAPK(简称MAPK通路)和PI3K-Akt-mTOR(简称mTOR通路)异常激活。MAPK通路介导细胞增殖周期、细胞生存和肿瘤发生。在甲状腺癌,常见的BRAFV600E突变[9],可能通过促进转化生长因子激活SMADs损害PAX8[10],抑制NIS的表达。mTOR通路则与滤泡状甲状腺癌发生及其转移性和侵袭性密切相关[11]。抑制mTOR通路可通过增强甲状腺癌细胞TTF1表达而增加NIS表达[12]。此外,有研究对鼠甲状腺滤泡细胞使用AICAR,即AMP依赖的蛋白激酶(AMPK)激活剂,细胞的NIS表达和摄碘能力明显抑制;继续使用Compound C(AMPK拮抗剂)可解除抑制效应,表明AMPK可能参与NIS调节。随后,ABDULRAHMAN等[13]进一步实验发现AMPK可能通过影响CRE元件转录活性而调节NIS表达和摄碘率。见图2。
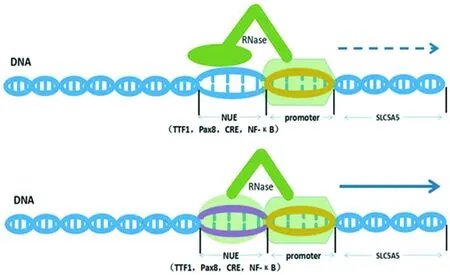
图2 SLC5A5转录受近侧启动子及上游NUE共同调节
微小RNA(miRNA,miR)也参与NIS调节。国际癌症和肿瘤基因图谱计划(TCGA)多平台分析496例乳头状甲状腺癌(PTC)标本,发现一些miR与低分化肿瘤有关[14]。EIZAGUIRRE等[15]发现PTC标本中miR-146b-5p和miR-146b-3p明显下调,这两个miR分别作用54个基因和66个基因(图3),其中包括PAX8、SLC5A5、DEHAL1和DIO2。而SLC5A5、DEHAL1和DIO2是PAX8的下游目标[16],提示miR-146b可能组成一个前反馈通过直接和间接机制控制基因表达。EIZAGUIRRE等[15]在鼠甲状腺细胞中沉默PAX8,发现miR-146b水平明显下降;同时也观察到miR-146b过度表达导致平均约30%的PAX8活性下降,说明PAX8通过诱导抑制物(miR-146b)限制自己的活性而形成一个负性前反馈,并得出结果证实miR-146b-3p结合在NIS 3′UTR的3-9位点直接抑制NIS表达(图4)。最近的实验也显示在鼠正常甲状腺细胞中miR-339也介导NIS表达[17]。说明miR可能参与甲状腺肿瘤NIS的负反馈调节,而正常甲状腺细胞中的NIS调节尚待研究。

图3 miR调节网络

图4 miR-146b调节NIS表达
染色质结构也调节NIS基因活性。LAVARONE等[18]用多聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂PJ34处理甲状腺TPC1、BCPAP细胞株(均来自乳头状癌)、FRO细胞株(来自人未分化型癌)及WRO细胞株(来自滤泡性癌)。在使用PJ34 60 μmol/L治疗72 h后,上述所有细胞生存能力均下降,NIS mRNA均增加,TPC1和BCPAP细胞株碘摄取显著增加。对TPC1细胞株行ChiP分析发现NUE区H3乙酰化水平增加5倍,H3K9K14ac和H3K4me3水平(转录活性标志)增加,H3K27me3水平(转录抑制活性标志)下降,与NIS mRNA增加水平一致,启动子区也有类似特征。D′AGOSTINO等[19]用丝裂原细胞外激酶(mitogen extracellular kinase,MEK)抑制剂U0126(阻断MAPK通路)和Akt抑制剂B2311(阻断mTOR通路)处理不同细胞株,研究结果显示NIS启动子H3K9K14ac和H3K4me3水平降低,H3K27me3升高。尽管两个实验结论有差异(可能与使用的细胞株不同,与抑制剂使用剂量、时间等也有关),但总的来说,这些实验都提示组蛋白的改变可能导致基因转录水平的改变,故而调节NIS表达水平。
2 NIS对妊娠期甲状腺功能的影响
NIS在甲状腺滤泡细胞中的主要作用是转运血浆中I-,但并非特异性,还可以转运其他离子半径相似的单价阴离子如ClO4-,SCN-和NO3-。美国健康和营养调查(NHANES)显示,几乎所有尿液标本中均检测到ClO4-、SCN-[20],所以ClO4-,SCN-又称NIS的环境抑制剂,故甲状腺易通过摄取ClO4-,SCN-等竞争性抑制I-摄取,加之孕妇在孕早期因I-需求量增加、更易受到碘供应不足的影响,孕早期甲状腺激素供应不足会增加孕妇妊娠不良结局和胎儿智力发育风险,因此NIS环境抑制剂对甲状腺功能的影响备受关注。
BLOUNT等[21]调查2 299例参与2001-2002 NEANES的人群,发现对于尿碘小于100 μg/L的女性,ClO4-与T4呈负相关(P<0.01),与TSH呈正相关(P=0.001);对于尿碘大于或等于100 μg女性,ClO4-与TSH呈正相关(P=0.025)。随后YANG等[22]从美国SEAD(the Study of Estrogen Activity and Development)研究中选取92例足月妊娠新生儿随访至1年,在低尿碘婴儿中,ClO4-、SCN-、NO3-与尿TSH呈正相关。HORTON等[23]对比293例16~35岁居住于纽约的平均(12.0±2.8)孕周孕妇,发现尿ClO4-、SCN-、NO3-的浓度加权和与TSH的增加显著相关,且ClO4-关系最为密切(权重为75%),NO3-最少(权重为22%)。近期Craig针对2000-2003年,1 880例居住在圣地亚哥的妊娠期女性。这段时间内此区域供应水被工业污染,该人群的尿ClO4-浓度中位数为6.5 μg/L(约为美国人群的2倍),分析得出lgClO4-和T4、FT4呈显著负相关,和lgTSH呈显著正相关[24]。上述研究均提示,环境ClO4-等NIS抑制剂的浓度与TSH密切相关,同时也易受到地区人群及孕妇碘营养状况、尿碘水平、环境NIS抑制剂浓度的影响。
相反的结论也有报道。Pearce分析2002-2006年居住在加的夫和都灵共22 000例小于16孕周孕妇的尿碘水平(加的夫:117 μg/L,都灵:50 μg/L)、ClO4-、SCN-和血清TSH,FT4关系,发现低水平ClO4-暴露没有影响碘缺乏地区孕妇甲状腺功能[25]。LEUNG等[26]分析64例波士顿地区产妇母乳和尿中碘(尿碘中位数101.9 μg/L)、ClO4-(中位数3.1 μg/L)、SCN-以及新生儿血清TSH、FT4相关性,发现环境的ClO4-、SCN-暴露与新生儿甲状腺功能无相关性,文章没有与产妇甲状腺功能的比较结果。研究结果的差异可能与环境ClO4-等NIS抑制剂的浓度差异及研究设计不同有关。
3 NIS抗体与甲状腺自身免疫性疾病
1995年RASPE等[27]将1例患有桥本病、自身免疫性胃炎及类风湿性关节炎的患者血清添加到狗甲状腺细胞培养皿,即使在1∶1 000稀释下,该血清都可以抑制TSH诱导的I-摄取。进一步试验发现有一种通过人甲状腺细胞产生,可诱导大鼠自身免疫的单克隆抗体(可能为NISAb),可以抑制TSH诱导的I-摄取,于是该学者提出NIS可能是一种自身抗原。由此开始关注NISAb在甲状腺疾病中的作用。
1996年ENDO等[28]用重组鼠NIS蛋白检测患自身免疫甲状腺疾病(AITD)患者血清,他发现84%的Graves病(graves disease,GD)患者和15%的桥本病(hashimoto′s thyroiditis,HT)患者血清能识别该蛋白,Western blot检测这些lgGs与兔NISAb条带上的迁移率一致,故ENDO等[28]提出NISAb有可能为一种新的甲状腺抗体,其重要性是可以预测AITD。1997年MORRIS等[29]合成人NIS胞外域多肽,与GD、HT患者及健康对照人血清IgG结合,发现部分多肽明显结合至患者IgG而对照组阴性,也提示NIS可作为AITD中的一种重要自身抗原,并且推断其抗原表位位于NIS多肽的8、12、13、14 th胞外区域。AJJAN等[30]在2000年也发表文章支持这一观点。他们发现在39% GD和35%HT患者血清对人NISAb反应。上述研究表明NISAb可能用于预测或诊断AITD。
但是近期的研究却提示相反的结果。CHIN等[31]检测更大标本血清(514例),指出在AITD中,抗体调节NIS活性的能力十分罕见。为进一步明确,Brix从丹麦双胞胎注册机构全国范围内筛选出复合标准的双胎进行分析,发现AITD的个体虽有更高的NISAb(17%vs.0%,P<0.01)表达,但也只有20%GD和14%HT有NISAb。只有2个病例(均患有GD)有NISAb而没有甲状腺过氧化物酶抗体(TPOAb)。在TgAb阳性个体,NISAb占17%。NISAb在3年内、3~5年、大于5年诊断GD或者HT的阳性率分别为19%、13%和19%。以上结果提示NISAb在AITD的发展中有高特异度但低灵敏度,因此针对NISAb检测在诊断AITD中没有帮助,同时该文章也指出可能是个体易感性导致AITD患者血浆中出现NISAb[32]。MULLER等[33]也发表文章支持这一观点,他们使用流式细胞术检测血清NISAb结合转运体,在42例血清中均没有发现明显阳性表达。
目前的研究尚不足以支持将NISAb作为AITD的判断依据,主要原因是NISAb的低灵敏度和对摄碘率抑制的不确定性。初期的阳性实验比之后的阴性实验样本量小,所以可信度受到质疑。RASPE等[27]的实验发现147例AITD患者的血清标本中有1个能抑制狗甲状腺细胞碘吸收。这个结果本身就提示阳性血清在AITD中少见。有研究发现IgG可以抑制碘摄取,但也发现约50%的IgG没有结合到NIS。因此推测抑制活性部分不是抗体介导或不是由NISAb直接介导[30,34]。综上所述,目前的研究结果尚不能支持将NISAb作为AITD的诊断依据,结合其是在多种自身免疫病聚集患者体内发现的,是否与其他自身免疫病有关,或者与重叠综合征有关,尚待进一步研究。
4 NIS在甲状腺癌治疗中的作用
1946年,美国批准放射性碘通过“原子鸡尾酒”治疗甲状腺癌[35],但直到1996年NIS被成功克隆后,治疗机制才逐渐清晰,主要为以下两点:(1)TSH可以促使NIS定位至细胞膜,如TSH缺乏将导致摄碘能力下降。(2)NIS可以高效地摄取放射性碘和锝-99m(Tc-99m),可以通过吸收I123、I131、I124、Tc-99m等形成扫描图像及杀伤细胞[36]。
放射性碘治疗甲状腺癌的一个重要基础是需杀灭的甲状腺细胞本身表达NIS。绝大多数经过外科甲状腺切除后的甲状腺癌患者需停止T4治疗4~5周以便获得较高TSH浓度,如果在低碘区域中则可以于48 h内接受人重组TSH注射达到同样目的,然后再使用30~150 mCiI131消融清除甲状腺癌术后残余癌细胞和甲状腺组织。放射性碘治疗也用于治疗全身核素扫描阴性甲状腺癌患者,因为残余的I131活性可能不足以在扫描中显现出来,但仍能导致肿瘤细胞衰亡,可通过甲状腺球蛋白(Tg)水平进行监测。此外,因为部分肿瘤聚集I131通过β粒子交叉效应破坏周围未分化组织,所以放射性碘治疗也用于一些还保留一定分化程度或者可测到血Tg表达的甲状腺未分化癌病例[37]。
目前131I治疗已成为美国内科医生常用的治疗方式,并且在世界范围内都是治疗分化型甲状腺癌的一个关键手段,它依赖甲状腺癌细胞比其他组织更有效地摄取放射性碘。目前已有研究将NIS表达细胞移植进大鼠,以使用放射性方法治疗滤泡状甲状腺癌[38]、未分化甲状腺和甲状腺髓样癌[39]或治疗非甲状腺肿瘤如肝癌、前列腺癌、胰腺癌、恶性胶质瘤、结肠癌等[37]。然而,在一些甲状腺癌病例中NIS高度表达但是放射性治疗效果却仍然不佳,这种NIS功能的缺乏原因可能与NIS异常胞内转移有关。LAN等[17]提出在侵袭性甲状腺癌HIF1α的抗放射性治疗作用是一种β连环蛋白依赖方法。这个信号可能通过改变NIS的膜定位而不是NIS的转录发挥作用。他们通过大鼠实验发现FTC133细胞HIF-1α或β连环蛋白过度表达改变NIS定位(从细胞膜到细胞质),使细胞放射性碘摄取能力明显下降。尽管具体机制不明,但在FTC细胞异种移植大鼠中β连环蛋白水平和NIS细胞质分布数量正相关,敲除β连环蛋白大鼠可以修正这些改变[40]。因此单纯放射性碘治疗效果不佳可能与NIS定位及功能异常所致,而放射性碘也不仅仅限于甲状腺癌的治疗,甚至可以扩展到非甲状腺肿瘤的治疗。
5 展 望
2010年9月8日中华医学会内分泌分会宣布甲状腺疾病目前已成为内分泌领域的第二大疾病。据国际癌症研究机构IARC2012统计,在我国,甲状腺癌占在女性恶性肿瘤占第3位、在美国是第5位、韩国是第1位。甲状腺组织中NIS控制着甲状腺激素合成的第一步,即碘的摄取。甲状腺组织去分化常伴有NIS功能的损害,因此NIS的调控及其功能表达的研究任重道远。本文主要从NIS基因调控、NIS抗体表达及NIS相关的放射性同位素治疗为切入点;同时妊娠期甲状腺疾病患病人数上升,而我国工业发展,可能导致部分影响碘吸收的污染物ClO4-、SCN-、NO3-,即NIS环境抑制剂增多,影响妊娠期甲状腺功能。故汇总上述研究,希望引起对NIS关注。然而,上述研究都还有大量未明之处:(1)NIS环境抑制剂对甲状腺功能的影响缺乏多中心大样本研究。(2)对于NIS基因的调控大都还处在细胞水平,人体中表达NIS的细胞并不是只有甲状腺滤泡细胞,如何精准定位研究又是一大难题。(3)NIS最终的表达情况不仅取决于基因调控,还取决于NIS蛋白能否正常定位,而相关研究尚显不足。(4)NIS抗体的研究不十分顺利,也许并不是NISAb本身难以表达,而是与目前检测手段有关。上述研究主要针对AITD,既然NIS在全身多处组织表达,或许NISAb能在其他疾病发生、发展起作用。总的来说,NIS目前所知极为有限,其在甲状腺疾病中的作用还需要深入研究。
[1]VENTURI S,VENTURI M.Iodine in evolution of salivary glands and in oral health[J].Nutrition Health,2009,20(2):119.
[2]GUPTA A,LAKHOO K,PRITCHARD N,et al.Epidermal growth factor in neonatal saliva[J].Eur J Pediatr Surg,2008,18(4):245-248.
[3]WAPNIR I L,MONIKA P,ANNA S,et al.Expression of the Na+/l-symporter (NIS) is markedly decreased or absent in gastric cancer and intestinal metaplastic mucosa of Barrett esophagus[J].BMC Cancer,2007,7(1):5.
[4]TROVATO M,VITARELLI E,TRIPEPI M,et al.Expression of NA/I symporter (NIS) in endometrial mucosa of fertile,sterile and post-menopausal women[J].Histol Histopathol,2008,23(5):549-554.
[5]DAI G,LEVY O,CARRASCO N.Cloning and characterization of the thyroid iodide transporter[J].Nature,1996,379(6564):458.
[6]CZARNOCKA B.Thyroperoxidase,thyroglobulin,Na(+)/I(-) symporter,pendrin in thyroid autoimmunity[J].Front Biosci,2011,16(4):783-802.
[7]ESKANDARI S,LOO D D,DAI G,et al.Thyroid Na+/I-symporter.Mechanism,stoichiometry and specificity[J].J Biol Chem,1997,272(43):27230.
[8]LAKSHMANAN A,SCARBERRY D,SHEN D H,et al.Modulation of sodium iodide symporter in thyroid cancer[J].Horm Cancer,2014,5(6):363.
[9]BAROLLO S,PENNELLI G,VIANELLO F,et al.BRAF in primary and recurrent papillary thyroid cancers:the relationship with (131)I and 2-[(18)F]fluoro-2-deoxy-D-glucose uptake ability[J].Eur J Endocrinol,2010,163(4):659-663.
[10]COSTAMAGNA E,GARC A B,SANTISTEBAN P.The functional interaction between the paired domain transcription factor Pax8 and Smad3 is involved in transforming growth factor-beta repression of the sodium/iodide symporter gene[J].J Biol Chem,2004,279(5):3439-3446.
[11]XING M.Molecular pathogenesis and mechanisms of thyroid cancer[J].Nat Rev Cancer,2013,13(3):184.
[12]PLANTINGA T S,HEINHUIS B,GERRITS D,et al.mTOR inhibition promotes TTF1-dependent redifferentiation and restores iodine uptake in thyroid carcinoma cell lines[J].J Clin Endocrinol Metab,2014,99(7):1368-1375.
[13]ABDULRAHMAN R M,BOON M R,SIPS H C,et al.Impact of metformin and compound C on NIS expression and iodine uptake in vitro and in vivo:a role for CRE in AMPK modulation of thyroid function[J].Thyroid,2014,24(1):78.
[14]AGRAWAL N,AKBANI R,AKSOY B A,et al.Integrated genomic characterization of papillary thyroid carcinoma[J].Cell,2014,159(3):676-690.
[15]RIESCOEIZAGUIRRE G,WERTLAMAS L,PERALESPAT N J,et al.The miR-146b-3p/PAX8/NIS Regulatory Circuit Modulates the Differentiation Phenotype and Function of Thyroid Cells during Carcinogenesis[J].Cancer Res,2015,75(19):4119-4130.
[16]RUIZ-LLORENTE S,PAU E C S D,SASTRE-PERONA A,et al.Genome-wide analysis of Pax8 binding provides new insights into thyroid functions[J].BMC Genomics,2012,13(1):147.
[17]LAKSHMANAN A,WOJCICKA A,KOTLAREK M,et al.microRNA-339-5p modulates Na+/I-symporter-mediated radioiodide uptake[J].Endocr Relat Cancer,2015,22(1):11-21.
[18]LAVARONE E,PUPPIN C,PASSON N,et al.The PARP inhibitor PJ34 modifies proliferation,NIS expression and epigenetic marks in thyroid cancer cell lines[J].Mol Cell Endocrinol,2013,365(1):1-10.
[19]D′AGOSTINO M,SPONZIELLO M,PUPPIN C,et al.Different expression of TSH receptor and NIS genes in thyroid cancer:role of epigenetics[J].J Mol Endocrinol,2014,52(2):121.
[20]SUH M,ABRAHAM L,HIXON J G,et al.The effects of perchlorate,nitrate,and thiocyanate on free thyroxine for potentially sensitive subpopulations of the 2001[ndash]2002 and 2007[ndash]2008 National Health and Nutrition Examination Surveys[J].J Expo Sci Environ Epidemiol,2014,24(6):579.
[21]BLOUNT B C,PIRKLE J L,OSTERLOH J D,et al.Urinary perchlorate and thyroid hormone levels in adolescent and adult men and women living in the United States[J].Environ Health Perspect,2006,114(12):1865-1871.
[22]YANG C,BLOUNT B C,VALENTIN-BLASINI L,et al.Goitrogenic anions,thyroid-stimulating hormone,and thyroid hormone in infants[J].Environ Health Perspect,2010,118(9):1332-1337.
[23]HORTON M K,BLOUNT B C,LIZA V B,et al.CO-occurring exposure to perchlorate,nitrate and thiocyanate alters thyroid function in healthy pregnant women[J].Environ Res,2015,143(Pt A):1.
[24]STEINMAUS C,PEARL M,KHARRAZI M,et al.Thyroid hormones and moderate exposure to perchlorate during pregnancy in women in southern california[J].Environ Health Perspect,2016,124(6):861-867.
[25]PEARCE E N,LAZARUS J H,SMYTH P P,et al.Perchlorate and thiocyanate exposure and thyroid function in first-trimester pregnant women[J].J Clin Endocrinol Metab,2012,77(3):3207.
[26]LEUNG A M,BRAVERMAN L E,HE X,et al.Environmental perchlorate and thiocyanate exposures and infant serum thyroid function[J].Thyroid,2012,22(9):938-943.
[27]RASP O E,COSTAGLIOLA S,RUF J,et al.Identification of the thyroid Na+/I-cotransporter as a potential autoantigen in thyroid autoimmune disease[J].Eur J Endocrinol,1995,132(4):399.
[28]ENDO T,KOGAI T,NAKAZATO M,et al.Autoantibody against Na+/I-symporter in the sera of patients with autoimmune thyroid disease[J].Biochem Biophys Res Commun,1996,224(1):92-95.
[29]MORRIS J C,BERGERT E R,BRYANT W P.Binding of immunoglobulin G from patients with autoimmune thyroid disease to rat sodium-iodide symporter peptides:evidence for the iodide transporter as an autoantigen[J].Thyroid,1997,7(4):527-534.
[30]AJJAN R A,KEMP E H,WATERMAN E A,et al.Detection of binding and blocking autoantibodies to the human sodium-iodide symporter in patients with autoimmune thyroid disease[J].J Clin Endocrinol Metab,2000,85(5):2020-2027.
[31]CHIN H S,CHIN D K,MORGENTHALER N G,et al.Rarity of anti- Na+/I-symporter (NIS) antibody with iodide uptake inhibiting activity in autoimmune thyroid diseases (AITD)[J].J Clin Endocrinol Metab,2000,85(10):3937.
[32]BRIX T H,HEGED S L,WEETMAN A P,et al.Pendrin and NIS antibodies are absent in healthy individuals and are rare in autoimmune thyroid disease:evidence from a Danish twin study[J].Clin Endocrinol,2014,81(3):440-444.
[33]MULLER I,ZHANG L,GIANI C,et al.The sodium iodide symporter is unlikely to be a thyroid/breast shared antigen[J].J Endocrinol Invest,2016,39(3):323-331.
[34]FIERABRACCI P,PINCHERA A,TONACCHERA M,et al.Absence of interference of serum IgGs from patients with breast cancer and thyroid autoimmunity on the function of human iodide symporter gene stably transfected in CHO cells[J].J Endocrinol Invest,2004,27(9):862.
[35]VERBURG F A,DE K B,VAN ISSELT J W.Use of radiopharmaceuticals for diagnosis,treatment,and follow-up of differentiated thyroid carcinoma[J].Anticancer Agents Med Chem,2007,7(4):399.
[36]AHN B C.Sodium iodide symporter for nuclear molecular imaging and gene therapy:from bedside to bench and back[J].Theranostics,2012,2(4):392-402.
[37]PORTULANO C,PARODERBELENITSKY M,CARRASCO N.The Na+/I-symporter (NIS):mechanism and medical impact[J].Endocr Rev,2014,35(1):106.
[38]PETRICH T,HELMEKE H J,MEYER G,et al.Establishment of radioactive astatine and iodine uptake in cancer cell lines expressing the human sodium/iodide symporter[J].Eur J Nucl Med Mol Imaging,2002,29(7):842-854.
[39]ELISEI R,VIVALDI A,CIAMPI R,et al.Treatment with drugs able to reduce iodine efflux significantly increases the intracellular retention time in thyroid cancer cells stably transfected with sodium iodide symporter complementary deoxyribonucleic acid[J].J Clin Endocrinol Metab,2006,91(6):2389-2395.
[40]LAN L,BASOURAKOS S,CUI D,et al.Inhibiting catenin expression promotes efficiency of radioiodine treatment in aggressive follicular thyroid cancer cells probably through mediating NIS localization[J].Oncol Rep,2016,37(1):426-434.

