长链非编码RNA HOTAIR在急性髓系白血病患者外周血中的表达变化及意义
郑转珍,贡荣,李国霞,任方刚,徐丽娟
(1山西医科大学第二临床医学院,太原030001;2山西大医院)
急性髓系白血病(AML)是一类高度异质性的造血系统恶性肿瘤,以骨髓和外周血中未成熟骨髓干细胞的快速积聚和恶性增殖为特征[1]。近年来,在AML的风险评估、缓解后化疗和造血干细胞移植等方面,取得了巨大进步[2]。尽管大多数接受化疗的AML患者能够获得完全缓解,其中仅约20%的完全缓解患者能够获得长期无复发生存[3]。因此,为提高AML的诊断、治疗效率,仍需对AML的发生发展机制进行深入探讨。研究表明,长链非编码RNA(lncRNA)在造血干细胞分化和AML等血液恶性肿瘤中均发挥作用[4]。HOX基因的反义基因间RNA(HOTAIR),由HOXC基因的反义链转录生成,长度约2.2 kb。研究证实,lncRNA HOTAIR在多种肿瘤的恶性进展过程中发挥调节作用[5]。而关于lncRNA HOTAIR在AML患者外周血中的表达变化,以及lncRNA HOTAIR在AML诊断、治疗中的应用价值,尚未有报道。本研究采用qRT-PCR法检测lncRNA HOTAIR在AML中的表达变化,并分析lncRNA HOTAIR表达与AML患者临床病理参数、预后的关系,探讨lncRNA HOTAIR在AML发生发展过程中的作用,以期作为AML诊断、治疗的新靶点。
1 资料与方法
1.1 临床资料 选择2012年6月~2015年1月于山西医科大学第二医院初诊AML的患者96例,均符合法美英合作组AML的诊断标准[6]。其中男52例、女44例,年龄19~70(46.21±12.87)岁;WHO分型[7]M1型5例、M2型30例、M4型13例、M5型34例、M6型14例。其中接受DA方案(柔红霉素、阿糖胞苷)诱导化疗86例,化疗2个周期完全缓解56例。根据患者的身体状况,完全缓解的患者,在巩固强化阶段均接受高剂量或中等剂量的以阿糖胞苷为基础的化疗。其余10例未接受治疗,且均未获得完全缓解。同期选择性别与年龄相符的健康志愿者30例。入选者均签署知情同意书;本研究经医院伦理委员会审核批准。
1.2 样本收集 采集AML患者与健康志愿者的晨起空腹静脉血3~5 mL,置于EDTA抗凝管,4 ℃静置1 h,采用Ficoll密度梯度离心法(人外周血单核细胞分离液试剂盒,北京索莱宝科技有限公司),4 ℃、400 g 离心30 min,收集外周血中的单核细胞,洗涤后沉淀。采用磁珠分离法(免疫磁珠分选试剂盒,德国美天旎生物技术有限公司)分离外周血中的CD34阳性单核细胞。
1.3 外周血中lncRNA HOTAIR 表达检测 采用qRT-PCR技术。用TRIzol法提取单核细胞的总RNA,按照RNA提取试剂盒(美国Invitrogen公司)的说明书进行操作。用紫外分光光度计(美国Thermo公司)检测总RNA浓度及纯度,逆转录试剂盒(大连宝生物工程有限公司)进行逆转录,cDNA产物置于-20 ℃保存备用。qRT-PCR引物序列(南京金斯瑞生物科技公司)如下:lncRNA HOTAIR正向引物:5′-GGTAGAAAAAGCAACCACGAAG-3′,反向引物:5′-ACATAAACCTCTGTCTGTGAGTGC-3′;18S rRNA正向引物:5′-AGGACATGCATGGACACAGA-3′,反向引物:5′-GGACGGAATCAACTCTGACA-3′。用定量PCR扩增仪(ABI 7500,美国ABI公司)检测lncRNA HOTAIR表达。qRT-PCR扩增体系10 μL;反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,35个循环。采用2-ΔΔCt法计算lncRNA HOTAIR的相对表达量。以大于等于相对表达量平均值为lncRNA HOTAIR高表达,小于其相对表达量平均值为低表达。
1.4 随访 对完全缓解56例患者采用电话或门诊就诊的方式进行随访。随访时间为进入完全缓解期后1~60个月至患者复发、死亡或2017年6月。
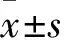
2 结果
2.1 AML患者外周血中LncRNA HOTAIR表达变化 初诊AML患者、完全缓解患者化疗前后、健康志愿者外周血中LncRNA HOTAIR相对表达量分别为3.92±0.47、4.82±0.36、2.91±0.13、1.15±0.18。初诊AML患者外周血lncRNA HOTAIR相对表达量高于健康志愿者(P<0.05);完全缓解患者化疗后外周血lncRNA HOTAIR相对表达量低于化疗前(P<0.05)。
2.2 LncRNA HOTAIR表达与AML患者临床病理参数的关系 LncRNA HOTAIR高表达与AML患者的年龄、性别、FAB亚型、是否完全缓解及AML危险度分层无关(P均>0.05),与白细胞计数(WBC)、血小板(PLT)、血红蛋白(Hb)水平有关(P均<0.05)。见表1。
2.3 LncRNA HOTAIR表达与AML患者预后的关系 行诱导化疗的AML患者86例,其中lncRNA HOTAIR高表达54例、低表达32例。 lncRNA HOTAIR高表达患者化疗完全缓解率为50.00%(27/54),低表达患者化疗完全缓解率为90.62%(29/32),比较差异有统计学意义(P=0.000)。lncRNA HOTAIR高表达完全缓解患者的总生存时间为(15.30±1.94)个月,lncRNA HOTAIR低表达完全缓解患者总生存时间为(30.52±2.34)个月,比较差异有统计学意义(P=0.000)。

表1 LncRNA HOTAIR高表达与AML患者临床病理参数的关系(例)
3 讨论
AML是成人最常见的急性白血病类型,起病急,病程进展迅速,发病率和病死率均呈逐年增高趋势[8]。为提高AML患者的治疗效率、改善AML患者的预后,近年来,越来越多的研究倾向于揭示AML的发病机制,寻找新的治疗靶标[9]。
LncRNA的异常表达与肿瘤的发生、发展密切相关,且多种lncRNA被证实与血液系统恶性肿瘤相关[10]。LncRNA HOTAIR是首个被发现的LncRNA,在胃癌[11]、宫颈癌[12]等多种恶性肿瘤组织中异常高表达,发挥促癌基因的功能。lncRNA HOTAIR可与多梳蛋白抑制复合物2(PRC2)相互作用,促进PRC2到达靶基因染色质区,调节下游靶基因表达,促进肝癌细胞侵袭转移。此外,lncRNA HOTAIR参与获得性耐药的产生。如在肺癌A549/DDP耐药细胞中,敲除lncRNA HOTAIR后,能够逆转细胞的化疗耐药[13]。lncRNA HOTAIR可作为多种肿瘤患者预后预测的分子标记物[14],然而lncRNA HOTAIR的表达及与AML患者预后的关系尚不清楚。
本研究采用qRT-PCR法检测健康志愿者和初诊AML患者外周血中lncRNA HOTAIR表达,结果显示,lncRNA HOTAIR在初诊AML患者外周血中高表达,此结果与lncRNA HOTAIR在膀胱癌[15]、乳腺癌[16]等实体肿瘤组织中的表达一致。提示lncRNA HOTAIR高表达可能参与并且促进了AML的发生。本研究接受标准DA方案化疗的86例患者中,有56例患者完全缓解,化疗后完全缓解AML患者外周血lncRNA HOTAIR表达较化疗前降低,提示lncRNA HOTAIR表达与AML的化疗疗效相关;化疗过程中检测lncRNA HOTAIR表达变化可监控AML患者的病情。
AML患者常伴有严重的并发症,如外周血WBC异常增高,致使血液黏度增加,小血管内易形成微血栓,损伤肺、脑等重要器官,进而导致呼吸窘迫综合征、脑出血等危及生命的并发症[17];AML患者常伴有PLT减少症,对于PLT计数<50×109/L的患者,需要预防性或治疗性输注PLT,而PLT输注无效引起的严重出血是导致AML患者高病死率的重要原因之一[18];此外,低Hb与AML患者的总生存时间密切相关,且可作为AML患者长期无复发生存的预测指标[19]。本研究发现,lncRNA HOTAIR高表达预示患者具有较高的WBC水平,较低的PLT、Hb水平。提示lncRNA HOTAIR高表达的AML患者常合并多种并发症。
lncRNA HOTAIR高表达的AML患者,接受化疗后的完全缓解率更低,且总生存时间更短,提示lncRNA HOTAIR高表达具有作为AML患者不良预后靶分子的潜能。
综上所述,本研究证实lncRNA HOTAIR在初发AML患者外周血中高表达,且经化疗获得完全缓解后,lncRNA HOTAIR表达水平有所下降;lncRNA HOTAIR高表达的AML患者完全缓解率低、总生存时间短,预后更差。lncRNA HOTAIR可作为AML治疗和预后预测的潜在靶点。
[1] Troy JD, Atallah E, Geyer JT, et al. Myelodysplastic syndromes in the United States: an update for clinicians[J]. Ann Med, 2014,46(5):283-289.
[2] Daver N, Cortes J. Molecular targeted therapy in acute myeloid leukemia[J]. Hematology, 2012,17(Suppl 1):S59-S62.
[3] Tallman MS, Gilliland DG, Rowe JM. Drug therapy for acute myeloid leukemia[J]. Blood, 2005,106(4):1154-1163.
[4] Pan JQ, Zhang YQ, Wang JH, et al. lncRNA co-expression network model for the prognostic analysis of acute myeloid leukemia[J]. Int J Mol Med, 2017,39(3):663-671.
[5] Zhang J, Zhang P, Wang L, et al. Long non-coding RNA HOTAIR in carcinogenesis and metastasis[J]. Acta Biochim Biophys Sin (Shanghai), 2014,46(1):1-5.
[6] Bennett JM, Catovsky D, Daniel MT, et al. Proposed revised criteria for the classification of acute myeloid leukemia. A report of the French-American-British Cooperative Group[J]. Ann Intern Med, 1985,103(4):620-625.
[7] Kuriyama K. Classification of myeloid leukemias[J]. Nihon Rinsho, 2009,67(10):1853-1862.
[8] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[9] Schlenk RF. Post-remission therapy for acute myeloid leukemia[J]. Haematologica, 2014,99(11):1663-1670.
[10] Guttman M, Amit I, Garber M, et al. Chromatin signature reveals over a thousand highly conserved large non-coding RNAs in mammals[J]. Nature, 2009,458(7235):223-227.
[11] Lee NK, Lee JH, Park CH, et al. Long non-coding RNA HOTAIR promotes carcinogenesis and invasion of gastric adenocarcinoma[J]. Biochem Biophys Res Commun, 2014,451(2):171-178.
[12] Huang L, Liao LM, Liu AW, et al. Overexpression of long noncoding RNA HOTAIR predicts a poor prognosis in patients with cervical cancer[J]. Arch Gynecol Obstet, 2014,290(4):717-723.
[13] Liu Z, Sun M, Lu K, et al. The long noncoding RNA HOTAIR contributes to cisplatin resistance of human lung adenocarcinoma cells via downregualtion of p21(WAF1/CIP1) expression[J]. PLoS One, 2013,8(10):e77293.
[14] Qiu JJ, Lin YY, Ye LC, et al. Overexpression of long non-coding RNA HOTAIR predicts poor patient prognosis and promotes tumor metastasis in epithelial ovarian cancer[J]. Gynecol Oncol, 2014,134(1):121-128.
[15] Yan TH, Lu SW, Huang YQ, et al. Upregulation of the long noncoding RNA HOTAIR predicts recurrence in stage Ta/T1 bladder cancer[J]. Tumour Biol, 2014,35(10):10249-10257.
[16] Zhuang Y, Nguyen HT, Burow ME, et al. Elevated expression of long intergenic non-coding RNA HOTAIR in a basal-like variant of MCF-7 breast cancer cells[J]. Mol Carcinog, 2015,54(12):1656-1667.
[17] How J, Sykes J, Gupta V, et al. Influence of FLT3-internal tandem duplication allele burden and white blood cell count on the outcome in patients with intermediate-risk karyotype acute myeloid leukemia[J]. Cancer, 2012,118(24):6110-6117.
[18] Berthelot-Richer M, Boilard B, Morin A, et al. Romiplostim efficacy in an acute myeloid leukemia patient with transfusion refractory thrombocytopenia[J]. Transfusion, 2012,52(4):739-741.
[19] Zhou JD, Wen XM, Zhang YY, et al. Down-regulation of GPX3 is associated with favorable/intermediate karyotypes in de novo acute myeloid leukemia[J]. Int J Clin Exp Pathol, 2015,8(3):2384-2391.

