水稻/拟南芥防御病原细菌入侵的表观遗传调控研究进展
徐以华 黎起秦 刘连盟 王玲 丁新华 侯雨萱 黄世文
(1. 中国水稻研究所水稻生物学国家重点实验室,杭州 310006;2. 广西大学农学院,南宁 530003;3. 山东农业大学植物保护学院,泰安 271018)
在生长发育过程中,植物不可避免的会受到真菌、细菌、病毒以及昆虫等各种生物的攻击。虽然植物不具备免疫细胞,但是面对病原菌的入侵,植物相应的进化出了复杂的应对机制——免疫防御反应。植物主要依靠与病原菌相关的分子模式(Pathogen associated molecular pattern,PAMP)或病原菌攻击时产生的内源分子,即损伤相关模式(Damageassociated molecular patterns,DAMPs)诱发的广谱性防御(PAMP Triggered Immunity,PTI)和 病原菌来源的效应子激发的特异性免疫反应(Effector Triggered Immunity,ETI)抵抗侵染[1-5]。PTI相当于植物的第一层免疫防御反应,由宿主植物细胞表面的模式识别受体激活(Pattern recognition receptors,PRRs),病原菌入侵时,PRRs相应的识别PAMP(包括脂多糖、细菌鞭毛蛋白、脂肽和肽聚糖等)或DAMPs从而作出防御反应,抑制病原菌的初步侵染[6-7]。然而,病原菌面对植物的防御会见招拆招,利用特异的效应蛋白(Effector)来抑制植物的PTI,帮助病原在植物体内繁殖或扩散;相应地,针对病原物的effector又会诱发某些植物的ETI防御病原菌侵染,即植物的第二层免疫防御反应,主要由核苷酸结合的富含亮氨酸重复的受体(Nucleotide binding-leucine rich repeat receptors,NLRs)即抗性相关基因(Resistance gene,R)调控,直接或间接识别效应蛋白,诱发植物抗性,并触发植物自身过敏反应,导致植物细胞自主凋亡,阻止病原菌的进一步扩散[2,4,7-8]。在上述病原菌 -植物的动态相互作用过程中,迫使植物相关机制的进化,快速而准确地激活/抑制防御反应相关基因的表达来建立局部和系统性抗性。
近年的研究表明,表观遗传在激活/抑制植物防御反应相关基因的表达方面起着非常重要的调控作用[9-10]。表观遗传主要指DNA的甲基化、组蛋白N端的甲基化、乙酰化、泛素化、磷酸化等共价修饰,小RNA也属于这个范畴。它在不改变基因序列的情况下就可以调控植物防御相关基因的表达,迅速激活特定的防御反应(水杨酸、茉莉酸、乙烯信号传递途径等)来对抗病原菌[11]。并且这些病原菌诱导形成的表观修饰能够遗传给后代,增强防御能力[2,11-14]。
水稻和拟南芥分别是单子叶和双子叶植物研究的重要模式植物,丁香假单胞杆菌番茄致病变种 DC3000[Pseudomonas syringaepv. tomato(Pst)DC3000]和白叶枯病原菌(Xanthomonas oryzaepv.oryzae,Xoo)是最普遍和最具代表性的重要病原细菌。本文主要在已报道的科学试验结果的基础上,总结了表观遗传修饰在水稻/拟南芥防御两种病原细菌入侵中的作用,重点阐明水稻/拟南芥的基因组DNA甲基化、组蛋白修饰以及小RNA在防御反应中的分子调控机理,以便更好地理解表观遗传修饰对病原细菌入侵的响应,为其他作物的表观遗传抗病研究提供理论参考。
1 DNA甲基化与抗病性
基因组DNA的表观遗传修饰主要是DNA甲基化,它是很多生物过程包括遗传印迹、X染色体失活、细胞分化、基因沉默等的基础,主要通过共价修饰调控基因的表达[5]。在植物中,生物基因组DNA胞嘧啶核苷酸上均能发生DNA的甲基化,主要是在CG,CHG和CHH(其中H可以是A、C或T)序列中的胞嘧啶上添加一个甲基,由DNA甲基转移酶家族(DNA Methyltransferase,DnMT)催化完成[15]。植物中的DNA甲基转移酶主要有:负责维持DNA甲基化的DNA甲基转移酶1(DNA methyltransferase 1,MET1)和染色质甲基化酶(Chromomethylases,CMTs),它们根据亲链上甲基化位点对已经完成复制的半甲基化DNA做相应的甲基化修饰;结构域重排甲基转移酶2(Domains rearranged methyltransferase 2,DRM2),由RNA介导作用于基因组上的同源特异序列,不依赖DNA的复制,在完全去甲基化的位点上催化DNA序列从头甲基化[3,15]。通常,基因组DNA的高度甲基化沉默基因的表达,而活跃表达的基因的启动子是低甲基化的。
DNA甲基化不仅在基因表达、细胞分化以及系统发育过程中起着重要的调控作用,而且在植物对病原细菌的防御反应中也扮演着重要角色,一些生物逆境应答基因就是通过DNA的甲基化和去甲基化调控的[4,16]。早在 1975年,Guseinov和Vanyushin[16]就从生化水平上提出了植物可以通过改变基因组胞嘧啶甲基化状态防御病原菌的入侵。目前,从分子水平上已有大量研究证实病原菌的侵染能诱导植物DNA甲基化动态变化,从而改变基因表达水平。通常基因组DNA的低甲基化程度激活植物防御反应。2006年,Pavet等[17]发现拟南芥被PstDC3000侵染后,其体内很多基因组序列变为低甲基化状态。2012年,Matzke证实DNA甲基化基 因(MET1-3,DDC,DRM1-2,DRM2-2,CMT3-11)缺陷的拟南芥突变体被PstDC3000侵染后,同野生型相比对DC3000抗性增强,且多个甲基化基因同时敲除的突变体表现出更高的抗性[3,18-19]。说明基因组甲基化水平的降低能够增强拟南芥对PstDC3000的抗性。此后又有研究报道,拟南芥表观遗传调节子延伸复合物亚基2(ELP2)是快速防御反应中重要的转录激活剂,而病程相关基因非表达子1(Nonexpressor of pathogenesis-related genes1,NPR1)是ELP2防御反应中的共激活剂;ELP2参与调节NPR1的基础甲基化水平,两者协同调控拟南芥对DC3000的防御反应。DC3000/avrRpt 2接种野生型和elp2突变体,发现elp2突变体因ELP2的缺失而无法调节病原菌应答基因NPR1基因DNA甲基化水平,表现为NPR1启动子区的DNA甲基化水平同野生型相比较高且稳定,从而延迟了防御基因的表达。由此表明,elp2在改变病原菌诱导的DNA甲基化水平,参与调控防御基因表达有重要作用[3,19](表1)。另外,RNA能够通过RNA指导的DNA甲基化(RNA-directed DNA methylation,RdDM)路径参与DNA甲基化过程。在RdDM组分AGO4(Argonaute 4)蛋白突变的拟南芥中,基因组DNA甲基化程度降低,且对致病菌PstDC3000和含avrRpm1效应子的非致病菌更敏感[3,20](表1)。说明RNA介导的DNA甲基化也参与植物防御反应。
此外,在植物体内还存在DNA去甲基化过程,由DNA糖基化酶催化的DNA去甲基酶家族完成[21-22]。目前,已鉴定的拟南芥中的DNA去甲基酶 有 DME(Demeter)、ROS1(Repressor of silencing1)也叫 DML1(DME-like 1)、DML 2(DME-like 2)和 DML3(DME-like 3)[3]。研究证实,PstDC3000侵染拟南芥ros1突变体后,其体内抗病基因(RMG1或At4g11170)启动子中的转座因子(AtREP 11)的胞嘧啶甲基化显著增加,从而降低了该抗病基因的表达,显示出对DC3000的敏感性增加(表1)。表明DNA去甲基化在拟南芥防御细菌入侵中起积极作用,特别是含转座子启动子的DNA去甲基化能够增强植物抗病性[23],正调控植物对病原细菌的抗性。
综上所述,当植物遭遇病原细菌侵染时,基因组的DNA甲基化水平会降低,激活抗病防御反应相关基因的表达,从而增强植物的抗病能力。这个过程由DNA甲基转移酶和去甲基酶基因共同调控。
2 组蛋白翻译后修饰与抗病性
基因组DNA和组蛋白(包括H2A,H2B,H3和H4四个亚单位)能够有组织的包装成核小体,是染色质的基本组成单位。核小体中的任何一个核心组蛋白都可能发生包括甲基化、乙酰化、泛素化、磷酸化、ADP-核糖基化等在内的表观遗传修饰,改变染色体结构,从而激活/抑制基因的表达[24]。一般而言,H3第4位和36位赖氨酸(H3K4和H3K36)的甲基化和H3 与H4高乙酰化修饰激活基因的表达;H3第9位和27位赖氨酸(H3K9和H3K27)的甲基化和H3 与H4低乙酰化修饰抑制基因的表达。
目前,病原细菌能诱导水稻/拟南芥组蛋白N端的氨基酸残基发生可逆的共价修饰,在其防御病原菌入侵过程中有非常重要的作用。研究得比较清楚的是赖氨酸残基的甲基化/去甲基化修饰,乙酰化/去乙酰化,丝氨酸和苏氨酸的泛素化修饰等在水稻/拟南芥防御病原菌入侵过程中的表观遗传调控功能[25]。
2.1 组蛋白甲基化/去甲基化修饰
组蛋白甲基化修饰由含进化上保守的SET结构域的组蛋白甲基转移酶(Histone methyltransferases,HMTs)调节。病原细菌诱导的组蛋白甲基化修饰能够激活宿主的细胞信号级联反应,激活/抑制防御基因的表达,从而增强/减弱植株的抗性。最近的研究表明,拟南芥的H3K4组蛋白甲基转移酶ATX1对基础抗病性反应起重要作用。ATX1通过调节WRKY70(水杨酸和茉莉酸信号途径的关键转录因子)启动子的H3K4的甲基化来激活WRKY70的表达,从而上调水杨酸(Salicylic acid,SA)信号途径基因PR1的表达以及下调茉莉酸(Jasmonic Acid,JA)信号途径基因THI2.1的表达,参与到拟南芥对PstDC3000 侵染的防御反应[26-27](表 1)。说明依赖ATX1的H3K4甲基化修饰参与SA和JA两条抗病信号通路,协同调控抗病,是拟南芥防御PstDC3000侵染不可或缺的调控因子。
SDG8,H3K36组蛋白甲基转移酶,通过介导RPS4-like R基因(LAZ5)位点的H3K36三甲基化,上调LAZ5基因的表达,在拟南芥对抗PstDC3000攻击的天然免疫中起正调控作用(表1)。另有报道,SDG8通过介导ERF1、MYC2、PDF1.2a和VSP2等JA/ ET信号途径基因位点,诱导这些基因的快速转录,增强拟南芥对真菌(黑斑病菌和灰霉病菌)的抗性[28]。这充分表明依赖SDG8的H3K36甲基化修饰能同时正调控对细菌及真菌的防御反应,其作用具有非特异性。
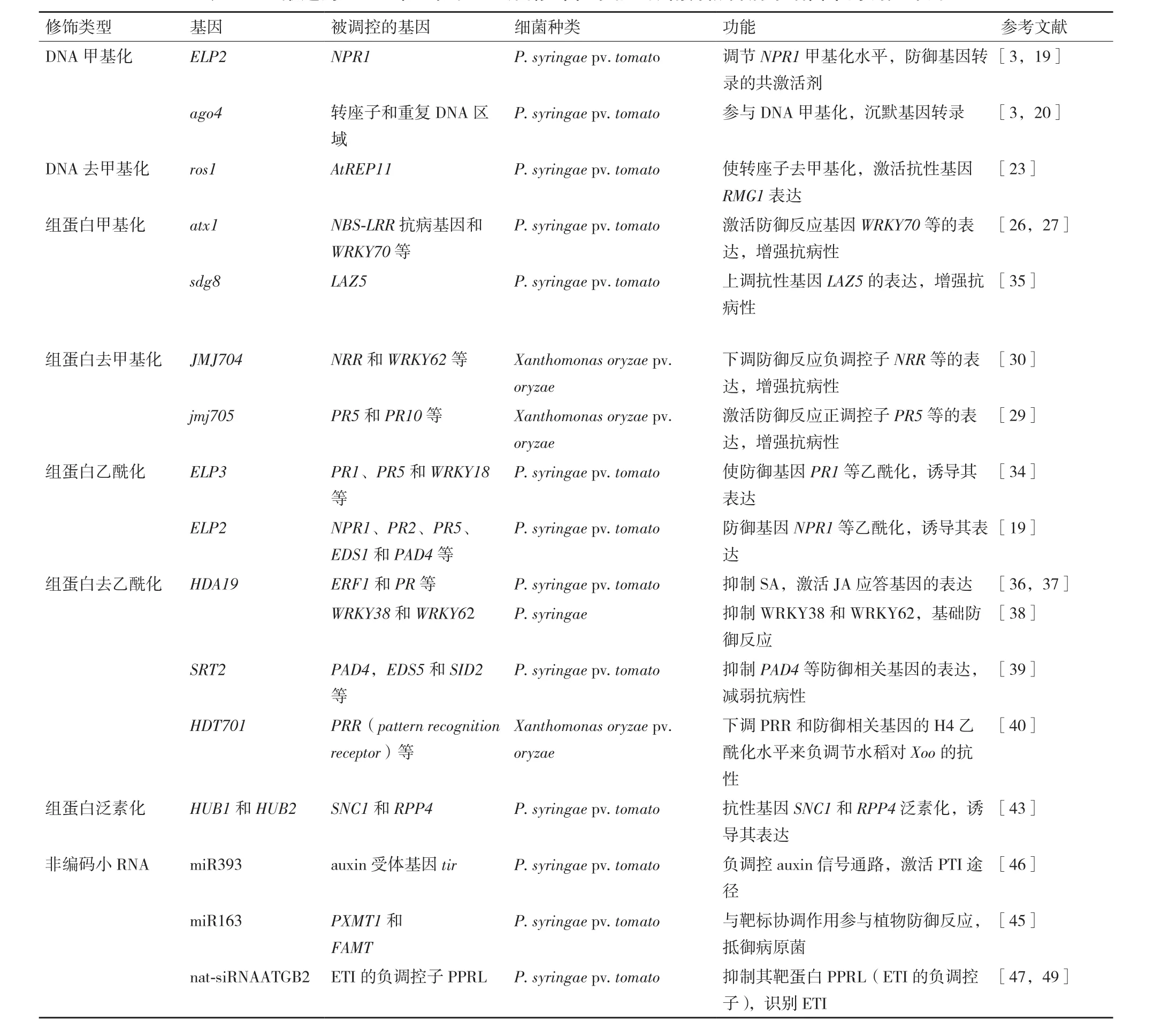
表1 已报道的DNA甲基化和组蛋白修饰在水稻/拟南芥防御病原细菌中的调控作用
组蛋白的甲基化转移酶通过修饰重要抗病信号途径(SA/JA等)基因或直接修饰R基因来激活或抑制其表达,从而调控水稻/拟南芥对病原细菌的防御方应。组蛋白去甲基化和甲基化修饰是互逆的动态过程,也参与到水稻/拟南芥防御病原细菌入侵的过程中,起到非常重要的调控作用。水稻jmjC去甲基化酶JMJ705特异地去除H3K27位点的甲基化修饰;白叶枯病原菌侵染水稻后,能诱导JMJ705的表达[29];超量表达的JMJ705可激活水稻抗病防御反应相关基因的表达,增强水稻对Xoo的抗性。相应地,抑制表达的JMJ705会减弱对Xoo的抗性[29]。实验还证明,JMJ705是通过去除JA信号途径相关基因的H3K27三甲基化修饰来增强它们的表达,从而提高水稻的抗性[3](表1)。另外,研究还证实水稻jmjC去甲基化酶基因家族另一个成员JMJ704也参与到水稻对Xoo防御反应。JMJ704能被Xoo诱导表达;且该基因的两个等位突变体均表现出对Xoo的抗性减弱[30](表1)。但是,与JMJ705的作用机制不同,JMJ704通过降低抗病负调控因子的H3K4的甲基化水平,抑制抗病负调控因子的表达,从而实现水稻对Xoo的正调节;而JMJ705则是通过上调抗病正调控因子的表达增强水稻对Xoo的抗性。这一结果表明,jmjC基因家族对水稻白叶枯的抗性存在着增强抗病基因表达和减弱感病基因表达的双向调控通路。
目前所证实的无论是H3K4、H3K27,还是H3K36位点的甲基化/去甲基化都是通过上调SA/JA信号途径的基因或R基因的表达来正调控对PstDC3000和Xoo的防御反应。这些修饰之间有没有协同和拮抗的作用;对其他病原菌的作用又如何;H3K4、H3K27、H3K36和H3K9以及精氨酸位点的甲基化/去甲基化对PstDC3000和Xoo的作用模式是否一样,这些具体的问题都有待我们去进一步探索和研究。
2.2 组蛋白乙酰化/去乙酰化修饰
与组蛋白去甲基化和甲基化修饰类似,组蛋白的乙酰化和去乙酰化也是互逆的动态过程,由组蛋白乙酰转移酶(Histone acetyltransferases,HATs)和去乙酰化酶(Histone deacetyltransferases,HDAs)共同调节组蛋白末端的赖氨酸残基的乙酰化水平。通常,组蛋白乙酰化激活基因转录,而组蛋白去乙酰化既可激活转录又可抑制转录[29,31-32]。在水稻/拟南芥中,HATs和HDAs除调控生长发育基因的表达外,还与抗病性有关[3]。
ELP3是延伸复合物的催化亚单位,其C端具有HAT结构域,N端具有富含半胱氨酸基序,具HAT活性,能乙酰化4种组蛋白,在ELP3参与的免疫反应中至关重要[33]。elp3功能缺失突变体感染PstDC3000后,会延迟诱导防御基因(包括PR1,PR5和WRKY18)表达[34](表 1)。与 ELP3 类似,ELP2是免疫反应的共激活剂,通过与NPR1相互作用参与植物防御反应。与野生型植物相比,elp2突变体中的NPR1、PR2、PR5、EDS1和 PAD4中的H3K9/14乙酰化水平较低,这可部分解释elp2诱导的组蛋白乙酰化与防御基因表达有关[19](表1)。
植物的HDAs可分为RPD3/HDA1、SIR2(Silent information regulator 2)和 HD2(Histone deacetylase-II)3大类型。组蛋白去乙酰化修饰在抗病方面的作用最早要追溯到对HDA1型去乙酰化酶HDA19(Histone Deacetylase 19,HDA19)的研究。HDA19与植物的多个生长发育过程相关。在拟南芥中,HDA19参与SA介导的防御反应[35]。HDA19活性的丧失使SA的含量增多,SA信号传递途径基因(如病程相关基因PR1、PR4和PR5)表达增强,表现为对P. syringaepv.tomatoDC3000抗性增强[36-37](表1)。另一方面,研究证实HDA19参与激活拟南芥中JA介导的防御反应。HDA19的超量表达促使JA信号途径基因ERF1的表达上调,增强拟南芥对黑斑病菌(Alternaria brassicicola)的抗性(表1)。此外,拟南芥中由P. syringae诱导的HDA19抑制WRKY38和WRKY62的转录活性,其中WRKY38和WRKY62是基础防御反应PR基因的负调节子[38](表1)。拟南芥SIR2型去乙酰化酶SRT2通过抑制PAD4,EDS5和SID2等SA信号途径基因的表达负调控拟南芥对番茄丁香假单胞菌(Pseudomonas syringaepv.tomatoDC3000)的防御反应[39](表 1)。
水稻中的HD2型去乙酰化酶HDT701是天然免疫的负调节子调控水稻免疫反应。HDT701超表达的转基因水稻对稻瘟病菌(Magnaporthe oryzae)和白叶枯病菌(Xoo)更敏感且组蛋白H4乙酰化水平下降;相应地HDT701的缺失突变株对两种病原菌抗性增强。进一步实验证明,水稻中的拟南芥鞭毛蛋白受体激酶(Receptor kinase flagellin sensing 2,FLS2)同源蛋白OsFLS2乙酰化水平的增强,以及防御相关基因MAPK6和WRKY53的表达和活性氧的爆发会提高水稻抗性[40](表1)。综上所述,乙酰化酶通过乙酰化相关防御基因来激活其表达,从而正调控水稻/拟南芥对病原细菌的入侵;不论哪一类型的去乙酰化酶,一般而言都是通过对SA和JA等重要抗病信号途径和防御反应相关基因的去乙酰化,抑制其表达来负调控水稻/拟南芥对病原细菌的入侵。但是也有例外,HDA19可以增强JA/ET信号途径基因ERF1的表达,正调控拟南芥对黑斑病菌的防御反应。因此,每一种乙酰化/去乙酰化修饰对病原菌入侵的作用都需要逐个研究。
2.3 组蛋白泛素化修饰
组蛋白泛素化主要发生在组蛋白H2A和H2B上,是自由的泛素分子或泛素链通过依赖于ATP的蛋白酶体系结合到特定底物的过程。分为单泛素化和多泛素化两种类型,由泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)催化实现[41],能够激活或抑制转录。在拟南芥中,组蛋白H2B单泛素化(Histone H2B monoubiquitination,H2Bub) 由 两个E3泛素连接酶HUB1(Histone monoubiquitibation 1)和 HUB2(Histone monoubiquitibation 2)催化形成[42]。通常,H2Bub与转录激活相关。
有研究表明,HUB1和HUB2调节R基因SNC1(Suppressor ofnpr1-1,constitutive1)和RPP4(Resistance to peronospora parasitica 4)的表达。HUB1通过调节SNC1/RPP4位点H2B单泛素化来调控SNC1/RPP4表达[42]。野生型植株感染PstDC3000后,会适度上调SNC1,同时SNC1的组蛋白H2B单泛素化水平增高。而在HUB1或HUB2功能缺失的突变体中,则会减少SNC1的上调。表明病原菌诱导的抗性基因SNC1的表达依赖 HUB1 和 HUB2[42](表 1)。
组蛋白泛素化不但直接激活R基因的表达,增强抗病性激活,还广泛参与包括JA、SA、ET、效应因子触发的免疫反应ETI以及病原相关分子模式触发的免疫PTI等在内的防卫信号传递过程。
3 小RNA与抗病性
动植物体内有一类非编码的小RNA(Small RNA),能够调控mRNA降解,抑制转录、翻译,影响染色质修饰,是重要调控因子,参与调节包括叶片发育、开花时间、胚胎形成和防御反应等多个生物过程[44-45]。植物内源小RNA根据生物合成途径可分为miRNA(microRNA)和siRNA(short interfering RNA)两类。miRNA是20-22 nt的单链RNA,与靶mRNA高度互补,通过封闭mRNA抑制基因的表达。siRNA是由双链RNA前体加工而来,主要通过DNA甲基化、组蛋白修饰、mRNA降解和翻译抑制沉默基因表达[44]。
拟南芥miR393是植物中最早发现的miRNA分子,通过负调控生长素(Auxin)信号通路在植物PTI中起重要作用[2,46]。病原细菌侵染植物后,细菌多肽f1g22会诱导宿主植物miR393表达,使其靶分子auxin的受体TIR(Toll/interleukin-1 receptor)降解,auxin信号通路下调,从而抑制细菌增殖(表1)[46]。tir突变植株对PstDC3000敏感性增强,表明miR393在植物防御病原菌中起重要作用[47]。有研究报道,丁香假单胞菌的f1g22诱导的PTI,通过miR160a负调控、miR398b和miR773 正调控胼胝质沉积,参与拟南芥对细菌病害的防御反应[2,20]。此外,Fahlgren等[48]以PstDC3000hrcC侵染拟南芥叶片1 h或3 h,经小RNA表达谱分析发现,miR393、miRl67和miRl60均超表达,且它们都通过靶向auxin受体基因或auxin应答因子负调控auxin信号,抑制细菌增殖。2017年,Chow HT等[45]报道了一个非保守的小RNA——miR163,它与小分子甲基转移酶(Small-molecule methyltransferases,MTs)有关,参与调节植物防御反应。早期有报道,其在拟南芥中作为防御反应的负调控因子。后来发现,当其与组蛋白脱乙酰酶(或其他靶标,如PXMT1和FAMT)协调作用时,又能够提高植物抗性,抵御Pst的侵染。
siRNA也可以调控植物免疫,具有avrRpt2效应子的PstDC3000侵染植株能特异性诱导拟南芥中天然反义转录本来源的siRNA[snatural antisense transcript(NAT)-associated siRNAs,nat-siRNAs]和长siRNA(lsiRNA-1),从而抑制其靶蛋白PPRL(ETI的负调控子),识别病原菌衍生效应子并激活ETI,起到防御病原菌的作用[2,47,49](表 1)。上述研究结果表明,植物病原菌入侵宿主植物后,产生的效应子可诱导植物中siRNA与特定抗性通路中的负调控因子作用而使之下调,进而激活ETI免疫反应。此外,siRNA还可通过介导DNA甲基化和组蛋白修饰诱导基因转录沉默[47,50]。
小RNA介导的基因沉默是植物抵抗病原细菌非常重要的调节机制之一,但是其调控植物免疫反应是一个复杂的过程。目前还需要进一步研究其功能,挖掘更多与抗病相关的小RNA并解析其机理,拓展植物病理学的研究。
4 小结
近年来表观遗传学已经成为生命科学研究关注的热点。植物对病原细菌的免疫防御反应有严格且复杂的调控机制。越来越多的研究表明,表观遗传修饰在水稻/拟南芥对病原细菌入侵的防御反应中起着关键的调控作用。表观遗传修饰通过激活/抑制宿主R基因、重要抗病信号途径(SA/JS等)以及防御反应相关基因的表达,从而调控水稻和拟南芥对病原细菌的抗性。
目前,我们对表观遗传修饰调控宿主的抗病防御反应过程已有初步的了解,但所认知的只是单个的表观遗传修饰的调控功能,众多表观遗传修饰在植物免疫防御中的联系及相互作用机制尚不明确;不同类型病原菌诱导的表观遗传修饰的范围和种类仍有待阐明;哪些与植物免疫力相关的表观遗传修饰可以传递给后代,以及这些修饰在病原菌共存的选择性压力下的稳定性都有待进一步探索。另外一方面,大量研究证实表观遗传修饰在植物的生长、发育和抗逆过程中发挥着重要的作用,是植物生命周期各个过程不可或缺的调控因子。如果表观遗传修饰在抗病防御反应中作用显著,是不是会削弱它在其他生长发育过程中的作用,植物的其他性状是否会受到影响,其如何有效协调植物各个生命过程?
今后,我们应深入挖掘表观遗传调控植物抗病性相关基因并分析其抗病调控功能,从基因组水平选育抗病品种;充分利用高通量测序从整体水平研究表观遗传修饰与各类病原菌的互作,与宿主植物免疫反应的机制;从遗传、分子、生化等方面深入探究表观遗传修饰在调控抗病和植物其它性状之间的协调机制;DNA甲基化是表观遗传中非常重要的一个过程,通常与组蛋白甲基化、乙酰化等多个表观途径密切相关,各表观遗传途径之间的相互作用还不明确;siRNA和组蛋白甲基化均可介导DNA甲基化,但是其参与免疫反应的机制还需进一步明确,它们是直接还是间接作用于抗病相关基因也还不清楚;其他多个表观遗传修饰是协同或拮抗作用调控植物免疫反应需要我们进一步研究。此外,表观遗传修饰能够遗传给后代,但传递机制还不清楚,如何利用这种机制调控和提高植物的抗性还有待研究,且可以利用跨世代遗传的特性改变植物的表观修饰为抗病育种提供新思路。这不仅有助于我们从理论上了解表观遗传学对植物抗病的分子调节机制,挖掘更多的表观遗传抗病性基因,而且在应用上可以为抗病遗传育种提供优良基因资源,培育高抗优质品种,减少粮食损失,保障国家粮食安全。
[1]Jones JDG, Dangl JL. The plant immune system[J]. Nature, 2006,444(7117):323.
[2]耿帅锋, 李爱丽, 毛龙. RNA介导的DNA甲基化路径在植物抗病中的研究进展[J]. 中国农业科学, 2015, 48(S):16-22.
[3]Zhu QH, Shan WX, Ayliffe M, et al. Epigenetic mechanisms:an emerging player in plant-microbe interactions[J]. Molecular Plant-Microbe Interactions, 2015, 29(3):187-196.
[4]Espinas NA, Saze H, Saijo Y. Epigenetic control of defense signaling and priming in plants[J]. Frontiers in Plant Science, 2016, 7(1201):1-7.
[5]Ranf S. Sensing of molecular patterns through cell surface immune receptors[J]. Curr Opin Plant Biol, 2017, 38 :68-77.
[6]Ding B, Wang GL. Chromatin versus pathogens:the function of epigenetics in plant immunity[J]. Frontiers in Plant Science,2015, 6(675):675.
[7]李智强, 王国梁, 刘文德. 水稻抗病分子机制研究进展[J].生物技术通报, 2016, 32(10):97-108.
[8]Gijzen M, Ishmael C, Shrestha SD. Epigenetic control of effectors in plant pathogens[J]. Frontiers in Plant Science, 2014, 5:638.
[9]Alvarez ME, Nota F, Cambiagno DA. Epigenetic control of plant immunity[J]. Mol Plant Pathol, 2010, 11(4):563-576.
[10]王树昌. 表观遗传学在植物中的研究[J]. 安徽农业科学,2011, 39(5):2562-2564.
[11]Gao S, Jin H. Host small RNAs and plant innate immunity[J].Non Coding Rnas in Plants, 2011:21-34.
[12]Bari R, Jones JD. Role of plant hormones in plant defence responses[J]. Plant Mol Biol, 2009, 69(4):473-488.
[13]Koornneef A, Pieterse CM. Cross talk in defense signaling[J].Plant Physiology, 2008, 146(3):839-844.
[14]Vlot AC, Dempsey DA, Klessig DF. Salicylic acid, a multifaceted hormone to combat disease[J]. Annu Rev Phytopathol, 2009, 47(1):177-206.
[15]李新玲, 徐香玲. 植物DNA甲基化与表观遗传[J]. 中国农学通报, 2008, 24(1):123-126.
[16]Guseinov VA, Vanyushin BF. Content and localisation of 5-methylcytosine in DNA of healthy and wilt-infected cotton plants[J]. Biochim Biophys Acta, 1975, 395(3):229-238.
[17]Pavet V, Quintero C, Cecchini NM, et al. Arabidopsis displays centromeric DNA hypomethylation and cytological alterations of heterochromatin upon attack by Pseudomonas syringae[J].Molecular Plant-Microbe Interactions, 2006, 19(6):577-587.
[18]Dowen RH, Pelizzola M, Schmitz RJ, et al. Widespread dynamic DNA methylation in response to biotic stress[J]. Proc Natl Acad Sci USA, 2012, 109(32):2183-2191.
[19]Wang Y, An C, Zhang X, et al. The Arabidopsis elongator complex subunit2 epigenetically regulates plant immune responses[J].Plant Cell, 2013, 25(2):762-776.
[20]López A, Ramírez V, García-Andrade J, et al. The RNA silencing enzyme RNA polymerase v is required for plant immunity[J].PLoS Genetics, 2011, 7(12):e1002434.
[21]Penterman J, Zilberman D, Jin HH, et al. DNA demethylation in the Arabidopsis genome[J]. Proc Natl Acad Sci USA, 2007, 104(16):6752-6757.
[22]Zhu JK. Active DNA Demethylation mediated by DNA glycosylases[J]. Annu Rev Genet, 2009, 43(1):143-166.
[23]Yu A, Lepère G, Jay F, et al. Dynamics and biological relevance of DNA demethylation in Arabidopsis antibacterial defense[J]. Proc Natl Acad Sci USA, 2013, 110(6):2389-2394.
[24]韦荣昌, 唐其, 马小军, 等. 植物表观遗传学研究进展[J].北方园艺, 2013(18):170-173.
[25]Kouzarides T. Chromatin modifications and their function[J].Cell, 2007, 128(4):693.
[26]Alvarezvenegas R, Abdallat AA, Guo M, et al. Epigenetic control of a transcription factor at the cross section of two antagonistic pathways[J]. Epigenetics, 2007, 2(2):106-113.
[27]Alvarez-Venegas R, Sadder M, Hlavacka A, et al. The Arabidopsis homolog of trithorax, ATX1, binds phosphatidylinositol 5-phosphate,and the two regulate a common set of target genes[J]. Proc Natl Acad Sci USA, 2006, 103(15):6049-6054.
[28]Berr A, Mccallum EJ, Alioua A, et al. Arabidopsis histone methyltransferase SET DOMAIN GROUP8 mediates induction of the jasmonate/ethylene pathway genes in plant defense response to necrotrophic fungi[J]. Plant Physiology, 2010, 154(3):1403-1414.
[29]Li T, Chen X, Zhong X, et al. Jumonji C domain protein JMJ705-mediated removal of histone H3 lysine 27 trimethylation is involved in defense-related gene activation in rice[J]. Plant Cell, 2013,25(11):4725-4736.
[30]Hou Y, Wang L, Ling W, et al. JMJ704 positively regulates rice defense response against Xanthomonas oryzae pv. oryzae, infection via, reducing H3K4me2/3 associated with negative disease resistance regulators[J]. BMC Plant Biology, 2015, 15(1):286.
[31]Wang Z, Zang C, Cui K, et al. Genome-wide mapping of HATs and HDACs reveals distinct functions in active and inactive genes[J]. Cell, 2009, 138(5):1019-1031.
[32]Zupkovitz G, Tischler J, Posch M, et al. Negative and positive regulation of gene expression by mouse histone deacetylase 1[J].Molecular & Cellular Biology, 2006, 26(21):7913-7928.
[33]Winkler GS, Kristjuhan A, Erdjument-Bromage H, et al. Elongator is a histone H3 and H4 acetyltransferase important for normal histone acetylation levels in vivo[J]. Proc Natl Acad Sci USA,2002, 99(6):3517-3522.
[34]Defraia CT, Wang Y, Yao J, et al. Elongator subunit 3 positively regulates plant immunity through its histone acetyltransferase and radical S-adenosylmethionine domains[J]. BMC Plant Biology,2013, 13(1):102.
[35]De-La-Peña C, Rangel-Cano A, Alvarez-Venegas R. Regulation of disease-responsive genes mediated by epigenetic factors:interaction of Arabidopsis-Pseudomonas[J]. Mol Plant Pathol,2012, 13(4):388-398.
[36]Tian L, Fong MP, Wang JJ, et al. Reversible histone acetylation and deacetylation mediate genome-wide, promoter-dependent and locus-specific changes in gene expression during plant development[J]. Genetics, 2005, 169(1):337-345.
[37]Choi SM, Song HR, Han S K, et al. HDA19 is required for the repression of salicylic acid biosynthesis and salicylic acid-mediated defense responses in Arabidopsis[J]. The Plant Journal, 2012,71(1):135-146.
[38]Kim KC, Lai Z, Fan B, et al. Arabidopsis WRKY38 and WRKY62 transcription factors interact with histone deacetylase 19 in basal defense[J]. Plant Cell, 2008, 20(9):2357-2371.
[39]Wang C, Gao F, Wu J, et al. Arabidopsis putative deacetylase AtSRT2 regulates basal defense by suppressing PAD4, EDS5 and SID2 expression[J]. Plant & Cell Physiology, 2010, 51(8):1291-1299.
[40]Ding B, Bellizzi MR, Ning Y, et al. HDT701, a histone H4 deacetylase, negatively regulates plant innate immunity by modulating histone H4 acetylation of defense-related genes in rice[J]. Plant Cell, 2012, 24(9):3783-3794.
[41]Pérez M, Cañal MJ, Toorop PE. Expression analysis of epigenetic and abscisic acid-related genes during maturation of Quercus suber somatic embryos[J]. Plant Cell Tissue & Organ Culture, 2015,121(2):353-366.
[42]Cao Y, Dai Y, Cui S, et al. Histone H2B monoubiquitination in the chromatin of FLOWERING LOCUS C regulates flowering time in Arabidopsis[J]. Plant Cell, 2008, 20(10):2586-2602.
[43]Zou B, Hua J. Monoubiquitination of histone 2B at the disease resistance gene locus regulates its expression and impacts immune responses in Arabidopsis[J]. Plant Physiology, 2014, 165(1):309-318.
[44]潘丽娜, 王振英. 植物表观遗传修饰与病原菌胁迫应答研究进展[J]. 西北植物学报, 2013, 33(1):210-214.
[45]Chow HT, Ng DW. Regulation of miR163 and its targets in defense against Pseudomonas syringae in Arabidopsis thaliana[J]. Sci Rep, 2017, 7:46433.
[46]Navarro L, Jones JDG. A plant miRNA contributes to antibacterial resistance by repressing auxin signaling[J]. Science, 2006, 312(5772):436-439.
[47]Harenberg J, Huhle G, Giese C, et al. Endogenous small RNAs and antibacterial immunity in plants[J]. FEBS Letters, 2008, 582(18):2679-2684.
[48]Fahlgren N, Howell MD, Kasschau K D, et al. High-throughput sequencing of Arabidopsis microRNAs:evidence for frequent birth and death of MIRNA genes[J]. PLoS One, 2007, 2(2):e219.
[49]Katiyar-Agarwal S, Morgan R, Dahlbeck D, et al. A pathogeninducible endogenous siRNA in plant immunity[J]. Proc Natl Acad Sci USA, 2006, 103(47):18002-18007.
[50]Saze H, Tsugane K, Kanno T, et al. DNA methylation in plants:relationship to small RNAs and histone modifications, and functions in transposon inactivation[J]. Plant & Cell Physiology, 2012, 53(5):766-784.

