基于聚吡咯/石墨烯的甘油酶电极的构建及性能研究
陈东霞,张力,李晓霞,朴金花,梁振兴,姜建国
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.华南理工大学化学与化工学院,广东广州 510640)
甘油的催化氧化是一个复杂的反应体系,包括多个平行和串联反应,可以生成甘油醛和甘油酸等多种产物[4]。通常的甘油催化氧化技术耗时昂贵且复杂繁琐,并且缺乏足够的特异性。已有大量文献报道Pt、Pd和Au纳米颗粒作为电催化剂在助剂的作用下可以选择性催化氧化甘油[3,5~7],但催化剂/产物分离过程复杂,贵金属催化剂重复使用困难,在各种替代技术中,酶由于其具有专一性、高选择性和高效率,表现出了极大的应用前景[8]。
很多研究团队用酶作为催化进行了甘油的催化氧化研究,Minteer[2,9~11]报道了在聚合物基底上使用多壁碳纳米管和其修饰的金纳米颗粒作为酶电极的修饰材料,制备 PQQ固定的乙醇脱氢酶和乙醛脱氢酶修饰电极,在其上进行多步氧化过程以将甘油氧化成丙酮二酸,电流密度高达 16.8±2.1 μA/cm2;Fernando[12]通过采用无机硫化铁单分子线修饰的金电极支撑NAD+-甘油脱氢酶辅酶配合物,制备了甘油氧化生物传感器,其甘油选择性氧化集中在生物转化上,用甘油脱氢酶催化产生 1,3-二羟基丙酮[13,14];Michelle[15]开发了基于甘油激酶和甘油三磷酸氧化酶的电化学方法,通过铂微电极测定生物柴油样品中的游离甘油。
对于酶催化剂,酶的活性位点到电极表面的电子转移的机制通常被分类为直接电子转移(DET)和间接电子转移(MET)。而在各种氧化还原酶中少于10%被证明可以通过 DET机制进行电子转移[16],大多数氧化研究依赖于外源氧化还原电对(可溶性氧化还原物质,还原性初级代谢物或外膜氧化还原蛋白),促进电子从酶活性位点转移,提高整体生物电化学效率。由于聚吡咯良好的环境稳定性,离子交换性能和高导电性,其纳米复合材料被广泛应用于超级电容器,气体检测机理和吸附剂[17~19],如聚吡咯及其改性物质如石墨烯-聚吡咯纳米复合材料被认为是从废水中去除ClO4-的有效吸附剂[20]。基于聚吡咯-石墨烯的纳米复合材料在酶修饰电极的制备中也可以预期去的很好的效果。
本论文研究了一种用于甘油催化氧化的新型酶电极。所构建的甘油酶电极以甘油激酶和甘油三磷酸氧化酶为催化剂,以三维石墨烯为载体,以聚吡咯为介体,同时采用Nafion溶液作为粘结剂,固定的修饰层在酶、介体及电极表面提供良好的电子转移。
1 材料与方法
1.1 材料与试剂
石墨粉(99.0%,天津市大茂化学试剂厂),甘油(99.0%,天津市富宇精细化工有限公司),甘油激酶(25~75 U/mg,Sigma),甘油三磷酸氧化酶(≥70 U/mg,Sigma),吡咯(99.0%,Adamas-beta),Nafion(5 wt%,Dupont D-520,昆山桑莱特新能源科技有限公司),铁氰化钾(99.9%,天津市大茂化学试剂厂)。其他常规试剂均来自广州化学试剂厂,均为分析纯,实验用水为去离子水。
1.2 仪器与设备
场发射扫描电子显微镜(Zeiss Merlin,德国);冷冻干燥机(ALPHA1-4LD plus,德国CHRIST);电化学工作站(CHI660E,上海辰华仪器有限公司);旋转蒸发器(RE-2000A,上海亚荣生化仪器厂);集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司);电热鼓风干燥箱(DHG-9076A,上海一恒科学仪器有限公司);数控超声波清洗器(KQ-300VDB,昆山市超声仪器有限公司);真空干燥箱(DZF-6050,上海秣马恒温设备厂);酸度测定仪(pH 400,Alalis)。
1.3 实验方法
1.3.1 三维石墨烯的制备
采用改进的 Hurnmers方法制备氧化石墨[21],取100 mg氧化石墨于烧杯中,加入50 mL去离子水后超声剥离 2 h,之后取分散液移到高压反应釜中,在180 ℃条件下水热还原16 h后取出,冷冻干燥24 h。
由表12可以看出随着浴比的减小,棉条表观深度K/S值增加,在浴比1:10棉条得色最深,但是染色不匀。这是由于浴比减小,上染率越大,棉条得色越深,但浴比过小,容易染色不匀。所以宜选择浴比1:15,以获得良好的染色深度。
1.3.2 吡咯的聚合
将工作电极的表面依次用直径为0.3 μm和0.05 μm的Al2O3粉末抛光成镜面,再用水冲洗;然后依次在无水乙醇和水中超声清洗 1 min,取出用水洗净,晾干。将吡咯单体(经70 ℃旋转蒸发预处理2 h)配制成为0.1 mol/L的吡咯溶液(含0.1 mol/L的LiClO4);采用循环伏安法(聚合电位:-1.0~1.0 V,扫速:50 mV/s)在10 mL吡咯溶液中电化学聚合不同时间,即可在电极表面得到不同厚度的聚吡咯膜,在室温下晾干,得到聚吡咯膜修饰的电极。
1.3.3 酶电极的制备

图1 聚吡咯酶修饰电极反应过程示意图Fig.1 The schematic diagram of the fabrication of the PPy-modified enzymatic electrode
将三维石墨烯溶液超声 2 h后得到浓度为 1 mg/mL分散液,采用0.1 mol/L NaOH溶液将5 wt%Nafion溶液调节pH至7.0,将甘油激酶和甘油3-磷酸氧化酶分别配制成浓度为30 mg/mL的水溶液,将四种溶液以1:1:1:1体积比混合得到混合溶液,取6.7 μL混合溶液滴于有聚吡咯膜的电极表面,在室温下晾干,得到催化甘油的酶电极。所述酶电极的修饰过程如图1所示。
1.3.4 电化学测试
电化学测试采用经典三电极体系,工作电极为在玻碳电极基底上制备的酶修饰电极,对电极为铂片电极,参比电极为银/氯化银电极。在含有0.2 mol/L KCl的5 mmol/L K3Fe(CN)6溶液中进行不同聚合圈数制备的聚吡咯膜性能测试,采用循环伏安法在0~0.5 V范围内测试。将所得基于催化甘油的酶电极在室温下进行电化学性能测试,均在 10 mL磷酸缓冲溶液(0.2 mol/L、pH 7.0)中进行,测试之前通N2,测试过程中采用循环伏安法,其中空白对照未滴加甘油,测试稳定后滴加100 μL甘油。
2 结果与讨论
2.1 聚吡咯的制备及表征

图2 不同聚合圈数的聚吡咯的SEMFig.2 SEM images of PPy films of different cycles
通过在电极上生长不同数量的吡咯聚合物,制备具有不同膜厚度的电极。采用扫描电子显微镜对所制备的PPy修饰电极的微观结构和形貌进行了研究,其扫描电子显微镜图如图2所示,结果表明,吡咯明显在电极表面聚合,显示出西兰花状结构,并随着聚合圈数从2圈增加到16圈,其膜厚度增加,当聚合圈数为16时其尺寸大于1 μm。
将不同修饰电极(GCE/PPy/PPy-GN-GK-GPO电极)在含有0.2 mol/L KCl的5 mmol/L K3Fe(CN)6溶液中进行循环伏安测试(扫描电位 0~0.5 V,扫描速度50 mV/s),其循环伏安图如图3所示,结果表明,在裸电极和修饰电极上都可以明显观察到Fe2+/Fe3+的一对可逆的氧化还原峰。裸电极的峰值电流(42.97 μA)与酶修饰电极的峰值电流(196.7 μA)相比最低,而PPy修饰电极的峰值电流较高,达到204.5 μA,这可能是由于酶的绝缘蛋白层阻碍了电子转移。同时从图3可知,随着聚吡咯薄膜的增加,电流稳定增加,并且与同时添加酶和石墨烯表现出相似的行为,则聚吡咯膜可能形成用于酶固定的致密结构,并同时作为电子转移的桥梁有助于电子转移。上述结果证实催化甘油的酶电极已成功制备。

图3 不同电极在铁氰化钾溶液中的循环伏安图Fig.3 The CVs of different electrodes in ferricyanide solution
2.2 酶浓度对催化电流的影响
实验研究了不同酶浓度对催化电流的影响,当GK和GPO的浓度为30 mg/mL时,催化电流为49.54 μA,当浓度达到60 mg/mL时,催化电流下降到42.73 μA,说明酶浓度的增加使得酶层变厚,可能降低电极的灵敏度,限制了电极表面介体与电子的传输与转移。
酶电极通过GN和GK/GPO形成稳定的键,因此可以利用复合材料来提高甘油检测的灵敏度和选择性。在进一步研究中,GK和GPO的浓度为30 mg/mL,且GK和GPO的比例固定为1:1。
2.3 主要实验条件的优化

图4 PPy-GN-GK-GPO修饰电极在不同pH 的0.2 mol/L磷酸缓冲溶液中的电流响应(甘油添加量为0.99 mmol/L)Fig.4 Amperometric response of the PPy-GN-GK-GPO modified electrode containing 0.99 mmol/L glycerol in0.2 mol/L PBS of different pHs
pH的变化不仅影响酶的活性,而且可能改变酶修饰电极表面的电荷性质。不同pH对PPy-GN-GK-GPO电极性能的影响(甘油添加量为0.99 mmol/L)如图4所示,催化电流峰值在pH为7.0是最大的,与应用于甘油三酸酯测定的多酶类型生物传感器中的结果一致[22],表明酶在该pH下更具活性,固定化的GK/GPO保持其天然结构并且不变性。同时由图4可知,催化电流在弱酸性溶液(pH 5.0和pH 6.0)中略有下降,而在弱碱性pH(pH 8.0和pH 9.0)下急剧下降,这可能是由于酶从电极表面的失活或浸出引起。在甘油氧化的相关研究中,Mahadevan[12]报道在Tris缓冲液中的最佳pH为10,Pundir[23]报道在0.1 mol/L PBS中的最佳pH为6.5。pH的差异会影响各种聚合物和固定物质的相互作用,同时在酶活性位置的环境中的变化可能导致酶和固定物质之间的不同相互作用。
2.4 修饰电极的电化学性能
通过循环伏安法以不同扫速对 PPy-GN-GK-GPO电极进行了电化学测试,结果如图5所示,其中甘油添加量为1.95 mmol/L。由图5可知,在约-0.6 V至-0.4 V的范围内出现了可逆的氧化还原对,这归结于固定在电极上的聚吡咯的稳定的氧化还原反应。同时,随着扫描速率从50 mV/s增加到300 mV/s,氧化还原电流和电位差都增加,氧化峰/还原峰电位逐渐转移到正/负电位,并且峰电流的数值与扫描速率的平方根成线性相关。这表明该复合修饰电极的氧化还原过程是准可逆的,且该反应过程主要为扩散控制而不是表面电化学过程控制。

图5 (a)PPy-GN-GK-GPO修饰电极在不同扫速下的循环伏安图(甘油添加量为1.95 mmol/L);(b)电流与扫速的平方根之间的线性关系图Fig.5 (a) The CVs of PPy-GN-GK-GPO modified electrode at different scan rates in 0.2 mol/L PBS containing 1.95 mmol/L glycerol; (b) The linear equations between peak current and the square root of scan rate
2.5 修饰电极的电催化性能
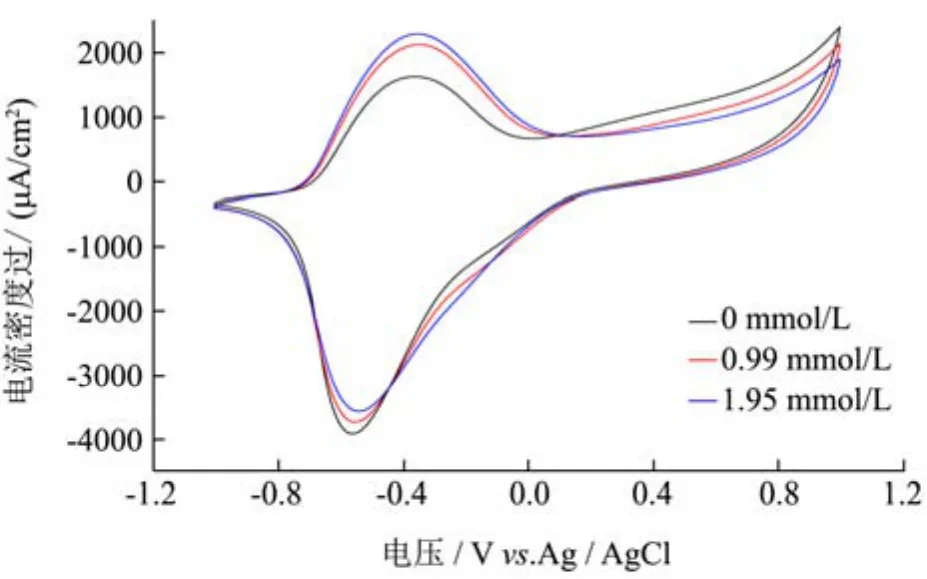
图6 PPy-GN-GK-GPO修饰电极在0.2 mol/L磷酸缓冲溶液中对甘油的电流响应图Fig.6 The CVs of PPy-GN-GK-GPO modified electrode in 0.2 mol/L PBS with/without glycerol
修饰电极在磷酸缓冲溶液中的电催化性能如图 6所示,其中曲线分别为未添加甘油、甘油添加量为0.99 mmol/L、甘油添加量为 1.95 mmol/L。PPy-GNGK-GPO修饰电极显示出准可逆行为,且随着甘油浓度的增加,氧化电流增加,还原电流减低,揭示了PPy-GN-GK-GPO电极对甘油的强响应,说明实现了甘油的催化氧化。且氧化峰催化电流达到46.2 μA,电流密度达到677.6 μA/cm2。根据上述结果,本实验建立了对甘油的高响应系统。
2.6 修饰电极的稳定性
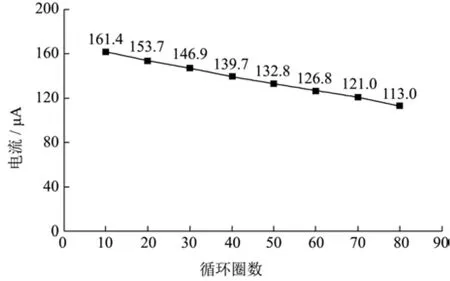
图7 PPy-GN-GK-GPO修饰电极的连续响应测试图Fig.7 Amperometric response of the PPy-GN-GK-GPO modified electrode with continuous tests
将甘油添加量固定为1.95 mmol/L,对制备的酶修饰电极进行连续的响应测试来评估PPy-GN-GK-GPO电极的长期稳定性,实验结果如图7所示。结果表明,在50次循环后,其电流响应为原始反应的82.3%,表明该修饰电极电极表面的催化剂层结构稳定,无明显形态变化,具良好的长期连续稳定性。
3 结论
本论文研究了一种新型的用于甘油催化氧化的酶电极,以甘油激酶和甘油三磷酸氧化酶为催化剂,采用循环伏安法将聚吡咯薄膜固定在电极表面,将Nafion、酶与石墨烯混合并固定于电极表面。所述的基于聚吡咯/石墨烯的甘油酶电极在pH为7.0,浓度为0.2 mol/L的磷酸缓冲溶液对甘油有着较高的电流响应,其催化电流达 46.2 μA,电流密度达 677.6 μA/cm2。
本文结合聚吡咯和石墨烯的独特性质,提高了修饰电极的导电性,并增强了电极表面与分析物之间的电子转移,从而实现了甘油的催化氧化,该修饰电极在电化学催化和生物传感中有极大的应用前景。
[1]Rahmat N, Abdullah A Z, Mohamed A R. Recent progress on innovative and potential technologies for glycerol transformation into fuel additives: A critical review [J].Renewable & Sustainable Energy Reviews, 2010, 14(3):987-1000
[2]Arechederra R L, Treu B L, Minteer S D. Development of glycerol/O2, biofuel cell [J]. Journal of Power Sources, 2007,173(1): 156-161
[3]Maya-Cornejo J, Guerra-Balcázar M, Arjona N, et al.Electrooxidation of crude glycerol as waste from biodiesel in a nanofluidic fuel cell using Cu@Pd/C and Cu@Pt/C [J].Fuel, 2016, 183: 195-205
[4]张梦媛.甘油氧化的催化剂及反应机理研究[D].杭州:浙江大学,2017 ZHANG Meng-yuan. The research of catalysts and the catalytic mechanism for selective oxidation of glycerol [D].Hangzhou: Zhejiang University, 2017
[5]Zhang J H, Zhu T, Liang Y J, et al. CeO2promoted Au/C catalyst for glycerol electro-oxidation in alkaline medium [J].Journal of the Energy Institute, 2016, 89(3): 325-329
[6]Mello G A B, Fernández P S, Martins M E, et al. Glycerol electrooxidation on Platinum-Tin electrodeposited films:inducing changes in surface composition by cyclic voltammetry [J]. Electrocatalysis, 2017, 8(1): 1-10
[7]Yang X, Varma A. Conversion of glycerol to hydrocarbon fuels via bifunctional Catalysts [J]. ACS Energy Letters, 2016,1(5): 963-968
[8]Rubenwolf S, Kerzenmacher S, Zengerle R, et al. Strategies to extend the lifetime of bioelectrochemical enzyme electrodes for biosensing and biofuel cell applications [J].Appl Microbiol Biotechnol, 2011, 89(5): 1315-1322
[9]Arechederra R L, Minteer S D. Complete oxidation of glycerol in an enzymatic biofuel Cell [J]. Fuel Cells, 2010,9(1): 63-69
[10]Arechederra R L, Minteer S D. Kinetic and transport analysis of immobilized oxidoreductases that oxidize glycerol and its oxidation products [J]. Electrochimica Acta, 2010, 55(26):7679-7682
[11]Aquino Neto S, Hickey D P, Milton R D, et al. High current density PQQ-dependent alcohol and aldehyde dehydrogenase bioanodes [J]. Biosensors & Bioelectronics, 2015, 72: 247-254
[12]Mahadevan A, Fernando S. An improved glycerol biosensor with an Au-FeS-NAD-glycerol-dehydrogenase anode [J].Biosensors & Bioelectronics, 2017, 92: 417-424
[13]Rocha-Martin J, Acosta A, Berenguer J, et al. Selective oxidation of glycerol to 1,3-dihydroxyacetone by covalently immobilized glycerol dehydrogenases with higher stability and lower product inhibition [J]. Bioresource Technology,2014, 170(5): 445-453
[14]Zhang J, Cui Z, Chang H, et al. Conversion of glycerol to 1,3-dihydroxyacetone by glycerol dehydrogenase co-expressed with an NADH oxidase for cofactor regeneration [J]. Biotechnology Letters, 2016, 38(9): 1-6
[15]Pêgas M M, Amado R S, Castro E V D, et al. Analysis of free glycerol in biodiesel using an electrochemical assay based on a two-enzyme platinum microelectrode system [J]. Journal of Applied Electrochemistry, 2010, 40(11): 2061-2063
[16]Neto S A, Milton R D, Hickey D P, et al. Membraneless enzymatic ethanol/O2, fuel cell: Transitioning from an air-breathing Pt-based cathode to a bilirubin oxidase-based biocathode [J]. Journal of Power Sources, 2016, 324: 208-214
[17]Huang Y, Li H, Wang Z, et al. Nanostructured Polypyrrole as a flexible electrode material of supercapacitor [J]. Nano Energy, 2016, 22: 422-438
[18]Li Y, Jiao M, Yang M. In-situ grown nanostructured ZnO via a green approach and gas sensing properties of polypyrrole/ZnO nanohybrids [J]. Sensors & Actuators B Chemical, 2017, 238: 596-604
[19]Srivastava V, Maydannik P, Sillanpää M. Synthesis and characterization of PPy@NiO nano-particles and their use as adsorbent for the removal of Sr(II) from aqueous solutions [J].Journal of Molecular Liquids, 2016, 223: 395-406
[20]Zhang S, Shao Y, Liu J, et al. Graphene-polypyrrole nanocomposite as a highly efficient and low cost electrically switched ion exchanger for removing ClO from wastewater[J]. Acs Applied Materials & Interfaces, 2011, 3(9): 3633
[21]董长城,张力,陈东霞,等.基于三维石墨烯的甘油酶生物燃料电池的构建及其性能研究[J].现代食品科技,2017,33(6):173-177 DONG Chang-cheng, ZHANG Li, CHEN Dong-xia, et al.Preparation and properties of glycerol enzymatic biofuel cells based on three-dimensional graphene [J]. Modern Food Science and Technology, 2017, 33(6): 173-177
[22]Yücel A, Ozcan H M, Sağıroğlu A. A new multi enzyme type biosensor for triglyceride determination [J]. Prep Biochem Biotechnol, 2016, 46(1): 78-84
[23]Pundir C S, Aggarwal V. Amperometric triglyceride bionanosensor based on nanoparticles of lipase, glycerol kinase, glycerol-3-phosphate oxidase [J]. Analytical Biochemistry, 2017, 517: 56-63

