口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫增强牛呼吸道黏膜免疫应答
李乙江,朱明旺,普仕华,郭云然,杨永幸,李世钰,创向辉,杨 倩
(1. 南京农业大学动物医学院,南京 210095; 2. 云南德宏州动物疫病预防控制中心,德宏 678400;3. 云南省兽医生物制品研制中心,保山 678000; 4. 云南德宏风平镇农业综合服务中心,德宏 678400;5. 云南陇川县动物疫病预防控制中心,德宏 678700; 6. 云南大学农学院,昆明 650500)
口蹄疫(foot-and-mouth disease, FMD)是由口蹄疫病毒(foot-and-mouth disease virus, FMDV)感染偶蹄动物引起的急性、热性、高度接触性传染病[1]。口蹄疫已给我国乃至全世界养殖业造成巨大的经济损失。FMDV主要通过呼吸道传播[2-3]。目前,我国预防FMD以皮下或肌肉注射口蹄疫灭活疫苗为主,但这种传统的免疫方式只能诱导机体产生系统免疫,对FMDV的入侵部位(黏膜)不产生免疫保护作用。FMDV主要通过气溶胶的形式经呼吸道和消化道等黏膜途径感染动物。如果切断FMDV进入动物体内的途径,这将能更有效地预防FMDV的感染和传播。
呼吸道黏膜下分布有较多的淋巴组织[4]。本实验室发现黄牛呼吸道分布有IgA分泌细胞,其中鼻腔黏膜中IgA分泌细胞数量最多,IgA在抵抗病毒的入侵中发挥重要的作用[5]。IgA分泌细胞的数量可代表鼻腔局部黏膜免疫力的水平。鼻腔免疫可诱导鼻腔黏膜产生较多的IgA分泌细胞以及其他重要的免疫活性细胞。此外,鼻腔免疫具有抗原诱导免疫反应阈值低、抗原用量少、不引起免疫耐受等诸多优点,在其他小动物上已获得很好的免疫效果[6-8]。然而作为我国一类动物疫病的FMD只能应用灭活病毒进行免疫接种,灭活病毒不能诱导鼻腔黏膜免疫。
最近研究发现枯草芽胞杆菌(Bacillussubtilis, B.s)是一种良好的免疫增强剂[9]。其有效成分表面活性素(surfactin)具有更好的免疫效果[10]。枯草芽胞杆菌主要通过诱导黏膜下树突状细胞(dendritic cells, DC)成熟,释放细胞因子,诱导免疫应答[11-12]。因而,本研究应用一株高表达表面活性素的枯草芽胞杆菌(B.subtilisOKB105)配合O型口蹄疫灭活病毒喷鼻气雾免疫牛,检测其牛呼吸道局部IgA分泌细胞的数量、鼻液、唾液中口蹄疫特异性SIgA水平、细胞因子IL-12和TNF-α水平以及血清中O型口蹄疫病毒特异性抗体的变化,探讨该方法对牛呼吸道黏膜免疫应答和系统免疫应答的影响。为口蹄疫全灭活病毒鼻腔免疫提供理论基础和应用前景。
1 材料与方法
1.1 实验动物
通过临床检查与实验室常规检查相结合,运用ELISA方法筛选出25头O型口蹄疫抗体阴性7岁健康婆罗门牛(由云南德宏州盈瑞肉牛养殖有限公司及芒市天龙街屠宰场提供)。
1.2 试验材料
灭活的牛O型口蹄疫病毒(OS/99株)(由中国农业科学院兰州兽医研究所提供),高表达表面活性素的枯草芽胞杆菌(B.subtilisOKB105)(本实验室保存)。口蹄疫O型灭活油乳苗(购于云南保山疫苗厂,批号:201503001)。兔抗牛IgA(购于Abcam公司,批号:ab112755),SABC试剂盒(购自南京生兴生物技术有限公司,批号:10K10A),山羊血清(实验室自制),Triton[购自生工生物工程(上海)股份有限公司],切片石蜡(购自国药集团化学试剂有限公司),RIPA裂解液(购于天根生物技术有限公司,货号:20160317),口蹄疫病毒O型抗体ELISA检测试剂盒(韩国金诺,购于云南省牧康动物防疫技术有限公司,批号:107H5436),牛O型口蹄疫病毒抗体SIgA ELISA试剂盒(购于上海劲马生物科技有限公司,批号:201508),牛IL-6、IL-12 ELISA试剂盒(购于上海劲马生物科技有限公司,批号:201508)、牛TNF-α ELISA试剂盒(购于上海劲马生物科技有限公司,批号:201508)。压电式雾化器(购于捷锐企业有限公司,型号:GUN-200型),球磨震动仪(购于天隆科技有限公司,型号:GT200)。
1.3 灭活的牛O型口蹄疫病毒准备
1.4 动物分组与处理
设O型口蹄疫灭活病毒配合免疫增强剂试验组、免疫增强剂对照组、O型口蹄疫灭活病毒对照组、常规疫苗对照组、空白对照组5个试验组。将1×107O型口蹄疫灭活病毒与B.subtilisOKB105菌液按1∶1体积比例直接混合使用,使用剂量为10 mL·头-1,通过呼吸道黏膜气雾喷鼻免疫给药(气雾仪所设定的气雾颗粒直径≤2 μm),每隔3 d喷鼻1次,连续2次。常规疫苗组按疫苗使用说明书使用,即肌肉注射1次,3 mL·头-1。口蹄疫灭活病毒对照组与免疫增强剂对照组,免疫程序方法与试验组一样,其中口蹄疫灭活病毒含量为1×107,5 mL·头-1,免疫增强剂枯草芽胞杆菌含量为5 mL·头-1。空白对照组未做任何处理。
1.5 样品采集与处理
为了观察抗体随时间变化的趋势,分别在免疫后第3、7、14、21、28、35天清晨牛进食前,使用一次性注射器分别吸取牛鼻液和唾液,保存于-20 ℃,通过ELISA方法检测口蹄疫特异性SIgA,同时使用真空管采血器从牛的颈静脉采集血样,分离血清,保存于-20 ℃。
结合屠宰场条件于免疫3个月后屠宰实验用牛,颈部放血处死后,将头部分解出来,用电锯锯开牛鼻部横断面,取鼻腔黏膜;剖开腹腔取气管(距离会厌部10 cm)、肺内支气管(右肺尖段支气管2 cm处部位)、肺(含有细支气管)。用于免疫组化的样品取后立即置于4%多聚甲醛液中固定48 h,而后常规制备石蜡切片(8 μm);用于ELISA检测组织中细胞因子的样品,取后立即置于液氮中。
1.6 免疫组织化学方法显示IgA分泌细胞
石蜡切片(8 μm)常规脱蜡至水,PBS(pH7.6)洗涤10 min;0.8%H2O2处理30 min,0.4%Triton-PBS(pH 7.4) 洗涤3次,5 min·次-1;10%山羊血清室温封闭20 min, 弃山羊血清后直接加1∶100稀释的兔抗牛IgA,4 ℃过夜; 洗涤同上,加入适当稀释的 SABC(1∶100)37 ℃孵育60 min; 弃SPA-HRP后入PBS(pH 7.6)中洗涤1次,Tris-HCl 缓冲液(0.05 mol·mL-1,pH 7.4)洗涤3次,5 min·次-1;适量的DAB-H2O2显色,晾干,透明,封固。阴性对照组用PBS 代替兔抗牛IgA,此后步骤同上。
用Olympus BH-2 显微镜观察组织切片并拍照。每个组织样品随机取5张切片,每张切片随机选10个视野,利用图像分析系统测量单位视野内IgA分泌细胞的数量。
1.7 ELISA检测鼻液和唾液中口蹄疫特异性SIgA
将鼻液和唾液样品取出融化,加于牛O型口蹄疫病毒抗体SIgA ELISA试剂盒提供的抗原包被板中,50 μL·孔-1,同时分别设置空白孔(空白对照空不加样品及酶标试剂,其余各步骤相同)、标准孔。在酶标包被板上标准品准确加样50 μL·孔-1,待测样品孔加样50 μL·孔-1。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后置37 ℃温育30 min。小心揭掉封板膜,弃去液体,拍干,每孔加满洗液,静置30 s后弃去,如此重复5次,拍干。每孔加入酶标试剂50 μL,空白孔除外。温育、洗涤同前。每孔加入显示剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色10 min。每孔加终止液50 μL,终止反应(此时蓝色立即转黄色)。以空白孔调零,在加终止液后15 min以内在450 nm波长下依序测量各孔的OD值。
1.8 ELISA检测血清中O型口蹄疫病毒抗体
将血清取出待融化后进行ELISA操作,待检样品孔、阴性对照孔、阳性对照孔加入样品稀释液80 μL,然后再加入样品、阴性对照、阳性对照各20 μL,轻轻晃动混匀,室温孵育60 min;洗板,弃洗液,拍干,如此重复3次;每孔加入100 μL酶标抗体,室温孵育60 min;洗板,弃洗液,拍干,如此重复3次;每孔加入100 μL TMB底物,室温暗处放置15 min;每孔加终止液50 μL,终止反应(此时蓝色立即转黄色)。以空白孔调零,在加终止液后15 min以内在450 nm波长下依序测量各孔的OD值。
2013年,陕西水利工作深入贯彻落实党的十八大精神和科学发展观,围绕服务“三个陕西”建设,遵循群众意愿,以江河之治为核心、以水资源管理为根本、以体制机制建设为保障,优化部署水资源配置重点工程,奋力实施项目带动战略,统筹推进各项工作扎实有效开展,年度完成水利投资224亿元,较上年增长19%。
1.9 ELISA方法检测组织中细胞因子
将鼻黏膜、气管、肺、肺内支气管组织样品从液氮中取出,用电子天平各称取2 mg,置于5 mL离心管中,加入500 μL生理盐水和200 μL组织蛋白裂解液,置于球磨震动仪中批量研磨样品后,室温放置10 min,10 000 r·min-1离心10 min,取上清,用ELISA检测组织中的IL-6、IL-12、TNF-α,其操作步骤同“1.7”中操作。
1.10 统计分析
的影响均用单因素方差分析,P<0.01表示差异极显著,P<0.05表示差异显著。
2 结 果
2.1 鼻黏膜中IgA分泌细胞的变化
通过对牛鼻黏膜的IgA免疫组化染色,在牛鼻黏膜中IgA分泌细胞呈棕色圆形或椭圆形,细胞膜和细胞质为阳性反应,细胞核为阴性反应。口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫后IgA分泌细胞数量明显增多,尤其在鼻黏膜基底膜下方较为明显(图1)。单独使用口蹄疫灭活病毒、单独使用枯草芽胞杆菌、单独使用常规口蹄疫灭活苗和空白对照组,均未观察到牛鼻腔黏膜中IgA分泌细胞明显增多。经统计学分析,单位视野中,口蹄疫灭活病毒喷鼻免疫后IgA分泌细胞数量呈极显著增加(P<0.01);其他对照组之间无明显差异(P>0.05)(图2)。
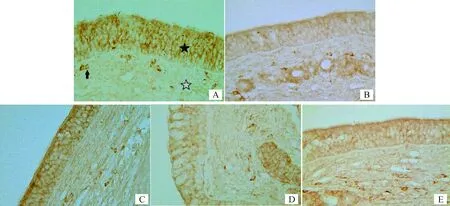
A.口蹄疫灭活病毒配合枯草芽胞杆菌组;B.常规疫苗组;C.枯草芽胞杆菌组;D.灭活病毒组;E.空白对照组;★.黏膜上皮;☆.固有层;.IgA分泌细胞A. Intranasal immunized with inactivated FMDV along with Bacillus subtilis; B. Vaccine control group; C. Bacillus subtilis control group; D. Inactivated virus control group; E. Negative control group; ★.Mucosal epithelium; ☆.Lamina propria; .IgA secreting cells图1 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛鼻黏膜中IgA分泌细胞的影响(400×)Fig.1 Effect of the intranasal immunized with inactivated FMDV along with Bacillus subtilis on IgA secreting cells in cattle nasal mucosa(400×)
2.2 肺内支气管中IgA分泌细胞的变化
通过对牛肺内支气管IgA免疫组化染色,从图3中可见,牛肺内支气管黏膜IgA分泌细胞呈棕色圆形或椭圆形,细胞膜和细胞质为阳性反应,细胞核为阴性反应。口蹄疫灭活病毒与枯草芽胞杆菌联合使用气雾喷鼻免疫牛后,肺内支气管黏膜中IgA分泌细胞数量明显增多,尤其在肺内支气管黏膜基底层下
方较为明显,并且在黏膜上皮中存在明显的IgA分泌细胞(图3),可清晰地看到IgA分泌到黏膜表面的生理过程。单独使用口蹄疫灭活病毒、单独使用枯草芽胞杆菌、单独使用常规口蹄疫灭活苗和空白对照组,均未观察到牛肺内支气管黏膜中IgA分泌细胞明显增多。经统计学分析,单位视野中,口蹄疫灭活病毒与枯草芽胞杆菌联合使用气雾喷鼻免疫后IgA分泌细胞在肺内支气管黏膜中分布数量极显著高于其他试验对照组(P<0.01);试验对照组之间无明显差异(P>0.05) (图4)。

不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图2 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后牛鼻黏膜中IgA分泌细胞数量的变化Fig.2 Changes of IgA secreting cells in cattle nasal mucosa after the intranasal immunized with inactivated FMDV along with Bacillus subtilis
2.3 鼻液和唾液中O型口蹄疫病毒抗体SIgA的变化
免疫后第3、7、14、21、28、35天采集牛鼻液和唾液,经牛O型口蹄疫病毒特异性SIgAELISA检测及统计学分析,结果显示口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫免疫牛后,在第3天分别于鼻液和唾液中检测到特异性SIgA,且维持直至试验结束。其中,口蹄疫灭活病毒与枯草芽胞杆菌配合免疫后,在第3、7、14天检测到牛鼻液中特异性SIgA与空白对照组和单独使用常规疫苗组呈差异极显著(P<0.01);在第21天与空白对照组和单独使用常规疫苗组呈差异显著(P<0.05);在第28、35天与空白对照组和单独使用常规疫苗组呈差异极显著(P<0.01),试验对照组之间无明显差异(P>0.05)。口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫后,在第3、7、21天牛唾液中检测到的特异性SIgA与空白对照组呈差异极显著(P<0.01);在第14、35天与空白对照组呈差异显著(P<0.05),其余对照组之间差异趋势不明显(图5、6)。
A.口蹄疫灭活病毒配合枯草芽胞杆菌组;B.常规疫苗组;C.枯草芽胞杆菌组;D.灭活病毒组;E.空白对照组;★.黏膜上皮;☆.固有层;.IgA分泌细胞A. Intranasal immunized with inactivated FMDV along with Bacillus subtilis; B. Vaccine control group; C. Bacillus subtilis control group; D. Inactivated virus control group; E. Negative control group; ★.Mucosal epithelium; ☆.Lamina propria; .IgA secreting cells图3 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛肺内支气管黏膜中IgA分泌细胞的影响(400×)Fig.3 Effect of the intranasal immunized with inactivated FMDV combine with Bacillus subtilison on IgA secreting cells in cattle pulmonary bronchial mucosa(400×)
2.4 血清中O型口蹄疫总抗体的变化
经ELISA检测血清中牛O型口蹄疫病毒特异性抗体(图7)与空白对照组、灭活病毒组、单独使用枯草芽胞杆菌组相比,口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫后第3天检测到特异性抗体,且在整个试验过程中呈差异极显著(P<0.01),依据试剂盒说明书常规疫苗组在免疫第14天后产生较好抗体。口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫牛所产生的特异性抗体水平较常规疫苗组高,且在免疫3个月后抗体水平回落较常规疫苗组慢。其余对照组间差异趋势不明显(P>0.05)。

不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图4 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后牛肺内支气管黏膜中IgA分泌细胞数量的变化Fig.4 Changes of IgA secreting cells in cattle pulmonary bronchial mucosa after the intranasal immunized with inactivated FMDV along with Bacillus subtilis
2.5 呼吸道组织中IL-6、IL-12和TNF-α的变化
结合屠宰场实际条件,在免疫3个月后屠宰牛,分别采集了这些牛的鼻黏膜、气管、肺、肺内支气管,运用ELISA检测其IL-6、IL-12和TNF-α的水平。结果显示(图8~10),口蹄疫灭活病毒配合枯草芽胞杆菌免疫后,鼻、气管、肺、肺内支气管中IL-6无明显差异(P>0.05);IL-12和TNF-α呈差异极显著表达(P<0.01),在单独使用枯草芽胞杆菌组中也呈差异显著表达(P<0.01或P<0.05);而单独使用疫苗组中与其余对照组一样,IL-12表达无明显差异(P>0.05),但在鼻和气管中TNF-α呈差异极显著(P<0.01)。
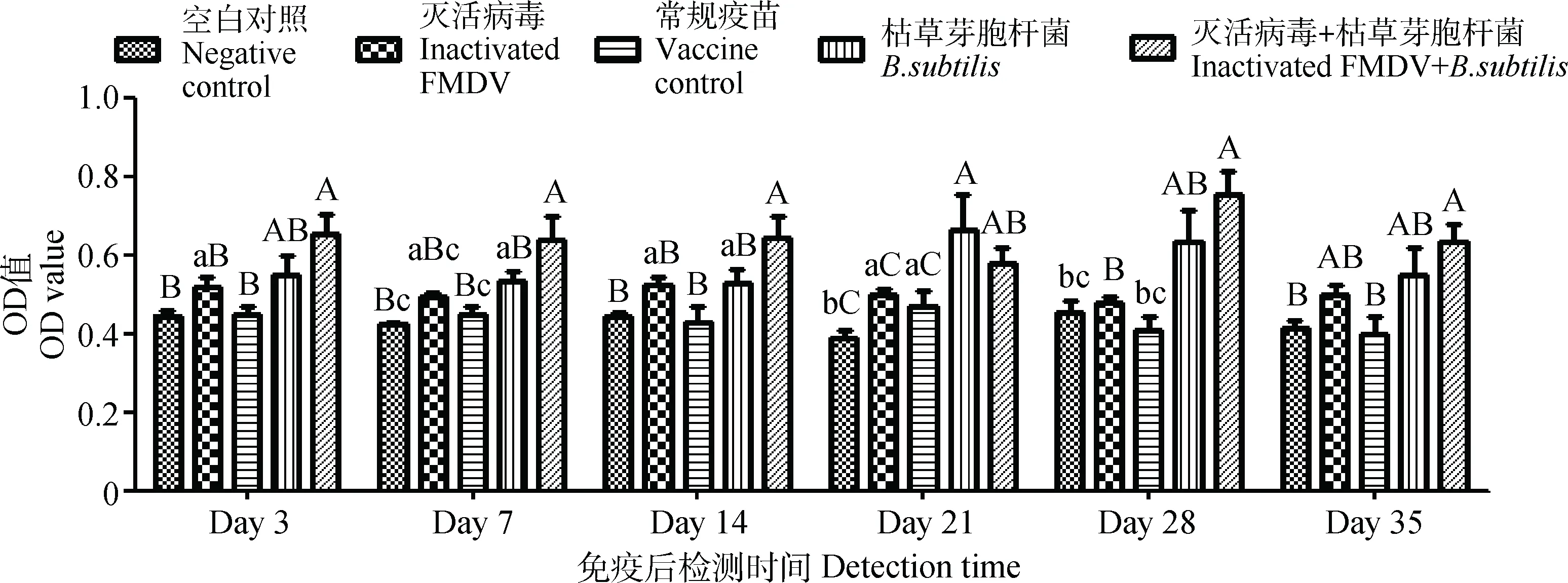
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图5 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛鼻液O型口蹄疫病毒特异性SIgA的变化Fig.5 Changes of O type FMDV specific SIgA in nasal discharge from cattle after the intranasal immunized with inactivated FMDV along with Bacillus subtilis
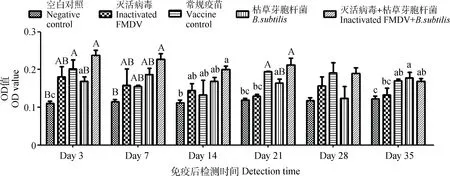
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图6 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后牛唾液中O型口蹄疫病毒特异性SIgA的变化Fig.6 Changes of O type FMDV specific SIgA in saliva from cattle after the intranasal immunized with inactivated FMDV along with Bacillus subtilis
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图7 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后牛血清中O型口蹄疫病毒特异性抗体的变化Fig.7 Changes of O type FMDV specific antibodies in serum from cattle after the intranasal immunized with inactivated FMDV along with Bacillus subtilis
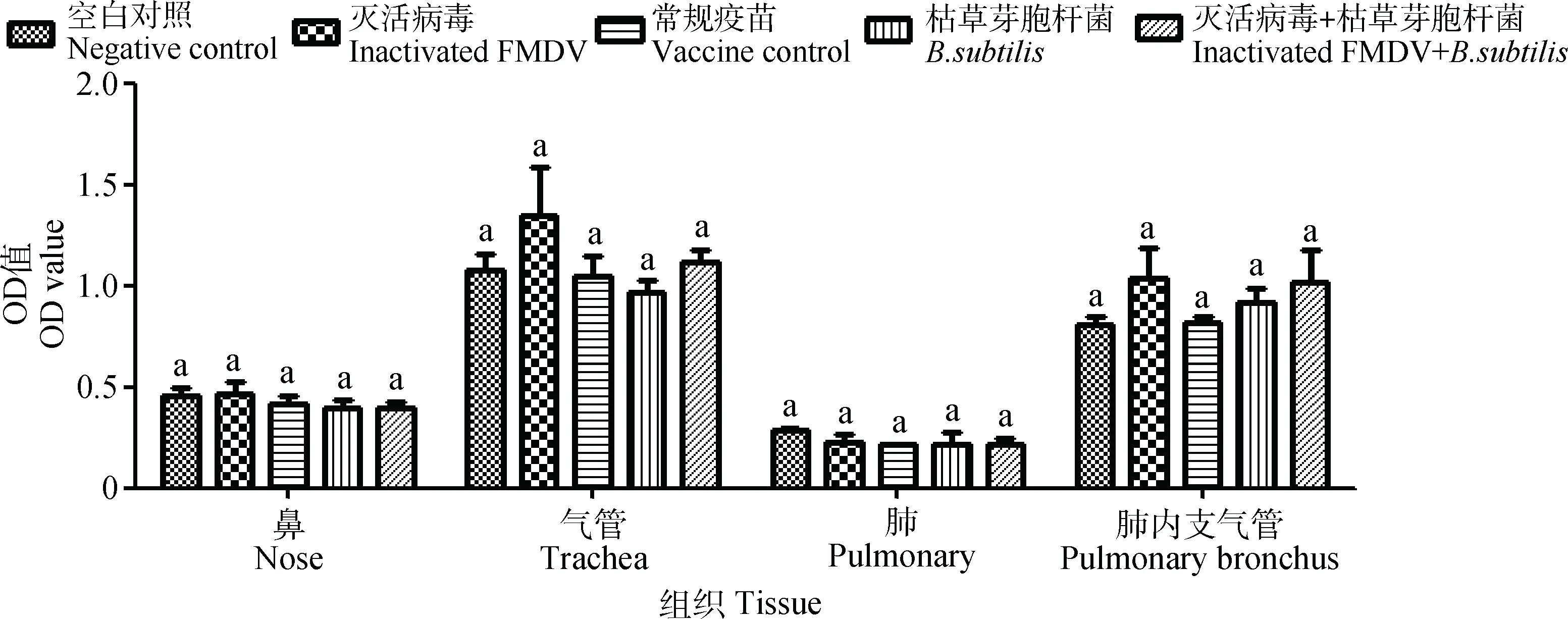
相同小写字母表示差异不显著(P>0.05)The same letters show no significant difference (P>0.05)图8 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛呼吸道组织中IL-6表达的影响Fig.8 Effect of the intranasal immunized with inactivated FMDV along with Bacillus subtilis on expression of IL-6 in cattle respiratory tissues
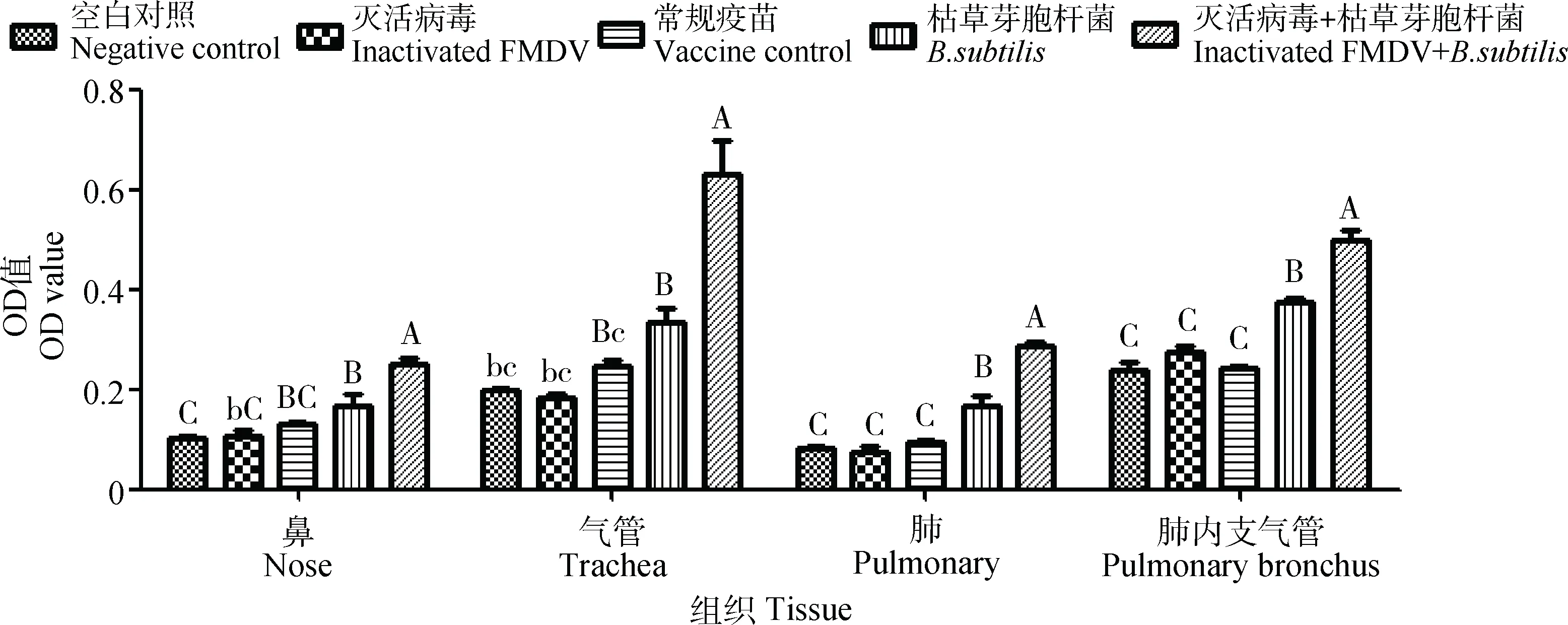
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图9 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛呼吸道组织中IL-12表达的影响Fig.9 Effect of the intranasal immunized with inactivated FMDV along with Bacillus subtilis on expression of IL-12 in cattle respiratory tissues
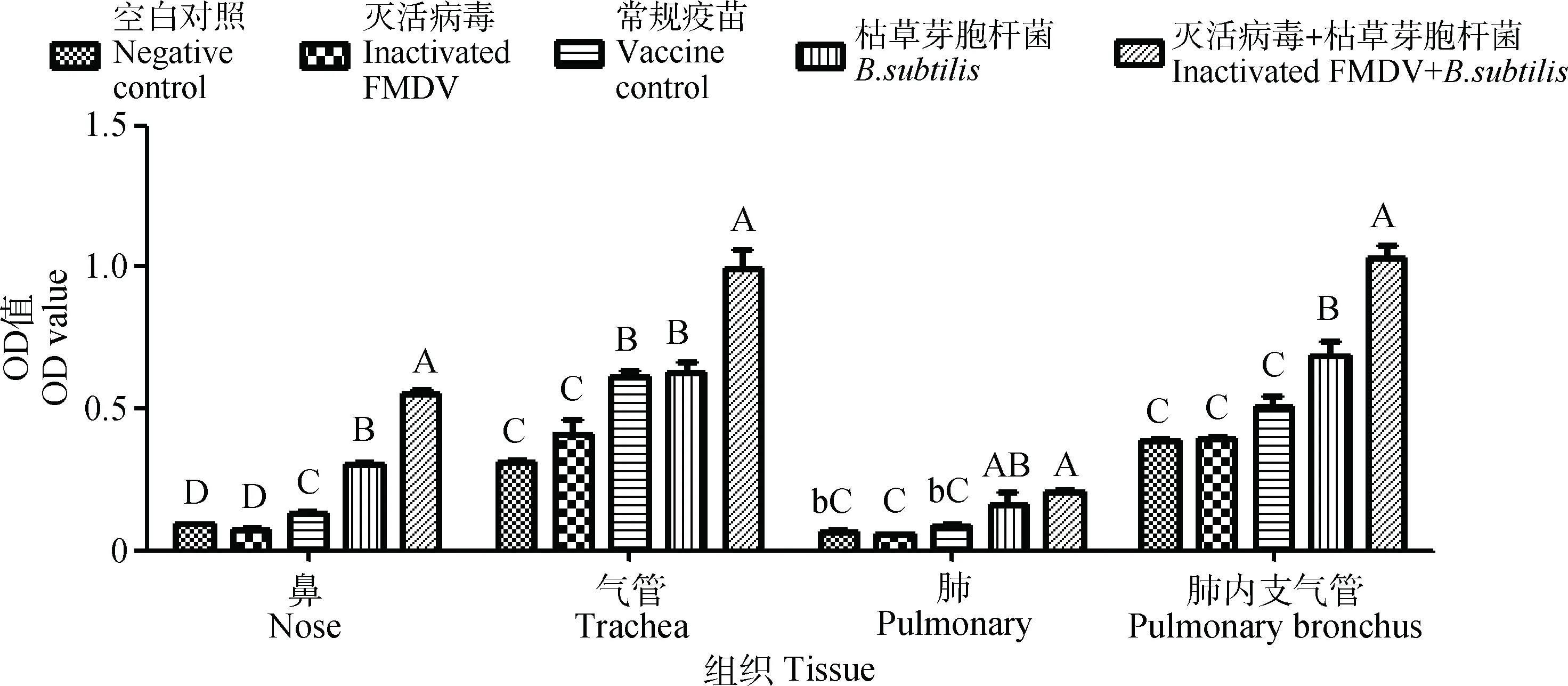
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05)Different superscript lowercase and capital letters respectively show significant difference (P<0.05) and extremely significant difference (P<0.01), the same letters show no significant difference (P>0.05)图10 口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后对牛呼吸道组织中TNF-α表达的影响Fig.10 Effect of the intranasal immunized with inactivated FMDV along with Bacillus subtilis on expression of TNF-α in cattle respiratory tissues
3 讨 论
由于口蹄疫是我国的A类动物疫病,目前预防口蹄疫主要用灭活病毒疫苗。而单独应用灭活病毒通过鼻腔免疫不能有效的刺激局部黏膜产生免疫应答。有研究表明灭活病毒与免疫增强剂配合经鼻腔免疫则会诱导有效的呼吸道免疫应答[13-15]。
口蹄疫病毒最初是通过呼吸道或消化道黏膜进入机体。如果在局部黏膜建立免疫屏障,则能在感染初期阻止病毒的进入减少病毒的定植和扩散。SIgA是黏膜免疫的主要效应因子,具有防止病毒黏附和入侵等重要功能。黏膜固有层中IgA分泌细胞先合成IgA,在通过黏膜上皮的过程中与上皮细胞合成的分泌片段形成SIgA,后者在黏膜表面形成一层保护层,构成防御病原微生物入侵机体极其重要的屏障[14]。呼吸道黏膜下分布较多IgA分泌细胞,可及时补充黏膜表面的SIgA。牛IgA应答在防御不同传染性病原体中发挥重要作用[16]。IgA分泌细胞分泌的SIgA在黏膜表面可阻断病原体入侵,并能中和进入黏膜中的病毒,是预防病毒感染的一个重要标志[16-17]。本研究发现应用O型口蹄疫灭活病毒配合枯草芽胞杆菌鼻腔免疫后能明显增加牛呼吸道IgA分泌细胞数量和鼻液中口蹄疫特异性SIgA水平,同时发现全身血清中O型口蹄疫病毒特异性抗体水平也显著增加,这就为口蹄疫灭活病毒鼻腔免疫奠定了理论基础。
本研究运用O型口蹄疫灭活病毒配合枯草芽胞杆菌喷鼻气雾免疫牛后,鼻黏膜、肺内支气管黏膜下IgA分泌细胞明显增多,同时鼻液和唾液中O型口蹄疫SIgA抗体也增加。由于鼻后孔与口腔相通,喷鼻过程中一部分抗原和枯草芽胞杆菌进入口腔后部,刺激周围扁桃体中IgA分泌细胞的形成和分泌,所以唾液中SIgA也随之增加。同时,在免疫后早期口蹄疫病毒特异性抗体出现在血清中,中和抗体在清除体内病毒中起重要作用[11]。表明口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫不仅可刺激局部呼吸道体液免疫,还能诱导牛的全身体液免疫应答。
口蹄疫灭活病毒免疫原性较差,很多学者应用多种方法试图提高口蹄疫的免疫效率。2008年C. Cubillos等[18]运用新型树枝聚合肽联合口蹄疫病毒T细胞表位、B细胞表位表达产物肌肉注射猪,增强黏膜IgA应答和抵抗口蹄疫病毒。2013年D. M. Alejo等[19]运用缺陷型腺病毒载体编码大肠杆菌热稳定性外毒素经鼻腔免疫小鼠,可提高口蹄疫病毒亚单位疫苗局部黏膜免疫力。2014年C. Çokçalkan等[20]应用壳聚糖配合口蹄疫灭活病毒经鼻腔免疫豚鼠,可促进全身和局部黏膜的免疫应答。2016年Y. L. Xie等[21]将表达O型口蹄疫病毒P12A和3C蛋白重组慢病毒经鼻腔、口腔免疫可刺激小鼠产生局部黏膜和全身免疫应答。尽管上述研究均能产生较好黏膜免疫应答,但仍然存在一些问题,如大肠杆菌热稳定性外毒素具有一定的毒副作用;慢病毒载体存在病毒毒力返祖的风险;壳聚糖和新型树枝肽价格昂贵,不合适用于大动物。
有研究表明枯草芽胞杆菌能提高机体免疫力[11-12,19]。本研究中所用的高表达表面活性素的枯草芽胞杆菌,能被黏膜下DC通过上皮细胞间伸出树突摄取,诱导DC成熟且释放TNF-α等细胞因子,诱导抗感染的非特异性免疫应答,增加抗体产生,调节Th1和Th2平衡[10];另外,表面活性素也能诱导DC的成熟,使其高表达MHCⅡ类分子和共刺激分子CD40,产生IL-6和TNF-α细胞因子,增强体液和细胞免疫应答[12]。P. Zanvit等[22]应用坚硬芽胞杆菌配合H1N1灭活流感病毒鼻腔免疫小鼠可诱导局部细胞免疫应答反应。牟春晓(C.X.Mou)等[11]用重组构建表达猪传染性胃肠炎spike蛋白的枯草芽胞杆菌免疫猪,结果发现能募集DC迁移至肠系膜淋巴结诱导免疫应答。
细胞免疫在抵抗口蹄疫病毒感染清除病毒中也起重要作用。本研究结果显示,鼻腔免疫后牛鼻、气管、肺、肺内支气管中IL-12、TNF-α水平均显著增加。与牟春晓(C.X.Mou)等[11]、徐文雯(W.W.Xu)等[12]报道的枯草芽胞杆菌和表面活性素能促进细胞因子分泌的免疫机制结果相一致。IL-12是Th1细胞活化所必需的细胞因子,在发挥抗病原微生物感染的适应性保护免疫中起重要作[23-25]。I. V. Lyadova等[26]用卡介苗鼻腔免疫小鼠5周后,肺部总T淋巴细胞数和CD4+T细胞数显著增加,且产生IL-5、IL-12、IFN-γ的T淋巴细胞数也明显增加,我们在本试验中观察到呼吸道中IL-12水平显著增加与之相一致。B. Clapp等[27]用布氏杆菌突变株ΔznuAB鼻腔接种免疫小鼠4周后,发现活化的效应记忆T细胞能够产生高水平的TNF-α、IFN-γ、穿孔素等抗病原微生物有效成分,提高机体对抵抗布氏杆菌的免疫保护作用。在本试验中我们也检测到了较高水平的TNF-α,可推测口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫牛后,机体也产生了效应记忆T细胞,进而保持持久的免疫效果,表明TNF-α在抗病毒中发挥重要作用。IL-6是在免疫早期产生的可促进B细胞活化增殖分化为浆细胞,增加免疫球蛋白合成与分泌的细胞因子[28]。因本试验于免疫3个月后屠宰牛,未能检测到IL-6的变化。上述结果表明口蹄疫灭活病毒配合枯草芽胞杆菌气雾喷鼻免疫可刺激牛呼吸道局部细胞免疫应答,这在阻断口蹄疫病毒向深部组织扩散时起重要防御作用。
4 结 论
应用O型口蹄疫灭活病毒配合枯草芽胞杆菌喷鼻气雾免疫牛后能明显增加呼吸道IgA分泌细胞数量和鼻液中口蹄疫特异性SIgA水平,鼻、气管、肺和肺内支气管中IL-12、TNF-α水平均显著增加,同时血清中O型口蹄疫病毒特异性抗体水平也显著增加,可见能提高呼吸道局部体液和细胞免疫,同时还可诱导全身系统免疫应答,有利于抵抗口蹄疫病毒。
[1] FERNANDEZ-SAINZ I, MEDINA G N, RAMIREZ-MEDINA E, et al. Adenovirus-vectored foot-and-mouth disease vaccine confers early and full protection against FMDV O1 Manisa in swine[J].Virology, 2017, 502: 123-132.
[2] ARZT J, JULEFF N, ZHANG Z, et al. The pathogenesis of foot-and-mouth disease I: viral pathways in cattle[J].TransboundEmergDis, 2011, 58(4): 291-304.
[3] STENFELDT C, SEGUNDO F D S, SANTOS T, et al. The pathogenesis of foot-and-mouth disease in pigs[J].FrontVetSci, 2016, 3: 41.
[4] 李正平. 山羊呼吸道相关淋巴组织及鼻腔吸收灭活病毒的形态学研究[D]. 南京: 南京农业大学, 2011: 35-41. LI Z P. Morphology of the respiratory tract associated lymphoid tissue and nasal absorption of inactivated virus in goat[D]. Nanjing: Nanjing Agricultural University, 2011: 35-41. (in Chinese)
[5] 李乙江, 杨晶晶, 牛自兵, 等. 黄牛呼吸道IgA分泌细胞和淋巴组织分布的研究[J]. 南京农业大学学报, 2017, 40(6): 1100-1104. LI Y J, YANG J J, NIU Z B, et al. Distribution of IgA secreting cells and lymphoid tissues in cattle respiratory tract[J].JournalofNanjingAgriculturalUniversity, 2017, 40(6): 1100-1104. (in Chinese)
[6] 杨 倩. 黏膜免疫及其疫苗设计[M]. 北京: 科学出版社, 2016: 24-289. YANG Q. Mucosal immunization and vaccine strategies[M]. Beijing: Science Press, 2016: 24-289. (in Chinese)
[7] 申育萌, 杨 倩. 枯草芽胞杆菌芽孢对猪扁桃体内树突状细胞的影响[J]. 畜牧兽医学报, 2015, 64(5): 849-854. SHEN Y M, YANG Q. Effects of intranasal administration withBacillussubtilisspores on the dendritic cells in porcine tonsils[J].ActaVeterinariaetZootechnicaSinica, 2015, 64(5): 849-854. (in Chinese)
[8] CHALLA S, SZCZEPANEK S M, ROOD D, et al. Bacterial toxin fusion proteins elicit mucosal immunity against a foot-and-mouth disease virus antigen when administered intranasally to guinea pigs[J].AdvVirol, 2011, 2011: 713769.
[9] AMUGUNI H, TZIPORI S. Bacillus subtilis: a temperature resistant and needle free delivery system of immunogens[J].HumVaccinImmunother, 2012, 8(7): 979-986.
[10] MNIF I, GHRIBI D. Review lipopeptides biosurfactants: mean classes and new insights for industrial, biomedical, and environmental applications[J].Biopolymers, 2015, 104(3): 129-147.
[11] MOU C X, ZHU L Q, XING X P, et al. Immune responses induced by recombinantBacillussubtilisexpressing the spike protein of transmissible gastroenteritis virus in pigs[J].AntiviralRes, 2016, 131: 74-84.
[12] XU W W, LIU H F, WANG X Q, et al. Surfactin induces maturation of dendritic cellsinvitro[J].BiosciRep, 2016, 36(5): e00387.
[13] TAKADA A, MATSUSHITA S, NINOMIYA A, et al. Intranasal immunization with formalin-inactivated virus vaccine induces a broad spectrum of heterosubtypic immunity against influenza A virus infection in mice[J].Vaccine, 2003, 21(23): 3212-3218.
[14] GEERAEDTS F, BUNGENER L, POOL J, et al. Whole inactivated virus influenza vaccine is superior to subunit vaccine in inducing immune responses and secretion of proinflammatory cytokines by DCs[J].InfluenzaOtherRespirViruses, 2008, 2(2): 41-51.
[15] RENEGAR K B, SMALL P A Jr, BOYKINS L G, et al. Role of IgA versus IgG in the control of influenza viral infection in the murine respiratory tract[J].JImmunol, 2004, 173(3): 1978-1986.
[16] MUTO K, KAMEI N, YOSHIDA M, et al. Cell-penetrating peptide penetratin as a potential tool for developing effective nasal vaccination systems[J].JPharmSci, 2016, 105(6): 2014-2017.
[17] ESTES D M. Regulation of IgA responses in cattle, humans and mice[J].VetImmunolImmunopathol, 2010, 138(4): 312-317.
[18] CUBILLOS C, DE LA TORRE B G, JAKAB A, et al. Enhanced mucosal immunoglobulin A response and solid protection against foot-and-mouth disease virus challenge induced by a novel dendrimeric peptide[J].JVirol, 2008, 82(14): 7223-7230.
[19] ALEJO D M, MORAES M P, LIAO X F, et al. An adenovirus vectored mucosal adjuvant augments protection of mice immunized intranasally with an adenovirus-vectored foot-and-mouth disease virus subunit vaccine[J].Vaccine, 2013, 31(18): 2302-2309.
[21] XIE Y L, GAO P, LI Z Y. A recombinant adenovirus expressing P12A and 3C protein of the type O Foot-and-Mouth disease virus stimulates systemic and mucosal immune responses in mice[J].BiomedResInt, 2016, 2016: 7849203.
[22] ZANVIT P, TICHOPD A,M, et al. Adjuvant effect ofBacillusfirmuson the expression of cytokines and toll-like receptors in mouse nasopharynx-associated lymphoid tissue (NALT) after intranasal immunization with inactivated influenza virus type A[J].ImmunolLett, 2010, 134(1): 26-34.
[23] COOPER A M, ROBERTS A D, RHOADES E R, et al. The role of interleukin-12 in acquired immunity to Mycobacterium tuberculosis infection[J].Immunology, 1995, 84(3): 423-432.
[24] FLYNN J L, GOLDSTEIN M M, TRIEBOLD K J, et al. IL-12 increases resistance of BALB/c mice to Mycobacterium tuberculosis infection[J].JImmunol, 1995, 155(5): 2515-2524.
[25] WAKEHAM J, WANG J, MAGRAM J, et al. Lack of both types 1 and 2 cytokines, tissue inflammatory responses, and immune protection during pulmonary infection byMycobacteriumbovisBacille Calmette-Guérin in IL-12-deficient mice[J].JImmunol, 1998, 160(12): 6101-6111.
[26] LYADOVA I V, VORDERMEIER H M, ERUSLANOV E B, et al. Intranasal BCG vaccination protects BALB/c mice against virulentMycobacteriumbovisand accelerates production of IFN-γ in their lungs[J].ClinExpImmunol, 2001, 126(2): 274-279.
[27] CLAPP B, YANG X H, THORNBURG T, et al. Nasal vaccination stimulates CD8+T cells for potent protection against mucosalBrucellamelitensischallenge[J].ImmunolCellBiol, 2016, 94(5): 496-508.
[28] ROSE-JOHN S, WAETZIG G H, SCHELLER J, et al. The IL-6/sIL-6R complex as a novel target for therapeutic approaches[J].ExpertOpinTherTargets, 2007, 11(5): 613-624.

