猪肺炎支原体不同毒力菌株对猪气管上皮3D细胞的损伤差异与机制分析
冯艳艳,王海燕,刘蓓蓓,韦艳娜,张珍珍,白 昀,倪 博,邵国青,雷治海,冯志新*
(1. 南京农业大学动物医学院,南京 210095;2. 江苏省农业科学院兽医研究所·农业部兽用生物制品工程技术重点实验室,南京210014)
猪支原体肺炎(Mycoplasmal pneumonia of swine,MPS)是由猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)引起的一种慢性接触性呼吸道病。MPS世界性流行,发病率高,并常诱发其他病原的感染引起死亡,给现代养猪业造成巨大损失[1]。研究发现,Mhp对猪气管上皮细胞表面纤毛的黏附作用是侵袭宿主呼吸道的关键步骤,决定了支原体的致病性[2-3],因此众多的文献通过猪气管上皮细胞(swine tracheal epithelial cells,STEC)模型探究Mhp的致病机制,但传统STEC都是通过浸没培养,无论是传代的细胞系还是原代分离的细胞均只能单层生长,无法分化形成原代细胞在体内生长条件下的假复层纤毛柱状上皮形状和功能[4];因此,建立一种尽可能接近体内生长方式的细胞培养模型以研究Mhp的感染及与宿主互作关系尤为重要。
近年来有学者利用气液交界面(air-liquid interface,ALI)培养模型研究人呼吸道上皮抗感染防御机制已取得重大突破[5-7],本研究借鉴人呼吸道上皮细胞ALI培养技术经验,建立及优化猪气管上皮传代细胞系的3D培养模型,分别将不同毒力的Mhp菌株感染猪气管上皮细胞,从细胞生长特性、活性和功能等方面比较Mhp强弱毒株的损伤差异及可能机制,为深入探究Mhp的致病机制奠定基础。
1 材料与方法
1.1 试验材料
RPMI-1640购自维森特生物技术有限公司,血清购自Gbico公司;人胎盘胶原Ⅳ购自Sigma公司;LPS购自Sigma公司;Alamar Blue、Hoechst 33342染液购自上海翊圣生物有限公司;NAC抗氧化剂、NO检测试剂盒、乳酸脱氢酶细胞毒性检测试剂盒购自碧云天生物技术有限公司;活性氧检测试剂盒购自南京凯基生物有限公司;CFDA-SE细胞增殖示踪荧光探针购自碧云天生物技术有限公司;黏液蛋白MUC5B一抗购自Santa Cruze;Cy3标记的兔多抗IgG购自碧云天生物技术有限公司;3470(Cat#)Transwell®通透性嵌套购自Costar。
1.2 菌体、细胞
猪肺炎支原体强毒菌株NJ株、中等毒力菌株AH株、弱毒菌株168L株由江苏省农业科学院兽医研究所分离保存,各菌株毒力经猪体试验测定;STEC传代细胞系购自上海抚生实业有限公司。
1.3 传代STEC细胞ALI培养模型
将生长于含10%胎牛血清RPMI-1640培养基中的STEC传代细胞以105·mL-1的浓度接种于胶原包被的24孔Transwell中,每孔接种250 μL,Transwell下层加800 μL细胞培养液,在37 ℃、5% CO2的培养箱中培养48 h,以后每天吸弃从下层小室渗透到支持膜表面液体,直到观察发现细胞长满单层、支持膜表面保持可见的干燥,则说明已形成气液交界面,继续培养5 d后用2.5%戊二醛固定部分细胞,通过扫描电镜观察纤毛分化情况。待纤毛分化成功后,可用于感染试验。
1.4 Mhp感染ALI细胞
分别将Mhp 168L株、NJ株和AH株接种于KM2培养基中,以1∶10复壮,待菌液培养至对数生长期备用。将各菌液以12 000 r·min-1,离心20 min,菌体沉淀用PBS洗涤一次,用无血清的RPMI-1640培养液重悬,调整滴度为107CCU·mL-1,分别以200 μL·孔-1接种于上层小室中已分化的细胞单层,分别标记为168L组、NJ组、AH组;设置阴性对照,接种等体积无血清的RPMI-1640培养液;设置阳性对照,接种用等体积无血清RPMI-1640培养液稀释的10 μg·mL-1的LPS,放入37 ℃、5%CO2的培养箱中孵育培养。
为了鉴定Mhp菌株的感染情况,在感染前按文献报道的方法[8],每管菌株中各加10 μL 10 mmol·L-1的CFDA-SE染液, 放入37 ℃ 200 r·min-1摇床中孵育15 min,进行标记。感染48 h后,用PBS洗涤细胞面3遍,在上层小室中加入100 μL配制好的Hoechst 33342染液标记细胞。用一次性刀片将Transwell insert的支持膜切下,放到载玻片上,用10%甘油封片,于Zeiss Lsm 710激光扫描共聚焦下进行断层扫描鉴定;另外用2.5%戊二醛固定各感染组细胞,通过扫描电镜观察其纤毛生长情况。
1.5 NAC抗氧化剂处理
分别取阴性对照和各感染组的其中三孔细胞,在其Transwell下层各加含终浓度为10 mmol·L-1NAC的新鲜培养液,之后放入37 ℃、5%CO2的培养箱中孵育培养。
1.6 细胞生长特性检测
分别取Mhp各感染组的细胞,在上层小室中加PBS 洗三遍,用Millicell ERS-2 电压计测量Transwell Inserts上下两侧上皮细胞间的测膜电阻TEER。
1.7 细胞活性检测
1.7.1 Alamar Blue检测法 分别取各感染组细胞,在各孔Transwell上下层各加入含10% Alamar Blue的RPMI-1640,在培养箱孵育2~4 h,吸取各孔上层所有液体至新的96孔板中,在激发光波长为560 nm,发射光波长为590 nm的荧光分光光度计上检测。
1.7.2 乳酸脱氢酶(LDH)释放检测法 分别取各感染组Transwell上层液体,按照LDH释放检测试剂盒说明书进行检测。
1.8 细胞黏液分泌检测
在各感染组Transwell上层加入4%的多聚甲醛固定20 min,加入1∶200稀释的anti-MUC5B抗体,4 ℃孵育过夜,第二天加入1∶300稀释的Cy3标记的兔多抗IgG抗体,37 ℃培养箱孵育1 h后,DAPI避光染色,用一次性刀片将Transwell insert的支持膜切下,放到载玻片上,用10%甘油封片,于Zeiss Lsm 710激光扫描共聚焦下进行断层扫描鉴定;之后将Transwell insert的支持膜放到96孔板中,使用550 nm激发波长,570 nm发射波长,检测各组荧光强度。
1.9 细胞氧化应激检测
1.9.1 细胞NO释放检测 分别取各感染组Transwell上层液体,按照NO检测试剂盒说明书进行检测。
1.9.2 细胞内源性ROS 检测 按活性氧检测试剂盒说明书,在各感染组Transwell上层加DCFH-DA荧光探针,培养箱中作用20 min,RPMI-1640洗去未结合的游离探针,设置阳性对照组,使用488 nm激发波长,525 nm发射波长,检测各组荧光强度。
1.10 统计分析
各试验组检测数据使用SPSS软件进行One-way ANOVA与Two-way ANOVA方差分析,并用GraphPad Prism 5软件制图。
2 结 果
2.1 传代STEC细胞ALI培养模型的建立
在ALI培养第5 天时,STEC表面有丰富的类似微绒毛结构分化,且分化数量多,生长旺盛,表示细胞分化状态正常,可用于感染试验(图1)。
2.2 Mhp感染STEC细胞的检测
在感染48 h后,激光共聚焦检测各组Mhp感染情况,结果发现,Mhp 168L株、NJ株和AH株均能成功黏附STEC表面(图2)。
2.3 扫描电镜观察细胞形态
在感染48 h后,扫描电镜观察各感染组STEC表面纤毛生长情况,结果发现,168L株、AH株和NJ株感染组细胞表面的纤毛上均有球状黏附物,且各组纤毛生长状态存在明显差异,与对照组相比,弱毒株168L株组纤毛上有散在的球状黏附物,纤毛状态与对照组差异不大;中等毒力AH株组纤毛上球状黏附物数量增多,纤毛有明显的变粗、破损和脱落现象;强毒株NJ株组纤毛上出现聚堆的球状黏附物,纤毛发生严重的破损和脱落现象(图3)。
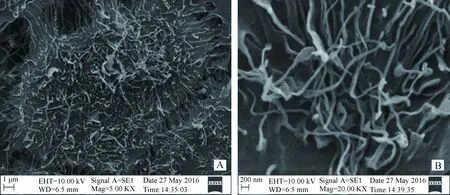
图1 ALI培养第5天的STEC扫描电镜结果Fig.1 The STEC scans by ALI in the fifth day
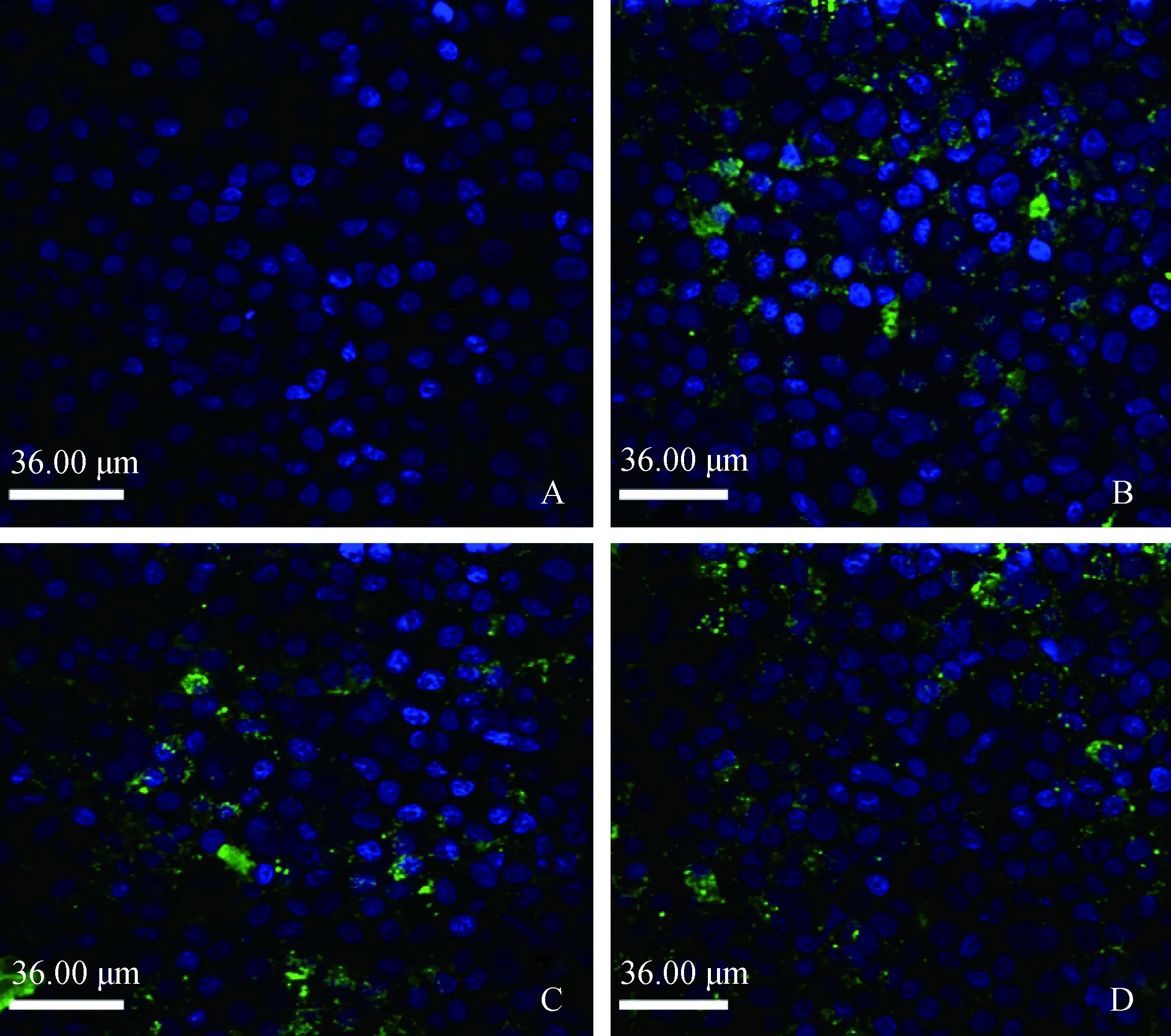
A. Control组;B. Mhp 168L株感染组;C. Mhp AH株感染组;D. Mhp NJ株感染组A. Control group; B. Mhp 168L strains infected group; C. Mhp AH strain infected group; D. Mhp NJ strain infected group图2 不同毒力组Mhp与STEC的黏附作用(48 h)Fig.2 The adherence of Mhp with different virulence to STEC cells (48 h)
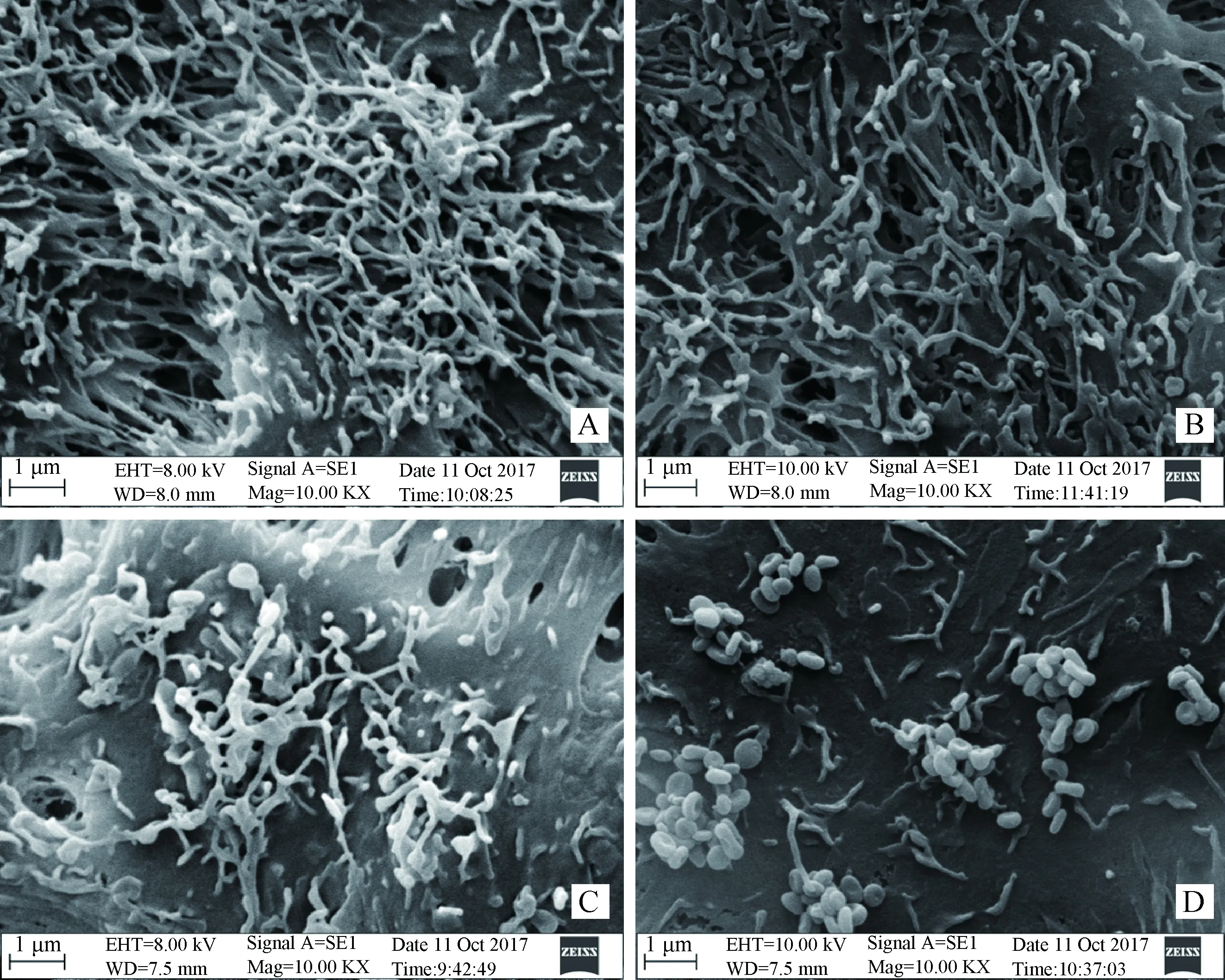
A. Control组;B. Mhp 168L株感染组;C. Mhp AH株感染组;D. Mhp NJ株感染组A. Control group; B. Mhp 168L strains infected group; C. Mhp AH strain infected group; D. Mhp NJ strain infected group图3 不同毒力Mhp感染48 h后STEC纤毛生长情况Fig.3 Cilia of STEC infected by Mhp with different virulence at 48 h
2.4 感染细胞生长特性检测
TEER值能准确地反映细胞间紧密连接状态,从而指示细胞的生长特性。在感染后48 h,检测各组跨细胞膜电阻,发现与阴性对照组相比,各感染组细胞的电阻值均出现了不同程度的下降,其中弱毒株168L株感染组下降程度最小,平均电阻值为113.8 Ω,对细胞生长的抑制较小;而中等毒力AH株和强毒株NJ株感染组下降程度依次变大,平均电阻值仅为84.5和72.9 Ω,对细胞生长的抑制率也依次升高;与阳性对照组相比,168L株与AH株感染组差异均显著(P<0.05),而NJ株感染组与阳性对照组差异不显著(P>0.05);各感染组之间,168L株与AH株、NJ株组相比差异性均显著(P<0.05)(图4)。
2.5 感染细胞活性检测

各组间相同字母代表差异不显著,不同字母代表差异显著(P<0.05). 下表同Columns with the same letters represent no significant difference, without the same superscripts are significantly different (P<0.05). The same as below图4 不同毒力Mhp感染48 h STEC的电阻值Fig.4 TEER of STEC infected by Mhp with different virulence at 48 h
2.5.1 Alamar Blue检测 通过Alamar Blue法检测了不同毒力Mhp菌株对STEC活细胞代谢的抑制率,在感染后24、36、48 h,检测各组细胞Alamar Blue还原率,发现随着感染时间的延长,弱毒株168L株感染组细胞Alamar Blue还原率几乎没有下降,一直稳定在60%左右,各时间点差异不显著(P>0.05),对STEC活细胞代谢的抑制率较低,对细胞活性影响较小;而中等毒力AH株和强毒株NJ株感染组细胞Alamar Blue还原率下降明显,在48 h时下降幅度最大,分别下降至48%和46%,对STEC活细胞代谢的抑制率依次上升,显著降低细胞活性;而且在感染后48 h,与阳性对照组相比,NJ株、AH株组差异不显著(P>0.05),而168L株组与阳性对照组、AH株、NJ株组之间差异均显著(P<0.05)(图5)。
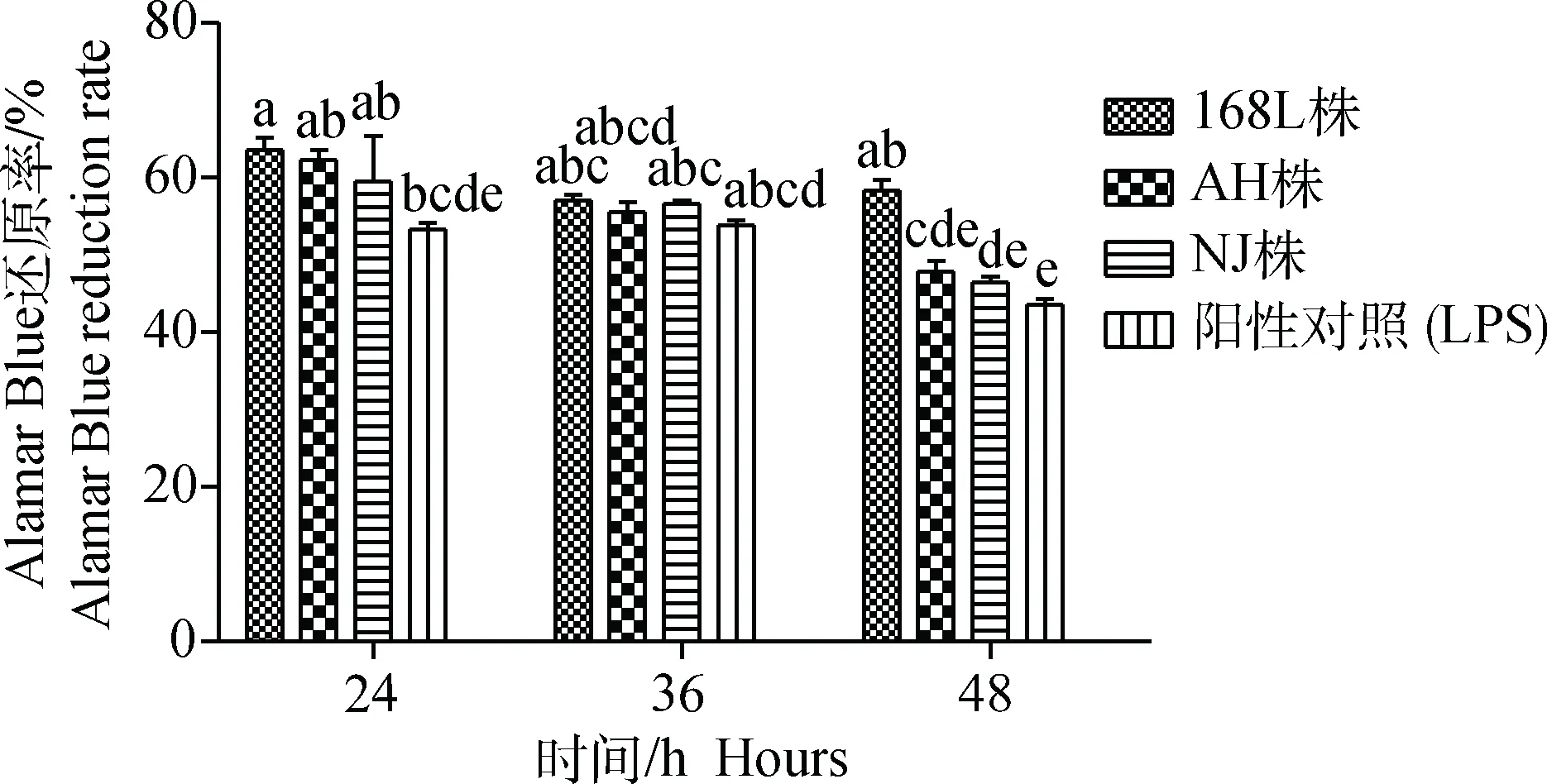
图5 不同毒力的Mhp感染STEC不同时间Alamar Blue还原率Fig.5 Alamar Blue reduction rate of STEC infected by Mhp with different virulence at different time
2.5.2 LDH释放检测 在感染后48 h,通过LDH释放检测各组细胞死亡率,发现与阴性对照组相比,各感染组细胞的细胞死亡率均出现了不同程度的升高,其中弱毒株168L株感染组细胞的死亡率最低,平均死亡率仅比阴性对照组升高4.2%,而中等毒力AH株和强毒株NJ株感染组细胞死亡率依次升高,比阴性对照组升高21.8%和51.0%;与阳性对照组相比,168L株、AH株组差异显著(P<0.05),而NJ株差异不显著(P>0.05)(图6)。
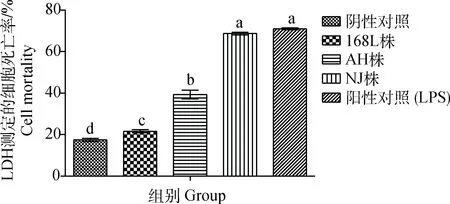
图6 不同毒力Mhp感染48 h STEC的细胞死亡率Fig.6 Cell mortality rate of STEC infected by Mhp with different virulence at 48 h
2.6 感染细胞黏液分析检测
在感染48 h后,通过激光共聚焦检测各组MUC5B黏液蛋白分泌情况,发现与阴性对照组相比,弱毒株168L株感染组差异不显著(P>0.05),而中等毒力AH株和强毒株NJ株感染组黏液蛋白分泌量显著上调,平均荧光强度值较阴性对照组分别升高了126.3和133.3,差异显著(P<0.05);与阳性对照组相比,168L株、AH株和NJ株组差异性均显著(P<0.05);各感染组之间,AH株和NJ株差异性不显著(P>0.05)(图7)。
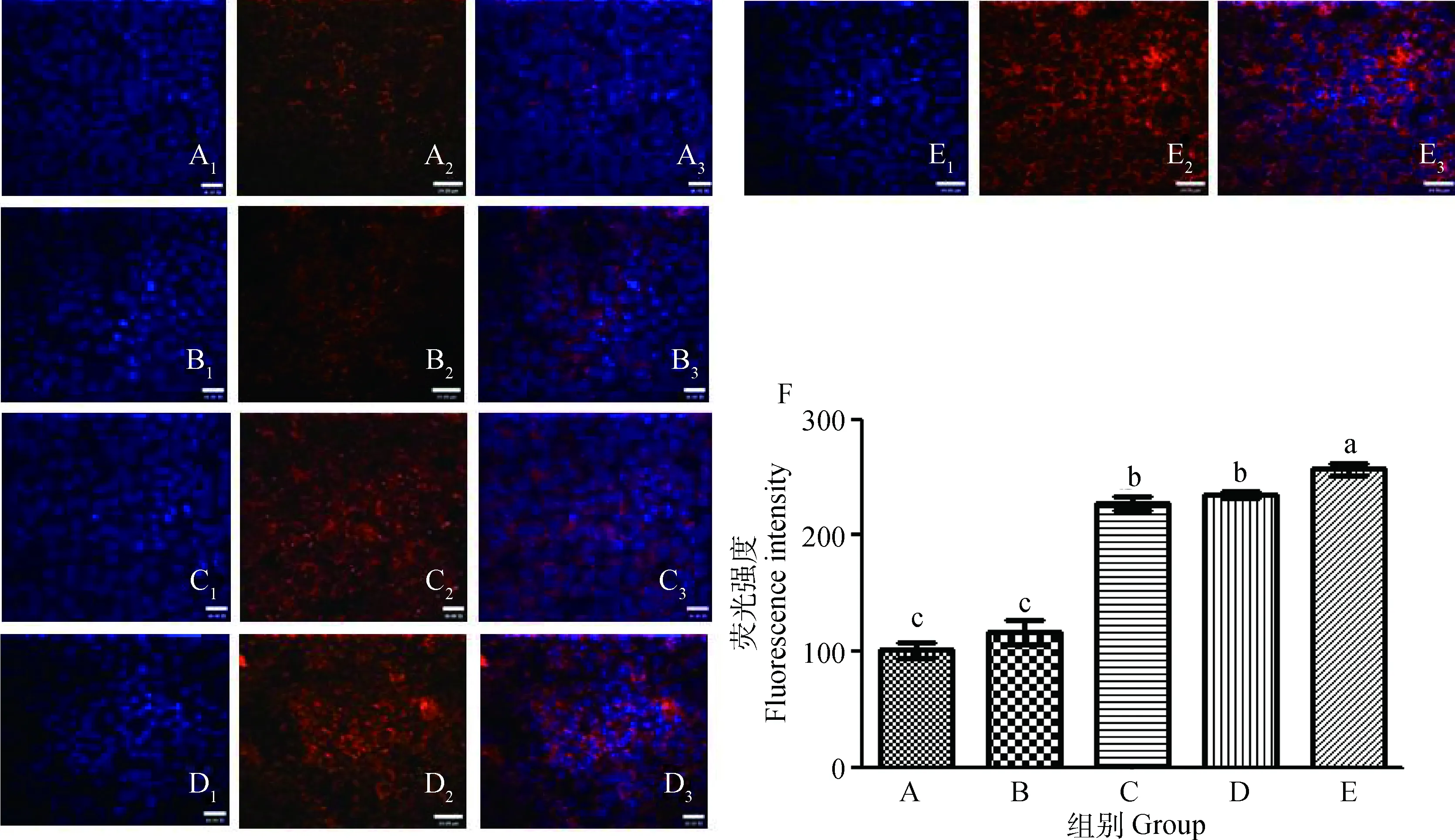
A1~A3. 阴性对照;B1-B3. Mhp 168L株;C1~C3. Mhp AH株;D1~D3. Mhp NJ株;E1~E3. 阳性对照(LPS);1. 细胞核DAPI染色;2. MUC5B蛋白Cy3荧光检测;3. 1、2合并图;F.黏液蛋白MUC5B荧光强度A1-A3. Negative group; B1-B3. Mhp 168L strains; C1-C3. Mhp AH strains D1-D3. Mhp NJ strains; E1-E3. Control group (LPS treated); 1. DAPI dyeing for cell nucleus;2. Cy3 fluorescence for MUC5B;3. Merged 1 & 2;F.Fluorescence intensity of MUC5B图7 不同毒力Mhp感染STEC黏液蛋白MUC5B分泌情况及荧光强度(48 h)Fig.7 The production situation and fluorescence intensity of MUC5B of STEC infected by Mhp with different virulence (48 h)
2.7 感染细胞氧化应激检测
2.7.1 NO释放检测 在感染后24、36、48 h,分别检测各感染组细胞NO释放,发现随着感染时间的延长,弱毒株168L株和中等毒力AH株感染组与阴性对照组中细胞NO释放变化较少,刺激细胞产生含氮自由基的能力较弱,而NJ株感染组细胞NO释放变化较大,且逐步上升,在感染后48 h,强毒株NJ株感染组细胞NO释放上升至最高,均值达到16 μmol·L-1,能刺激细胞产生较高水平的含氮自由基。感染各时间点,168L株感染组与阴性对照组相比差异均不显著(P>0.05),而AH株组与NJ株组在各时间点与阴性对照组相比均差异显著(P<0.05)。在感染后48 h,NJ株感染组释放的NO量与阳性对照组相比差异已不显著(P>0.05)(图8)。
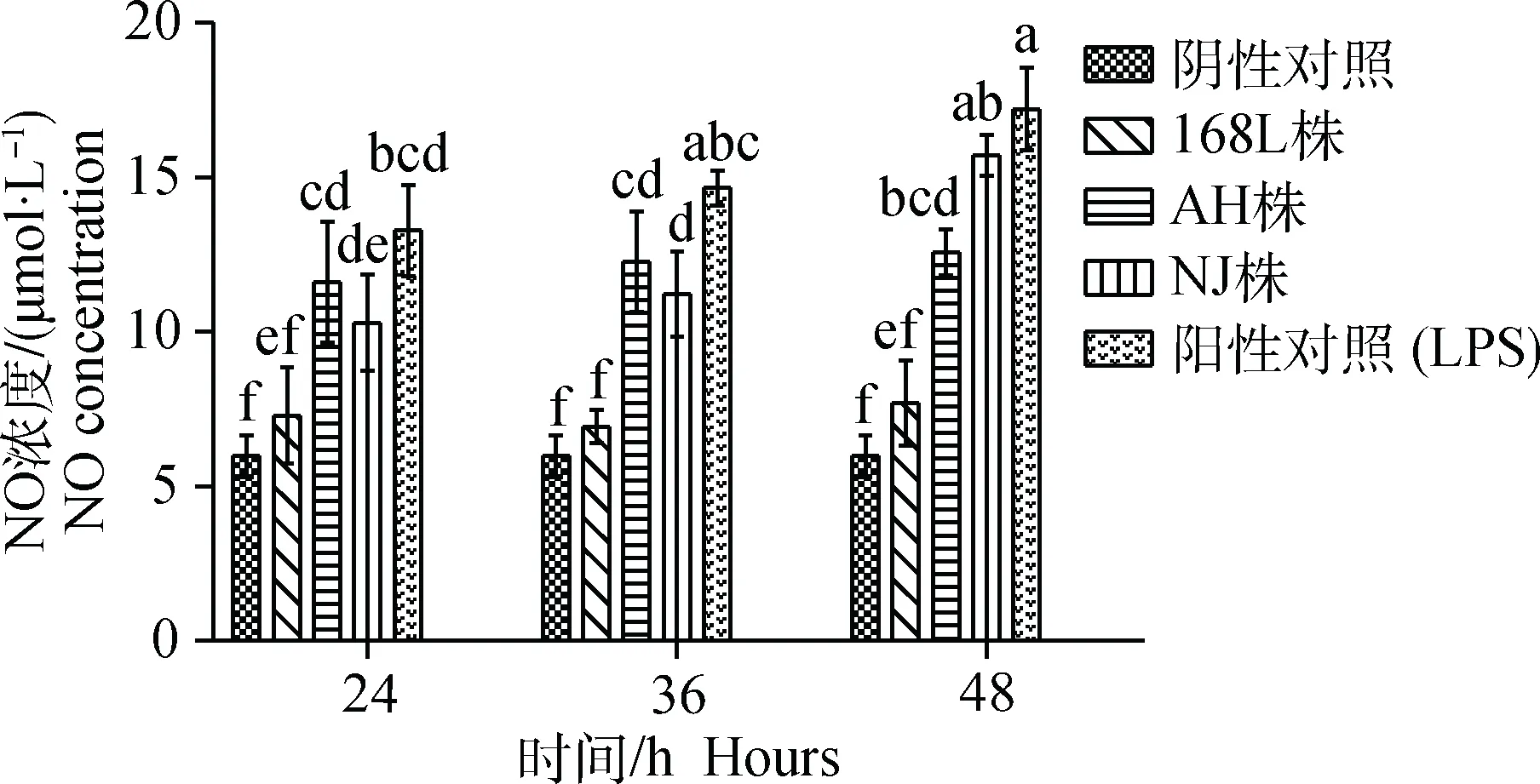
图8 不同毒力的Mhp感染STEC不同时间NO浓度Fig.8 NO concentration of STEC infected by Mhp with different virulence at different time
2.7.2 细胞内源性ROS检测 在感染后48 h,检测各感染组反映ROS释放水平的细胞DCF荧光强度,发现与阴性对照组相比,弱毒株168L株感染组ROS释放水平差异不显著(P>0.05),刺激细胞产生活性氧的能力较弱,而中等毒力AH株和强毒株NJ株感染组与阴性对照组相比差异显著(P<0.05),平均细胞DCF荧光强度分别升高了90.6和775.3,刺激细胞产生活性氧的水平依次升高;NJ株感染组刺激细胞释放ROS的量最高,与阳性对照组差异已不显著(P>0.05)(图9)。
2.8 NAC抗氧化剂对各感染组细胞损伤的影响
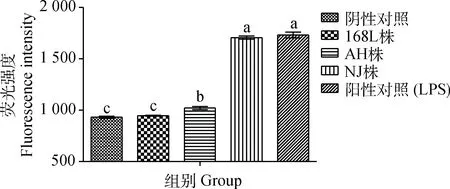
图9 不同毒力Mhp感染48 h STEC的 DCF荧光强度Fig.9 DCF model fluorescence intensity of STEC infected by Mhp with different virulence at 48 h
NAC抗氧化剂处理各组后,在感染后48 h,发现对照组的NAC处理孔与未处理孔相比,其细胞活性(Alamar Blue法)、电阻值和黏液分泌均没有显著变化,说明NAC抗氧化剂对STEC细胞的生长特性、活性与功能无影响;而各感染组的NAC处理孔与未处理孔相比,内源性ROS产生水平与对照组的百分比均有所下降(7.8%~58.3%),且随着感染菌株毒力增加,下降幅度增大,其中弱毒株168L株组的下降水平最低,且与对照组相比,差异不显著;各感染组的NAC处理孔与未处理孔相比,细胞跨膜电阻值与对照组的百分比均有显著上升(3.6%~22.4%),且随着感染菌株毒力增加,上升幅度增大;各感染组的NAC处理孔与未处理孔相比,MUC5B黏液蛋白分泌量与对照组的百分比均有显著下降(7.6%~74.7%),且随着感染菌株毒力增加,下降幅度增大;各感染组的NAC处理孔与未处理孔相比,其细胞活性(Alamar Blue法)与对照组的百分比均有显著提高(3.7%~12.3%),且随着感染菌株毒力增加,提高幅度增大。
NAC处理后,不同毒力Mhp菌株感染组对STEC在跨膜电阻、细胞代谢、黏液分泌功能方面的影响均有不同程度的恢复,且菌株毒力越强,NAC添加后的恢复作用越明显(图10)。
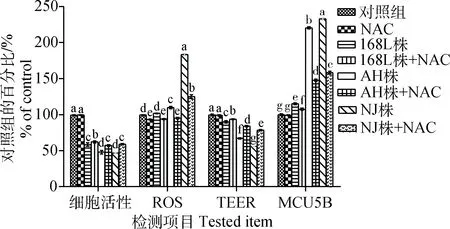
图10 NAC抗氧化剂对不同毒力Mhp感染48 h STEC损伤的影响Fig.10 Effects of NAC antioxidants on the damage of STEC infected by Mhp with different virulence at 48 h
3 讨 论
猪肺炎支原体黏附并定植到猪呼吸道纤毛上皮是感染和发生致病作用的关键阶段[9],但前期研究中选用的体外感染模型均为浸没培养的原代细胞或细胞系,非呼吸道靶细胞或非分化出纤毛的呼吸道上皮细胞的选用,无法模拟Mhp在体内感染的真实状态,影响Mhp感染与致病机制的准确评价[10-11]。气液界面(ALI)培养技术将细胞生长于两相介质上,真实模拟体内呼吸道或消化道的管腔结构。对于呼吸道上皮细胞,有助于细胞立体结构的形成和纤毛及微绒毛的分化,同时具有黏液分泌等细胞功能[12]。因此,本研究通过建立传代STEC 3D细胞模型以及基于此细胞的Mhp侵染模型,更真实地模拟了Mhp与猪呼吸道纤毛的结合过程,为支原体的增殖培养和研究菌体与细胞互作开辟新途径。
本研究分别从细胞形态、细胞生长特性、细胞活性和细胞黏液分泌功能方面比较和分析Mhp强弱毒株对STEC的致病性差异。扫描电镜观察感染不同毒力Mhp菌株的STEC细胞表面纤毛状态,直观体现了各菌株毒力的差异,证实了各菌株的毒力与纤毛细胞损伤的相关性。紧密连接是宿主黏膜屏障的重要组成部分,是黏膜上皮细胞选择性通透作用的物质基础。研究表明,3D细胞的跨膜电阻值TEER能反映细胞间紧密连接形成情况和生长特性,其电阻值越低,紧密连接的完整性和生长特性越差[12-14]。本试验结果显示,感染后48 h,对照组和Mhp 168L组紧密连接和生长特性良好,而AH和NJ组紧密连接被破坏,生长被抑制。这表明Mhp对STEC的生长存在抑制作用,且其抑制作用的程度与菌株的毒力呈正相关。在此基础上,我们又选用Alamar Blue和LDH释放检测两种方法测定STEC活性。Alamar Blue是一种反映活细胞代谢能力[15],且在3D细胞上常用的细胞活性测定方法[16-17],LDH释放检测则是从细胞膜完整性方面测定细胞活性[17-18],我们前期的研究结果表明,Mhp感染有可能会导致细胞膜完整性的破坏[19]。因此,本研究采用以上两种细胞活性检测方法来评价Mhp感染影响细胞活性的情况,并分析导致细胞活性损伤的可能方式。结果表明,Mhp强毒的感染不仅破坏了细胞膜的完整性,同时也降低了细胞的代谢与增殖能力,这种破坏能力同样与菌株的毒力呈正相关。ALI培养与浸没培养的STEC相比,ALI培养的STEC能分泌多种黏液蛋白,如MUC5B、MUC5AC和MUC4等,更接近于体内气管的生理功能[12,20],有研究表明,人肺炎支原体感染,会导致黏液过量分泌,支原体损伤程度越大,黏液分泌量越高,因此黏液分泌过量也是疾病恶化的反映[21]。本试验通过不同毒力的Mhp感染传代STEC 3D细胞,比较各感染组黏液分泌量差异,结果表明,Mhp感染显著上调黏液分泌量,其中NJ株黏液分泌量极显著高于AH株,AH株极显著高于168L株,也同样验证了Mhp菌株毒力越强,刺激感染细胞分泌黏液的量越高,越可能容易引起肺炎病变的恶化。
本研究结果验证了Mhp感染会导致分化的STEC细胞活性降低,生长受到抑制以及黏液分泌量上调,且与菌株的毒力强弱呈正相关。在Mhp可能的致病机制方面,我们前期研究在浸没培养细胞模型上,从细胞氧化系统角度进行探索,初步发现了Mhp强弱毒株体外感染气管上皮细胞后可产生氧化损伤及相关蛋白的表达差异[22-23]。本研究在3D细胞模型上验证细胞氧化损伤与Mhp感染致病的相关性,首先通过测定细胞NO和ROS分泌量,研究结果表明Mhp感染后可刺激宿主细胞产生过量的活性氧自由基与活性氮自由基,且产生量与Mhp毒力呈正相关[24];另外应用NAC抗氧化剂处理Mhp感染组,发现NAC处理后,不同毒力Mhp菌株感染组的ROS和黏液分泌量均显著降低,细胞活性和电阻值均显著升高,其变化水平与菌株的毒力呈正相关。这表明NAC可通过降低细胞内源性ROS分泌量,从而降低Mhp菌株对各感染组细胞形态、细胞活性以及细胞黏液分泌方面的损伤,而且菌株毒力越强,NAC的抑制作用越明显,进一步论证了该氧化应激与后续形成的细胞活性与功能损伤密切相关[ 25]。但同时也发现,在细胞活性的检测中,NAC氧化抑制剂的加入并不能完全恢复感染组细胞的代谢能力,说明Mhp感染引起细胞代谢能力的下调还受其他主要因素的影响。
4 结 论
通过更接近体内环境的猪气管上皮3D分化细胞感染模型证明,Mhp感染可影响宿主细胞的生长特性、活性与功能,损伤分化的纤毛,其损伤的能力与菌株毒力呈正相关;而这种损伤机制与Mhp菌株引起感染细胞氧化应激的能力密切相关。
[1] 张凤强, 武佳斌, 步 帆. 猪支原体肺炎研究进展[J]. 中国动物保健, 2015, 17(6): 30-32. ZHANG F Q, WU J B, BU F. Research progress of mycoplasmal pneumonia of swine[J].ChinaAnimalHealth, 2015, 17(6): 30-32. (in Chinese)
[2] 车巧林, 余姗姗, 刘茂军, 等. 猪肺炎支原体对猪气管上皮细胞的黏附作用[J]. 中国兽医学报, 2015, 35(3): 388-393. CHE Q L, YU S S, LIU M J, et al. Adhesion ofMycoplasmahyopneumoniaeto swine tracheal epithelial cells[J].ChineseJournalofVeterinaryScience, 2015, 35(3): 388-393. (in Chinese)
[3] 冯志新, 刘茂军, 熊祺琰, 等. 猪支原体肺炎活疫苗(168株)肺内免疫机制研究[J]. 中国兽药杂志, 2012, 46(8): 4-7, 19. FENG Z X, LIU M J, XIONG Q Y, et al. Immunologic mechanism of the attenuatedMycoplasmahyopneumoniae168 strain vaccine by intrapulmonic immunization in piglets[J].ChineseJournalofVeterinaryDrug, 2012, 46(8): 4-7, 19. (in Chinese)
[4] 黄 宁, 吴 琦, 李胜富, 等. 利用气液界面无血清培养原代兔气管上皮细胞的研究[J]. 细胞生物学杂志, 1999, 21(1): 39-42. HUANG N, WU Q, LI S F, et al. Studies on primary culture of rabbit tracheal epithelial cells in serum-free hormonesupplemented medium in a biphasic chamber system[J].ChineseJournalofCellBiology, 1999, 21(1): 39-42. (in Chinese)
[5] ZAIDMAN N A, PANOSKALTSIS-MORTARI A, O′GRADY S M. Differentiation of human bronchial epithelial cells: role of hydrocortisone in development of ion transport pathways involved in mucociliary clearance[J].AmJPhysiolCellPhysiol, 2016, 311(2): C225-C236.
[6] JIANG D, BERMAN R, WU Q, et al. The anti-inflammatory effect of alpha-1 antitrypsin in rhinovirus-infected human airway epithelial cells[J].JClinCellImmunol, 2016, 7(6): 475.
[7] ESCAFFRE O, BORISEVICH V, VERGARA L A, et al. Characterization of Nipah virus infection in a model of human airway epithelial cells cultured at an air-liquid interface[J].JGenVirol, 2016, 97(5): 1077-1086.
[8] LI L, XU Z F, ZHOU Y, et al. Analysis onActinobacilluspleuropneumoniaeLuxS regulated genes reveals pleiotropic roles of LuxS/AI-2 on biofilm formation, adhesion ability and iron metabolism[J].MicrobPathog, 2011, 50(6): 293-302.
[9] 车巧林, 熊祺琰, 冯志新, 等. 猪肺炎支原体黏附宿主细胞间接免疫荧光检测方法的建立[J]. 江苏农业学报, 2012, 28(5): 1069-1073. CHE Q L, XIONG Q Y, FENG Z X, et al. Establishment of an indirect immunofluorescence assay for detection of adherence ofMycoplasmahyopneumoniaeto host cells[J].JiangsuJournalofAgriculturalSciences, 2012, 28(5): 1069-1073. (in Chinese)
[10] 高元妹, 徐 军. 小鼠气管上皮细胞的气液相界面培养[J]. 广东医学, 2008, 29(2): 217-219. GAO Y M, XU J. Air-liquid interface cultivation of mouse tracheal epithelial cells[J].GuangdongMedicalJournal, 2008, 29(2): 217-219. (in Chinese)
[11] KRUNKOSKY T M, JORDAN J L, CHAMBERS E, et al.Mycoplasmapneumoniaehost-pathogen studies in an air-liquid culture of differentiated human airway epithelial cells[J].MicrobPathog, 2007, 42(2-3): 98-103.
[12] 李茂中, 庞立丽, 王 宏, 等. 人气管上皮细胞的原代分离及气液界面培养[J]. 中国生物制品学杂志, 2016, 29(1): 65-69. LI M Z, PANG L L, WANG H, et al. Isolation of primary human bronchial epithelial cells and culture at an air-liquid interface[J].ChineseJournalofBiologicals, 2016, 29(1): 65-69. (in Chinese)
[13] NEILSON L, MANKUS C, THORNE D, et al. Development of aninvitrocytotoxicity model for aerosol exposure using 3D reconstructed human airway tissue; application for assessment of e-cigarette aerosol[J].ToxicolinVitro, 2015, 29(7): 1952-1962.
[14] DELGADO-ORTEGA M, OLIVIER M, SIZARET P Y, et al. Newborn pig trachea cell line cultured in air-liquid interface conditions allows a partialinvitrorepresentation of the porcine upper airway tissue[J].BMCCellBiol, 2014, 15: 14.
[15] 杨 阳, 刘宝瑞, 钱晓萍. Alamar Blue法用于体外培养细胞活性检测的方法研究[J]. 现代肿瘤医学, 2006, 14(1): 6-8. YANG Y, LIU B R, QIAN X P. The research on the Alamar Blue assay to evaluate cell proliferation and cytotoxicityinvitro[J].ModernOncology, 2006, 14(1): 6-8. (in Chinese)
[16] LATVALA S, HEDBERG J, MÖLLER L, et al. Optimization of an air-liquid interface exposure system for assessing toxicity of airborne nanoparticles[J].JApplToxicol, 2016, 36(10): 1294-1301.
[17] JING X F, PARK J H, PETERS T M, et al. Toxicity of copper oxide nanoparticles in lung epithelial cells exposed at the air-liquid interface compared withinvivoassessment[J].ToxicolinVitro, 2015, 29(3): 502-511.
[18] CHORTAREA S, CLIFT M J D, VANHECKE D, et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model[J].Nanotoxicology, 2015, 9(8): 983-993.
[19] 车巧林, 刘蓓蓓, 刘茂军, 等. 不同毒力猪肺炎支原体侵入宿主细胞的观察[J]. 畜牧兽医学报, 2014, 45(6): 981-988. CHE Q L, LIU B B, LIU M J, et al. Invasion of host cells by different virulentMycoplasmahyopneumoniae[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(6): 981-988. (in Chinese)
[20] KRAFT M, ADLER K B, INGRAM J L, et al.Mycoplasmapneumoniaeinduces airway epithelial cell expression of MUC5AC in asthma[J].EurRespirJ, 2008, 31(1): 43-46.
[21] HAO Y H, KUANG Z Z, JING J, et al.Mycoplasmapneumoniaemodulates STAT3-STAT6/EGFR-FOXA2 signaling to induce overexpression of airway mucins[J].InfectImmun, 2014, 82(12): 5246-5255.
[22] BAI F F, NI B, LIU M J, et al.Mycoplasmahyopneumoniae-derived lipid-associated membrane proteins induce apoptosis in porcine alveolar macrophage via increasing nitric oxide production, oxidative stress, and caspase-3 activation[J].VetImmunolImmunopathol, 2013, 155(3): 155-161.
[23] 李彦伟, 刘茂军, 刘蓓蓓, 等. 猪肺炎支原体对上皮细胞氧化损伤的分析[J]. 畜牧兽医学报, 2014, 45(7): 1202-1206. LI Y W, LIU M J, LIU B B, et al. Analysis of epithelial cell oxidative damage induced byMycoplasmahyopneumoniae[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(7): 1202-1206. (in Chinese)
[24] 倪 博, 白方方, 韦艳娜, 等. 4株猪肺炎支原体脂膜蛋白对猪肺泡上皮细胞生长抑制作用的比较[J]. 畜牧兽医学报, 2013, 44(8): 1283-1287. NI B, BAI F F, WEI Y N, et al. Comparative analysis of the inhibitory effects of lipid associated membrane proteins from four different strains ofMycoplasmahyopneumoniaeon porcine alveolar epithelial cell lines[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(8): 1283-1287. (in Chinese)
[25] LI Y N, JIANG Z J, XUE D, et al.Mycoplasmaovipneumoniaeinduces sheep airway epithelial cell apoptosis through an ERK signalling-mediated mitochondria pathway[J].BMCMicrobiol, 2016, 16: 222.

