氢氧化镧对磷酸根吸附性能的研究
曲 君,刘彦琳,王 原
(辽宁工业大学 化学与环境工程学院,辽宁 锦州 121001)
磷污染[1]会导致严重的富营养化,不仅会影响江河湖泊的水体质量,而且还极有可能危害人类健康。传统的除磷的方法是生物法和化学法。生物法进行除磷工艺受污水的温度、pH等影响大,对污水中有机物的浓度(BOD)依赖性很强[2];化学法除磷消耗大量的人工合成药物,产生的污泥量很大,难以处理。吸附法除磷弥补了以上方法的不足,吸附除磷使得磷在吸附剂表面附着、离子交换或络合沉淀,实现磷从废水中的分离,并进一步通过解吸过程回收磷资源[3-4]。研究者发现,氧化镧颗粒可使吸附剂表现出优良的尺寸化效应,而且大大的提高其对磷的吸附性能[5]。氢氧化镧吸附剂作为一种新型的人工合成材料,具有良好的吸附性能;目前,利用氯化镧与氢氧化钠反应生成氢氧化镧后,再与水体中的磷酸根反应生成不易溶于水的沉淀物,也会吸附水体中的有机磷和其他形式的磷的化合物。故本论文选用氢氧化镧吸附去除磷酸根,并考察各因素对吸附磷酸根性能的影响。
1 实验材料及方法
1.1 实验试剂及仪器设备
实验试剂:氯化镧(分析纯)、氢氧化钠(分析纯)、盐酸(36%~38%)、硫酸(95%~98%)、酒石酸锑钾(分析纯)、钼酸铵(分析纯)、磷酸二氢钾(分析纯)、抗坏血酸(分析纯)。
实验仪器:722型可见分光光度计(上海仪电分析仪器有限公司),水浴恒温振荡器SHA-B(上海三发科学仪器有限公司),恒温烘箱DHG-9101.1A(上海三发科学仪器有限公司),pH计PHSJ-4F(上海仪电分析仪器有限公司),玻璃仪器(天津玻璃仪器厂),红外光谱仪7080-2B(上海安亭科学仪器厂)。
1.2 实验方法
1.2.1 标准曲线的绘制
在25 mL磨口带塞儿比色管中配制梯度浓度的磷酸根标准溶液,然后分别加入4 mL组合试剂(2.50 mol/L硫酸溶液50 mL,8.89 mmol/L酒石酸锑氧钾溶液5 mL,32.04 mmol/L钼酸铵溶液15 mL和0.10 mol/L抗坏血酸溶液30 mL,每加一种试剂后都要混匀,现配现用),10min后,在波长890 nm处测定吸光度,以含有混合试剂的比色管作为空白参比。最后以测定的吸光度值为纵坐标,磷的浓度为横坐标,绘制出吸附度对磷酸盐浓度的标准曲线。通过线性拟合得出,A=0.73031C-0.00199,其相关系数R2=0.9995。
1.2.2 考察各个因素对吸附量的影响

2 结果与讨论
2.1 考察pH对吸附性能的影响
由图1可见,随着pH值的增加吸附量先增大后减小,在pH值=3处达到峰值。可能原因是溶液的pH增大时,氢氧根浓度增加,氢氧根与磷酸根离子之间存在竞争吸附作用,而氢氧化镧吸附剂更易吸附氢氧根,因此除磷率下降很快,进而吸附后溶液的pH会降低。但是pH较低时,氢氧化镧吸附剂会趋于溶解,不能对磷酸根产生吸附作用,因此pH较低,氢氧化镧吸附剂除磷率会略微减小。故此选用pH值为3的条件下进行除磷。

图1 吸附量随着pH的变化图
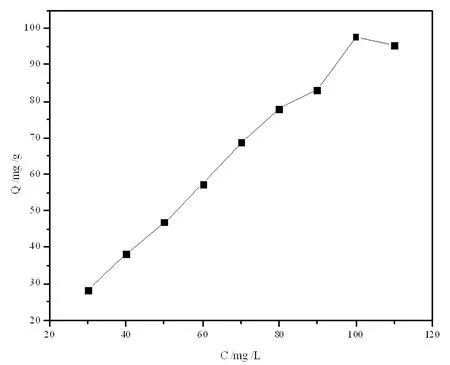
图2 吸附量随着磷酸根初始浓度的变化图
2.2 考察磷酸根初始浓度对吸附性能的影响
从图2中可见随着磷酸根初始浓度值的增大,吸附量随之增大,并在100mg/L时达到峰值。分析原因可能是一定量氢氧化镧吸附剂的吸附位点是一定的,当磷酸根浓度较低时,吸附位点并未达到饱和;之后随着初始磷浓度的增加,吸附位点会被逐渐占据,直至达到饱和。
2.3 考察吸附温度对吸附性能的影响
从图3可知,不同浓度下进行吸附,吸附量随温度变化有相同的趋势,即随着吸附温度的提高,吸附量会有略微的变化,但是总体上为一条平直直线,可见温度这一影响因素相对于其他的影响因素可忽略;原因是升高温度有利于提高磷酸根离子向氢氧化镧吸附剂表面的扩散速率,使更多的磷酸根离子有机会被吸附,但是温度过高可能会破坏吸附剂结构,使其部分分解;因此,通常在室温条件下进行吸附即可。
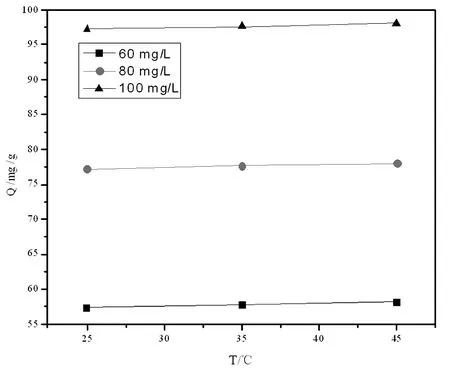
图3 吸附量随着吸附温度的变化图
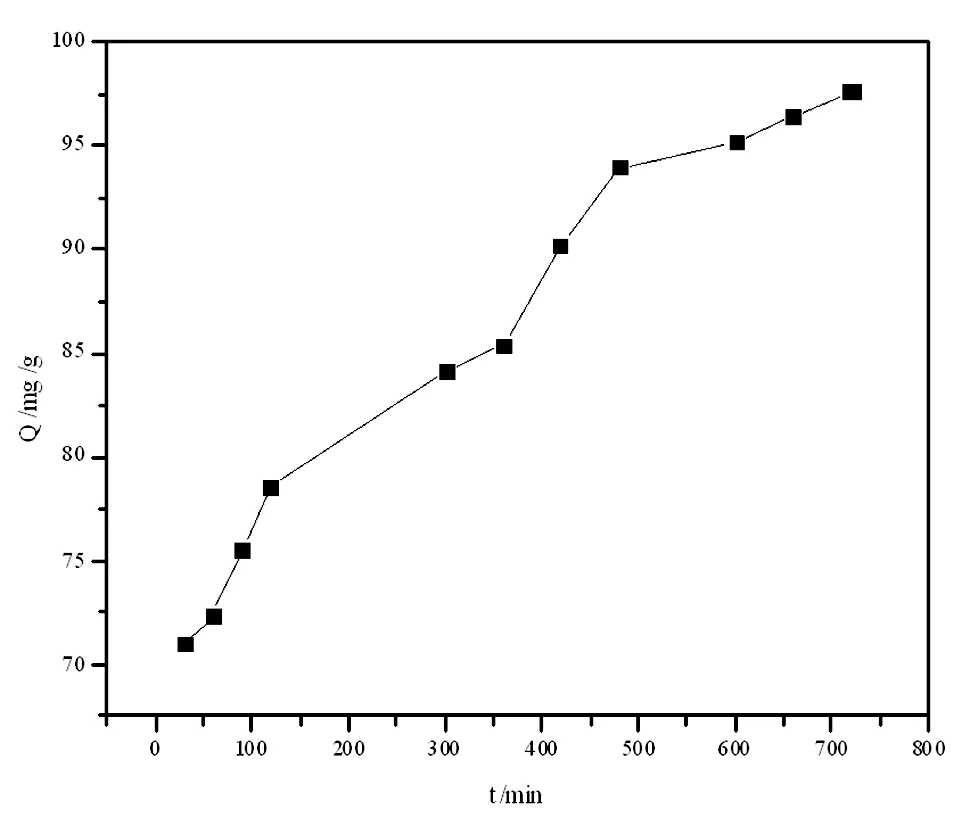
图4 吸附量随着吸附时间的变化图
2.4 考察吸附时间对吸附性能的影响
图4中,吸附量整体随时间的变化呈上升的趋势。吸附时间在(0~500min)时,图中曲线急速上升即吸附量迅速增加,说明吸附反应速率很快,这是由于溶液与吸附剂表面存在较大的浓度梯度,传质速度较快。在吸附反应在(500~700 min)时,图中曲线斜率明显降低即吸附量的增加速度明显减慢,说明吸附反应继续进行但其速度在不断减小。这是由于此时氢氧化镧表面活性吸附位点逐渐减少。
2.5 吸附等温线
Langmuir等温吸附模型:该模型假设吸附剂对吸附质呈单分子层吸附,且在吸附剂表面均匀分布着有限个吸附位点。其表达式为:
(1)
Freundlich等温吸附模型:该模型可用来描述非均相体系。其表达式为:
(2)
分别对两种模型进行考察,用origin作图,如图5,Langmuir模型得到一条Ce/qe-Ce的线性相关线,方程为A=0.01429C-0.02308,其R2为0.9967;如图6 Freundlich模型,得到一条lgqe-lgCe的线性相关线,其R2为0.8458。结果表明Langmuir等温吸附模型方程的R2大于0.99,可见该模型线性拟合的很好;进一步推断该吸附应属于单分子层吸附。

图5 Langmuir等温模型
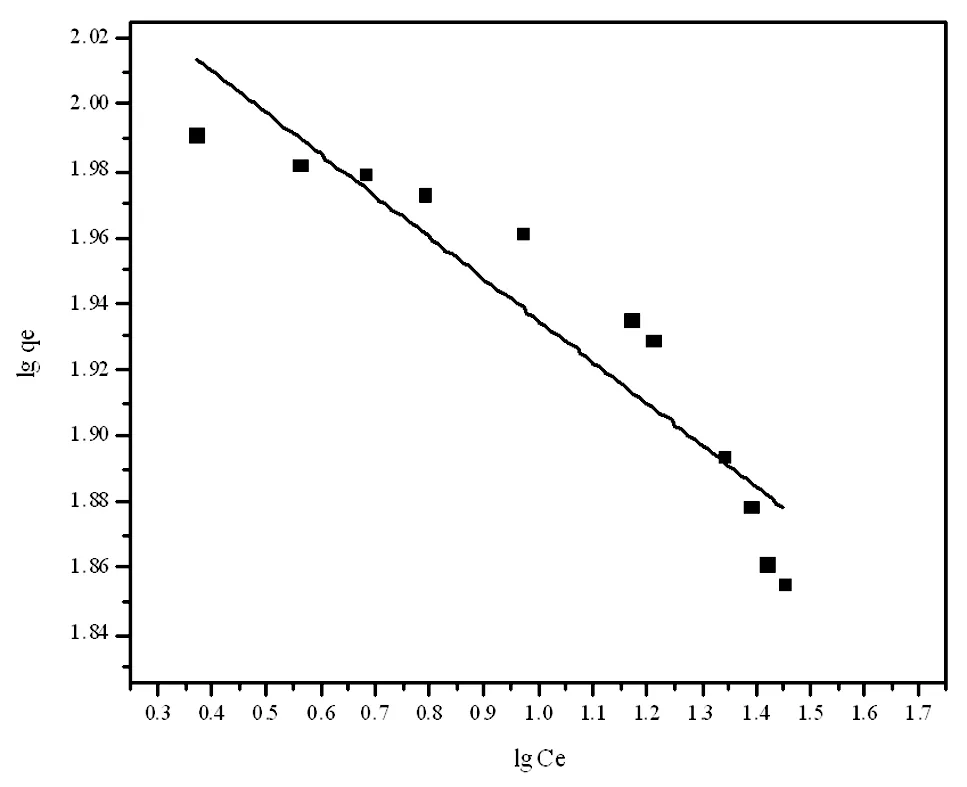
图6 Freundlich等温模型
2.6 动力学计算
伪一级动力学方程积分式如下:
log(qe-qt)=log qe-k1t / 2.303
(3)
式中:qe是吸附平衡时的吸附量,mg/g;qt是吸附时间为t时的吸附量,mg/g;k1是伪一级反应速率常数,min-1;其中k1可以通过log(qe-qt)~t 作图得到。
伪二级动力学方程积分式如下:
(4)
式中:qe是吸附平衡时的吸附量,mg/g;qt是吸附时间为t时的吸附量,mg/g;k2是伪二级反应速率常数,g·mg-1·min-1;其中k2和qe可以通过t/qt~t作图得出。
通过吸附时间对吸附量的影响,对动力学模型进行研究,将吸附量随吸附时间变化的数据代入方程(3),通过origin作图,得到一条lg(qe-qt)-t的线性相关线,方程为A=1.761-0.00295C,其R2为0.8563,如图7所示。代入方程(4)作图得到一条t/qt-t的线性相关线,方程为A=0.01003C+0.32193,其R2为0.9981,如图8所示。由此可见,伪二级动力学模型的方程R2大于0.99,具有很好的线性相关性;能更好的反映氢氧化镧吸附剂对磷酸根的动力学吸附过程。

图7 伪一级动力学方程拟合直线

图8 伪二级动力学方程拟合直线
3 结论
(1)在对pH值影响因素的研究中,经过实验测得最佳的吸附pH值为3。较大的磷酸根初始浓度的吸附效果更好,经过实验测得最佳的磷酸根初始浓度是100 mg/L。对于吸附温度的升高吸附量无明显变化,选取在室温下进行吸附即可。随着吸附时间的延长,吸附量会有明显的增大,最终测得在12 h后吸附量不再有明显变化。
(2)经过对吸附等温线的研究,符合Langmuir等温模型氢氧化镧对磷酸根的吸附过程属于单分子层吸附,伪二级动力学方程可以很好的反映氢氧化镧对磷酸根的动力学过程。
[1] 李 彬.稀土吸附剂微污染水深度除磷研究[D].昆明:昆明理工大学,2005.
[2] 尹 雯.复合改性除磷剂的制备及用于富营养化水体的试验研究[D].云南:云南师范大学,2006.
[3] 罗 芳.固定化活性金属氧化物除磷的进一步实验研究[D].昆明:昆明理工大学,2010.
[4] 刘艳冰.镧-铁复合氧化物污水除磷及其真空再生的研究[D].昆明:昆明理工大学,2011.
[5] 刘泉利.氧化镧改性硅酸盐矿物的表征及其除磷机理研究[D].北京:北京科技大学,2017.
(本文文献格式:曲君,刘彦琳,王原.氢氧化镧对磷酸根吸附性能的研究[J].山东化工,2018,47(02):10-12.)

