厚朴饮片不同浓度乙醇浸出物的研究
李文惠,翁德会
(武汉华夏理工学院 生物与制药工程学院,湖北 武汉 430223)
厚朴为木兰科植物厚朴(Magnolia officinalis Rehd. et Wils.)的干燥干皮、根皮及枝皮[1]。厚朴中含酚类、生物碱类和挥发油类等成分,厚朴酚、和厚朴酚是其主要活性成分[2-3]。但是不同产地、不同生长年限的厚朴饮片中所含有的厚朴酚、和厚朴酚的含量有极大的差异,从而影响临床疗效[4-6]。药典中厚朴醇浸出物是考核厚朴质量的一个重要指标,因而本实验是以恩施道地厚朴为研究对象,对其醇浸出物进行研究。文献研究表明[7-8],不同的醇浓度提取的浸出物的含量是不一样的,通过采用不同浓度的醇分别对厚朴进行提取,从而来制定厚朴的质量控制指标提供参考,并为厚朴饮片的质量分级管理提供依据。
1 实验试剂、仪器设备与药材
1.1 仪器、试剂与样品
FC204 电子分析天平(上海精密科学仪器有限公司);TU-1900 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);数字显示电子恒温水浴锅(HW·SY11-KP2巩义市予华);电热恒温鼓风干燥箱(101-OEBS北京市医疗仪器厂);乙醇(分析纯,天津市大陆化学试剂厂)。
厚朴酚对照品;中国食品药品检查研究院,含量为98.8%,批号:110729-201513;和厚朴酚对照品;中国食品药品检查研究院,含量为99.3%,批号:110730-201614。
1.2 实验材料
实验所用样品是采购于武汉市刘天保中药饮片厂,产地为湖北恩施,经湖北中医药大学张林碧教授鉴定为木兰科厚朴(Magnolia officinalis Rehd.et Wils)的树皮。
2 实验方法
2.1 对照品溶液的制备
精密称取经五氧化二磷干燥至恒重的厚朴酚对照品3.0 mg、和厚朴酚对照品3.0 mg分别至10 mL容量瓶,用乙醇溶解并稀释定容到规定的刻度,振摇并摇匀,即为厚朴酚、和厚朴酚的对照品贮备液。
2.2 测定波长的选择
准确吸取厚朴酚对照品溶液1.5mL置于 25mL量瓶中,和厚朴酚对照品溶液1.0 mL置于 25 mL量瓶中,乙醇定容摇匀。以乙醇为参比,于紫外200~400 nm波长范围内进行波长扫描,测定其紫外吸收曲线。结果如图1、2所示,厚朴酚最大吸收波长为292 nm,和厚朴酚最大吸收波长为294 nm。

图1 厚朴酚紫外光谱图(λmax=292 nm ,A=0.556)

图2 和厚朴酚紫外光谱图(λmax=294 nm ,A=0.493)
2.3 线性关系考察
2.3.1 厚朴酚标准曲线的绘制
精密吸取厚朴酚对照品贮备液0.5,0.75,1.0,1.25,1.5 mL置于25 mL量瓶中,以乙醇定容摇匀,得对照品的溶液。以乙醇为参比,置于紫外仪器中在292 nm条件下测其吸光度,线性回归方程y=0.0308x(r2=0.9999)。表明厚朴酚的吸光度和浓度在6~18μg/mL浓度范围时,具有较好的线性关系。
2.3.2 和厚朴酚标准曲线的绘制
精密吸取和厚朴酚对照品贮备液1,1.25,1.5,1.75,2.0mL置于50mL量瓶中,用乙醇定容摇匀,得对照品的溶液。以乙醇为参比,置于紫外仪器中在294 nm条件下测其吸光度,线性方程y=0.0413x(r2=0.9995)。表明和厚朴酚的吸光度和浓度在6~12μg/mL浓度范围时,具有较好的线性关系。
2.3.3 精密度实验
精密移取厚朴酚对照品溶液1.5 mL,置于10 mL量瓶中,用乙醇稀释定容至刻度,在上述光谱条件下进行分析,连续测定其吸收度,并计算RSD为2.88%,表明本仪器精密度良好。
2.3.4 稳定性实验
称取65%乙醇提取的浸出物0.01 g用65%的乙醇溶解并定容至250 mL,分别于0、1、2、3、4 h,在上述光谱条件下测定其吸光度,并计算RSD,厚朴酚的RSD为1.46%,和厚朴酚的RSD为1.628%,说明供试品溶液在4 h内较稳定。
2.3.5 重复试验
分别称取75%乙醇提取的浸出物0.01 g 5份,分别用65%的乙醇溶解并定容至250 mL,测定其吸收度,计算厚朴酚、和厚朴酚的含量及RSD值,厚朴酚的RSD为1.916%,和厚朴酚的RSD为1.79%,表明重现性较好。
2.3.6 加样回收率试验
采用回收率试验的方法,以65%乙醇提取的浸出物为样品,称取样品加入一定的对照品溶液,按照样品测定方法,在292、294 nm紫外下,测定它们的吸收度,计算其含量,结果见表1、2,表明回收率较高。
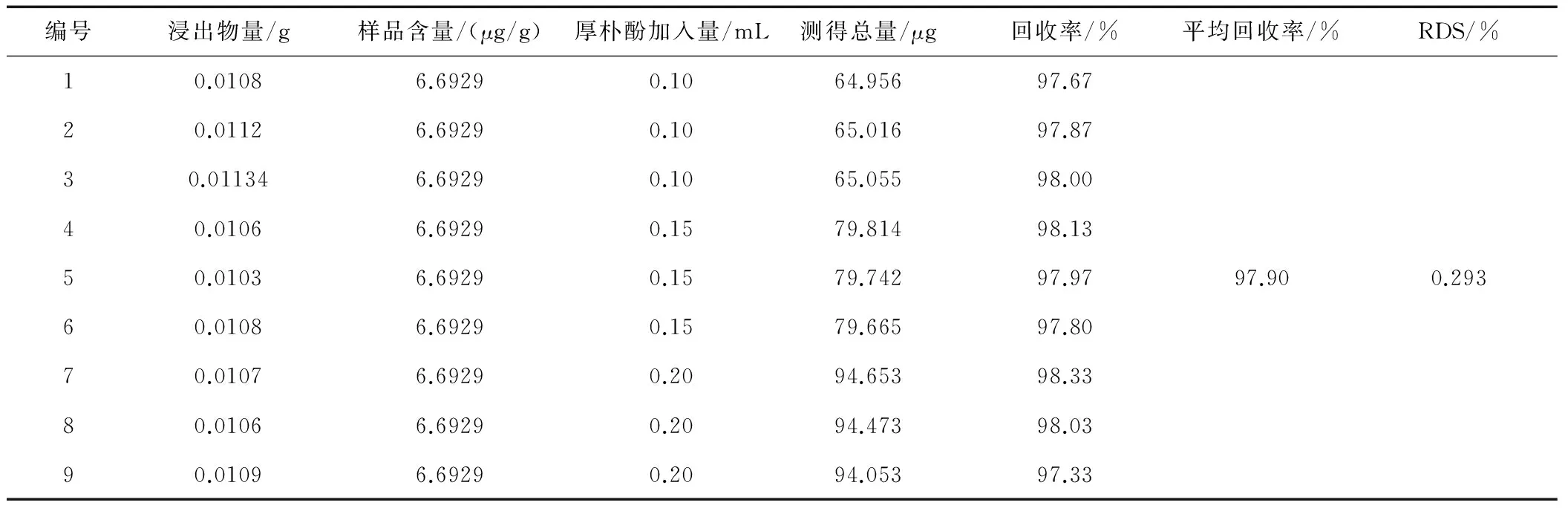
表1 厚朴酚加样回收率测定试验结果
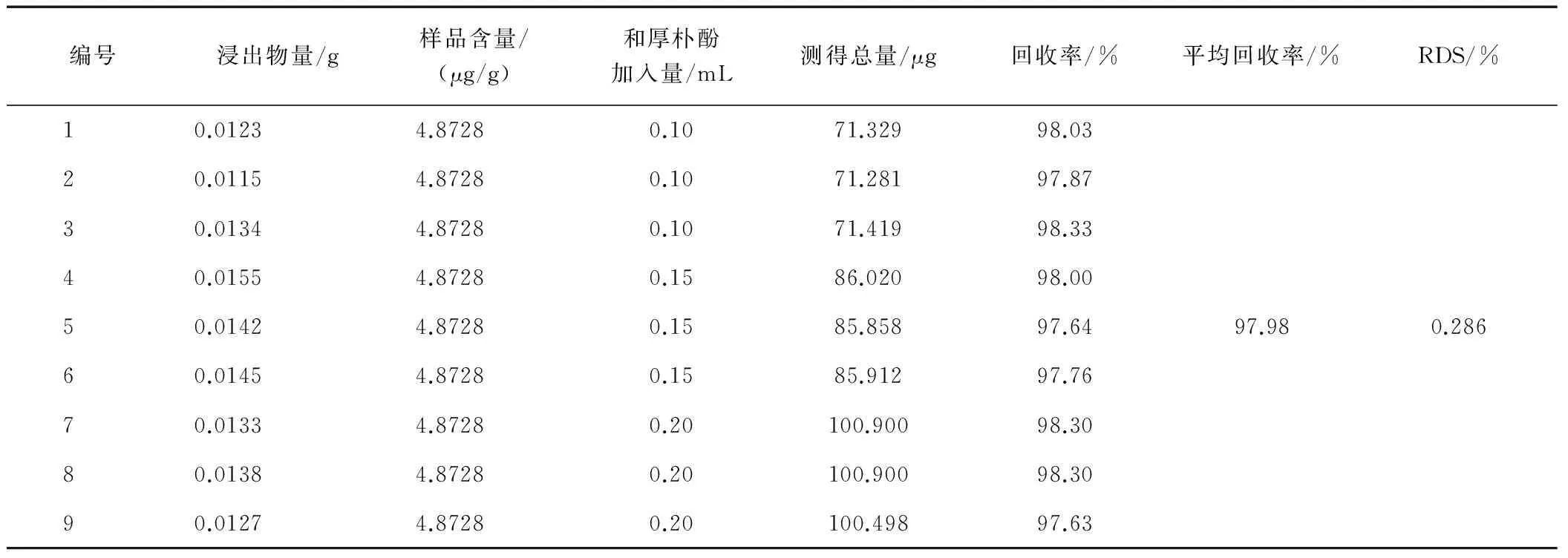
表2 和厚朴酚加样回收率测定试验结果
2.4 含量测定
2.4.1 不同浓度乙醇浸出物的提取与测定
按照中国药典2015版(四部)通则2201中热浸法测定。分别取供试品约4 g,精密称定,置250 mL的圆底烧瓶中,分别用55%、65%、75%、85%、95%浓度的乙醇100 mL[9-11],密塞,称定质量,静置1 h后,连接回流冷凝管,加热至沸腾,并保持微沸1 h。放冷后,取下圆底烧瓶,密塞,再称定质量,用乙醇补足减失的质量,摇匀,用干燥滤器滤过,精密量取滤液25 mL,置已干燥至恒重的125 mL蒸发皿中,在水浴上蒸干后,于105℃干燥3 h,置干燥器中冷却30min,迅速精密称定重量。除另有规定外,以干燥器计算供试品中水溶性浸出物的含量(%),结果见表3。
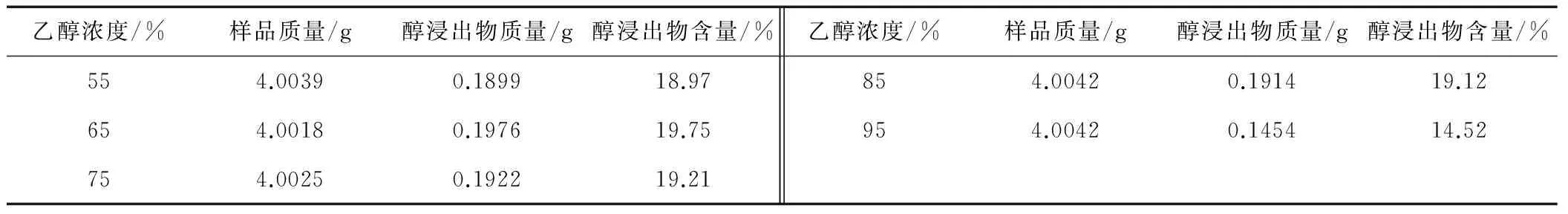
表3 浸出物含量表
2.4.2 不同浓度乙醇浸出物中有效成分的含量测定
分别称取上述5种浸出物各3份,每份0.01 g,精密称定,用65%乙醇溶解并稀释定容至250 mL,在上述色谱条件下测定其吸光度,计算其厚朴酚、和厚朴酚的含量,结果见表4。
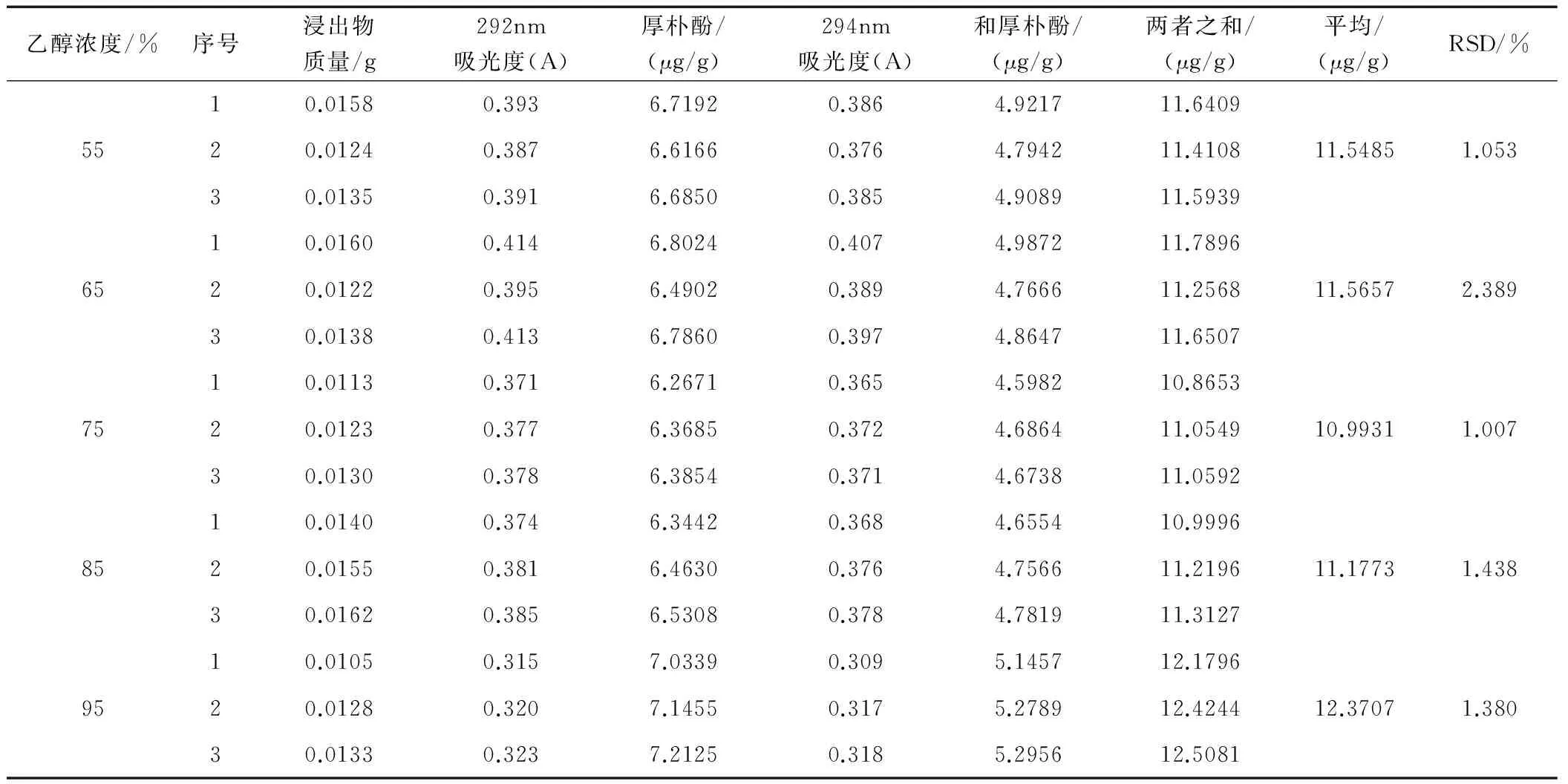
表4 浸出物中厚朴酚与和厚朴酚含量测定结果
结合表3、表4中醇浸出物含量和浸出物中厚朴酚、和厚朴酚含量结果,计算厚朴饮片中不同浓度乙醇提取的厚朴酚、和厚朴酚的含量见表5。

表5 厚朴饮片不同乙醇浓度提取物中有效成分的含量
从表5可知,用65%乙醇提取厚朴饮片,所得厚朴酚、和厚朴酚的综合提取率最高。厚朴饮片醇浸出物提取所需的乙醇最佳浓度为65%。
3 总结
(1)不同浓度乙醇提取厚朴浸出物,所得到的浸出物溶液颜色有所不同,55%乙醇提取的浸出物颜色最浅,呈浅棕色,其余乙醇浓度下提取出的浸出物溶液颜色相差不多,呈深棕色。
(2)在不同乙醇浓度下提取的醇浸出物量具有一定差异,95%的醇浸出物量最少,55%的醇浸出物量其次,65%,75%,85%的醇浸出物量差异不大。
(3)测定不同浓度乙醇提取的浸出物中厚朴酚与和厚朴酚含量,结果显示,95%乙醇浓度的浸出物中厚朴酚与和厚朴酚之和含量最高,75%乙醇浓度的含量最低,55%、65%、85%乙醇浓度的含量居中。
(4)结合醇浸出物量和浸出物中厚朴酚与和厚朴酚含量结果,计算厚朴中有效成分的综合提取率, 65%乙醇提取的厚朴酚、和厚朴酚的综合提取率最高。厚朴饮片醇浸出物提取所需的乙醇最佳浓度为65%。
[1]中华人民共和国药典委员会.中华人民共和国药典2015年版(一部)[M].北京:化学工业出版社,2015:251.
[2]郑虎占,董泽宏,余 靖.中药现代化研究与应用(第四卷)[M].北京:学苑出版社,1998:3280-3304.
[3]洪 燕,周先礼,黄 帅,等.凹叶厚朴中生物碱成分的研究[J].华西药学杂志,2007,22(1):30-33.
[4]翁德会,刘先琼,许腊英,等.不同等级厚朴饮片质量评价指标的系统聚类分析[J].中国实验方剂学杂志,2016,22(23):6-10.
[5]翁德会,许腊英.不同产地姜厚朴饮片气相指纹图谱的探讨[J].湖北中医学院学报,2008,10(2):41-43.
[6]杨红兵,詹亚华,石 磊,等.湖北恩施产厚朴的质量研究[J].中国医院药学杂志,2008,28(12):690-693.
[7]苏 健,王宝琴.厚朴及其制剂中厚朴酚、和厚朴酚含量测定方法研究综述[J].中国中医药信息杂,2002,9(9):45-47.
[8]翁德会,吴士筠,魏艳芬,等.用紫外分光光度法分析中药厚朴饮片[J].时珍国医国药,2011,22(8):1900-1901.
[9]崔乘幸,许光日,汤 波,等.中药厚朴中厚朴酚、和厚朴酚的提取研究[J].河南科技学院学报,2008,36(1):40-42.
[10] 叶 卉,冉晓辉,俞 凯.厚朴提取物工艺研究[J].医药导报,2008,27(8):974-975.
[11]张建和,符伟玉,莫丽儿.中药厚朴及其提取工艺的研究概况[J].时珍国医国药,2004,15(5):313-314.

