羊传染性脓疱病毒PCR检测方法的建立与应用
沙娜瓦尔·塔希,买买提艾力·斯迪克,李 舵,王 文,美热木古丽·巴依待拉提,马晓燕,苏晓慧,盛卓君
(新疆维吾尔自治区动物卫生监督所,新疆乌鲁木齐 830001)
羊传染性脓疱又称为羊口疮,是由痘病毒科副痘病毒属的传染性脓疱病毒(Contagious pustular dermatitis virus,CPDV)引起的,主要感染山羊和绵羊的一种急性、接触性传染病[1]。该病在全世界范围都可发生,主要危害3~6月龄羔羊,一般呈群发性流行;成年羊也能够感染该病毒,但是一般不表现临床症状,且往往呈散发性[2-3]。患病羊主要临床症状为口腔黏膜、舌、唇等部位出现丘疹、红斑、水疱、脓疱,脓疱破裂继而发展成为烂斑,最后形成厚厚的疣状痂块[4]。这会导致患病羊出现采食困难,因营养不良而死去。患病羔羊在吮吸母羊乳头时可以通过皮肤感染母羊,继而母羊又传播至公羊,给养羊业造成一定的经济损失。
目前,国内对CPDV的检测大多采用电子显微镜检查(EM)、血清学检查、病原分离等[5]。这些检测方法存在操作时间长、过程繁琐、敏感性低等不足。并且CPDV引起的临床症状与山羊痘、口蹄疫等类似,如果再继发细菌感染,就很容易造成误诊[3]。本研究根据GenBank中公布的CPDV毒株序列,通过多毒株B2L序列保守区的比对,设计并合成1对特异性引物,建立了特异性PCR检测方法。采用此方法,对新疆维吾尔自治区南疆地区的部分疑似感染CPDV的羊群进行了检测,以验证该方法的应用效果。
1 材料与方法
1.1 材料
1.1.1临床待检样品 在新疆维吾尔自治区南疆地区喀什、阿克苏、和田、克州等区域采集的发病羊疑似病料。
1.1.2主要试剂 DL2000 DNA Marker、琼脂糖、Premix Taq(Ex Taq Version 2.0)、RNase-free Water、DNA提取试剂盒:购自生工生物工程(上海)有限公司合成。
1.1.3引物设计与合成 根据GenBank中公布的CPDV毒株序列,通过多毒株(登录号分别为 AY386264.1、AY386263.1、DQ184476.1、HM133903.1)B2L序列保守区的比对,利用Primmer 5.0软件设计1对引物,预期PCR扩增核酸片段大小为436 bp。引物由生工生物工程(上海)有限公司合成。上游引物:P1 5´-GGGTCCGCGTTCTTCCACTC-3´;下游引物:P1 5´-GGTCCGTGTCCACCATCAAG-3´。
1.2 方法
1.2.1病毒核酸的提取 按照病毒核酸提取试剂盒操作说明书进行病毒核酸提取;提取之后将其置于4 ℃保存。对采集的羊唇部病变皮肤,首先用20 mmol/L的盐酸盐缓冲液进行洗涤;然后用高压灭菌剪刀剪碎,将其置于研钵中;用研磨棒充分研磨,加入一定量5%的双抗(青霉素和链霉素),再加维持液(MEM培养基中加入1%的双抗,用NaHCO3调节pH至7.0制备而成)稀释,3 000 r/min 离心10 min,取上清无菌过滤(用0.45微孔滤膜);收集滤液并将其分装至离心管;取出200 µL进行DNA提取;最后将剩余滤液置于−20 ℃保存备用。
1.2.2PCR方法的建立 25 µL PCR反应总体系:Premix Taq(Ex Taq Version 2.0)12.5 µL,上下游引 物 各 0.5µL(20 µmol/L),DNA 模 板 2 µL,RNase-free Water 9.5 µL。PCR 反应条件:94 ℃预变性3 min,94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,循环35次,72 ℃延伸10 min,4 ℃ 5 min。取PCR产物5 µL,在1%的琼脂糖凝胶电泳中进行电泳,用凝胶成像系统观察结果。
1.2.3PCR扩增的特异性试验 用建立的PCR方法分别检测1.2.1中提取到的羊痘病毒、口蹄疫病毒、CPDV、小反刍兽疫病毒、蓝舌病病毒,以及健康羊组织,检测引物的特异性,同时用三蒸水作阴性对照。
1.2.4PCR扩增的敏感性试验 对CPDV模板DNA,用RNase-free Water连续作10倍梯度稀释;用上述已建立并优化好的最佳反应体系和反应条件进行PCR扩增,确定出现特异性扩增条带的最低DNA模板量。该模板量即为最低检出量。用核酸蛋白仪检测最初模板浓度并计算出最初模板量。
1.2.5临床样品检测 对采自新疆维吾尔自治区南疆地区喀什、阿克苏、和田、克州、巴州等区域发病山羊的48份疑似病料进行检测。
2 结果
2.1 PCR反应的最佳条件
结果显示:当退火温度为56 ℃时,目的条带最亮,且清晰无杂带(图1);当引物量为0.6 µL时,目的条带最亮,且杂带较少,适合观察(图2)。因此,所建立的PCR检测方法的最适退火温度为56 ℃,最佳引物量为 0.6 µL。
2.2 特异性试验
将CPDV、羊痘病毒、口蹄疫病毒基因组DNA为PCR反应模板,按照本试验中优化好的反应体系和条件进行扩增,发现仅CPDV为模板的反应体系有大小约436 bp左右的条带,其他毒株模板的反应体系以及阴性对照组未见明显条带(图3),表明本试验建立的PCR检测方法具有高特异性。
2.3 敏感性试验
以CPDV DNA为样本,测定OD260nm值,计算模板DNA含量;将CPDV模板DNA进行10倍系列稀释,稀释10个梯度后进行PCR扩增。结果显示,当模板量为1 pg时(第7组)都可以扩增出大小为436 bp的目的片段(图4)。
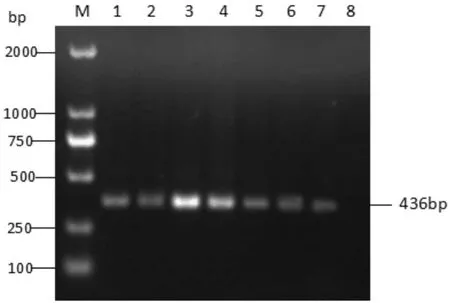
图1 PCR反应退火温度梯度优化
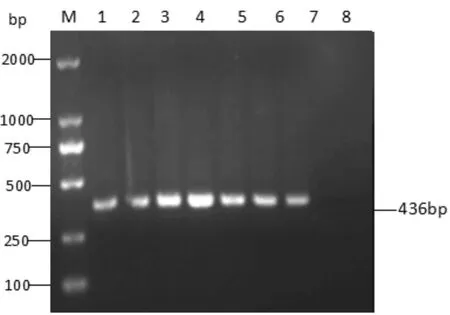
图2 PCR反应引物优化
2.4 临床样品检测
对从新疆维吾尔自治区南疆地区部分区域收集到的48份临床发病羊疑似病料进行PCR检测,发现45份显示为CPDV阳性(图5),检出率为93.8%,说明该地区CPDV感染率较高,表明本试验建立的方法可以对临床样本进行快速、准确检测。

M. DL2000 DNA marker;1. 已知的CPDV样品;2. 采集的疑似发病羊病料;3. 羊痘病毒;4. 口蹄疫病毒;5.小反刍兽疫病毒;6.蓝舌病病毒;7. 健康羊组织;8. 阴性对照

图4 PCR方法灵敏度
3 讨论
传染性口疮病是羊群中的常见疫病之一,在大部分养羊国家曾发生过,在我国西北地区,尤其是新疆维吾尔自治区、内蒙古自治区等养羊大省十分常见。该病在无继发感染情况下,死亡率一般较低,但发病率较高,容易在羊群中流行。该病的流行会使羊群繁殖性能受到影响,造成巨大经济损失。传染性口疮病的发病症状与羊口蹄疫、羊痘相类似,容易混淆而造成误诊[6]。

图5 临床样品检测
近年来,新疆维吾尔自治区的羊养殖规模不断扩大,但主要以散户、小型养殖户为主,大型规模化养殖场较少。在放牧过程中,羊容易被草料划伤唇部皮肤,并且小型羊场卫生条件较差,防疫措施较落后,户主又缺乏专业知识,因而容易将传染性口疮病与其他一些疾病,如口蹄疫、羊痘等混淆而造成误诊。对于轻微症状的羊如果不重视,疏于管理,就容易造成羊口疮反复发作,给养殖场带来巨大经济损失。因此,在羊养殖过程中,一定要做好羊口疮防控工作。首先养殖户主要足够重视,对于症状轻微羊只,既要细心照料,加强护理,又要改善羊舍环境卫生,保持羊舍清洁,及时清理羊舍粪便和其他异物,还要做好通风工作[7-8];要做好疫苗预防,定期对羊群进行CPDV检测,不从发生过该病的疫区引种,从源头上杜绝羊口疮的传播与流行。
4 结论
本研究参考相关文献,对退火温度和引物浓度进行了优化,确定了最佳反应条件,通过对羊痘病毒、口蹄疫病毒、蓝舌病病毒、小反刍兽疫病毒,以及空白对照的扩增,表明建立的PCR检测方法具有较高的特异性。敏感性试验表明,样品DNA含量只有1 pg时,仍能扩增出特异性目的条带,说明该PCR检测方法具有较高的敏感性。
本试验建立的PCR试验方法只需提取病料中的DNA,利用所设计的特异性引物进行扩增,就可以扩增到相应的目的片段,具有高效、快速、特异性强等优点。用本试验所建立的PCR检测方法对临床采集样品进行检测,能够迅速检测出阳性样品,说明本试验建立的PCR检测方法适用于羊传染性脓疱的临床检测,对于新疆维吾尔自治区南疆地区羊CPDV感染的确诊和防控有重要意义。
[1] YU Y Z,WU Z J,ZHU Z B,et al. Molecular characteristics and immune evasion strategies of ORFV:a review[J]. Chinese journal of virology,2012,28(3):278-284.
[2] 秦文娟. 羊传染性脓疱病的流行病学,临床症状,诊断及防控[J]. 现代畜牧科技,2017(3):151-151.
[3] 陈小丽. 羊传染性脓疱病毒 PCR 检测方法的建立与初步应用[J]. 福建畜牧兽医,2015,37(1):13-15.
[4] 李慧霞,朱学亮,骆学农. 羊口疮病的研究进展[J]. 中国预防兽医学报,2013,35(5):426-430.
[5] 林裕胜,江锦秀 林甦,等. 羊传染性脓疱病毒研究进展[J]. 动物医学进展,2016,37(2):91-96.
[6] 马超锋,余洪涛,彭燕,等. 副猪嗜血杆菌 PCR 检测方法的建立与应用[J]. 畜牧与兽医,2017(2):89-93.
[7] 涂明亮,张志丹,安维雪,等. 羊口疮的实验室诊断及防控措施[J]. 畜牧与饲料科学,2014,35(12):97-99.
[8] 郭良兴,赵魁,赵广海,等. 吉林省2006—2010 年羊传染性脓疱病的流行病学调查及分析[J]. 中国兽医学报,2011,31(11):1623-1626.

