CDX2、NF-κB和MUC2在Barrett食管中的表达及意义
蒋 丽 张桂英
(1 湖南省长沙市第四医院消化内科,长沙市 410006;2 中南大学湘雅医院消化内科,长沙市 410008)
Barrett食管(Barrett′s esophagus,BE),即肠上皮化生(Intestinal metaplasia,IM)是食管腺癌(esophagial adenocarcinoma,EAC)的唯一癌前病变[1-2],文献报道行二级预防可有效阻断其向EAC发展[3]。诊断该病根据内镜表现和活检确诊;治疗不难,为氩离子凝固术(APC)和冷冻治疗术。但要做到早诊早治、尤其是在基层医院内镜医生经验欠缺、活检阳性率不高的情况下要做到这一点有一定难度。内镜窄带成像技术(narrow band imaging,NBI)无须染色可增强黏膜对比度,发现普通白光内镜下不明显的病灶,行靶向活检,可提高诊断率。本研究比较普通内镜及NBI模式下BE并IM检出率差异,对比正常食管黏膜、BE和EAC中肠化相关指标尾型同源框转录因子-2(Caudal Type Homeo Box Transcription Factor 2,CDX2)、核因子-κB(Nuclear Factor-Kappa B,NF-κB)、粘蛋白-2(Mucin 2,MUC2)阳性率,探讨BE并IM对EAC的发生、发展所起的作用。
1 资料与方法
1.1 对比普通白光内镜活检和NBI模式下靶向活检实验部分研究对象 筛选2016年1月至2016年8月长沙市第四医院胃镜下发现胃食管交界近端出现橘红色柱状上皮的患者76例,随机对照均分为普通内镜组[男24例,女14例,年龄(51.9±9.2)岁]和NBI组[男22例,女16例,年龄(49.6±8.7)岁],两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。由2名经验丰富的胃镜医师观察,进镜后按照普通内镜-NBI模式的顺序进行观察,诊断一致才能入选。
1.2 检测正常食管黏膜、BE和EAC中肠化相关指标实验部分研究对象 病例入选标准:①BE组:NBI发现食管远端有明显的柱状上皮化生并经病检证实。②EAC组:病理诊断为食管腺癌,且病灶位于齿状线上方,未行放化疗及免疫治疗。③正常食管黏膜组:无胸痛、反酸等临床表现,胃镜示食管黏膜正常,胃和十二指肠黏膜正常或仅有轻度炎症。排除标准:①合并消化道严重疾病,如食管胃底静脉曲张、消化性溃疡、幽门梗阻、内镜下活动性出血;②有食管、胃手术史(单纯穿孔缝合除外);③合并其他系统严重疾病,如严重心、肺、肝、肾疾病,其他系统晚期肿瘤、血液和造血系统疾病;④孕妇、哺乳妇女。选择2016年8月至2017年5月符合入选标准的BE患者30例,男17例,女13例,年龄(51.9±9.2)岁;另收集EAC患者30例,男18例,女12例,年龄(53.6±8.4)岁,及同期正常食管黏膜30例,男15例,女15例,年龄(48.8±7.5)岁。三组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。胃镜+NBI图像均由2名经验丰富的胃镜医师观察,诊断一致才能入选。
1.3 研究方法
1.3.1 胃镜检查与病检 将胃镜(型号为Olympus,CV-260SL)置于食管下端鳞-柱状上皮交界处,切换至NBI模式筛选,进行靶向活检。BE组及EAC组沿病变长轴四象限活检取材;正常黏膜组在食管近齿状线端四象限活检取材,均取4块标本,10%甲醛固定,石蜡包埋,连续切片,行HE染色及免疫组织化学染色。
1.3.2 免疫组织化学检测CDX2、NF-κB、MUC2表达 采用SP法行免疫组织化学染色,浓缩型鼠抗人CDX2、NF-κB(p65)、MUC2单克隆抗体及免疫组化SP试剂盒均购自北京中杉金桥生物技术有限公司。CDX2蛋白阳性位于胞核内[4-7],NF-κB(p65)蛋白阳性位于胞浆和胞核内,MUC2蛋白阳性位于胞浆内,均呈棕黄色颗粒状染色。高倍镜(10×40)下随机取5个视野,判定标准[8]:阳性细胞百分比计数≤10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。染色强度评分:无染色为0分,淡染色为1分,棕黄色为2分,棕褐色为3分。以两项积分和<3分为阴性,≥3分为阳性。
1.4 统计学方法 所有数据采用SPSS 22.0统计学软件包进行分析,计量数据以(x±s)表示,多组间计量数据比较用方差分析;计数资料用百分率(%)表示,组间比较采用χ2检验以及Spearman秩相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 普通内镜及NBI模式下活检BE并IM检出率比较 NBI组BE并IM的检出率为65.8%(25/38),显著高于普通内镜的34.2%(13/38),差异有统计学意义(χ2=7.579,P=0.006)。见图1。
2.2 CDX2、NF-κB及MUC2的阳性率比较 三组间CDX2、NF-κB及MUC2阳性率比较,差异均有统计学意义(P<0.05)。BE组、EAC组CDX2、NF-κB及MUC2阳性率均高于正常组,差异有统计学意义(P<0.05);BE组与EAC组CDX2、NF-κB及MUC2阳性率比较,差异无统计学意义(P>0.05)。见表1及图2~图4。
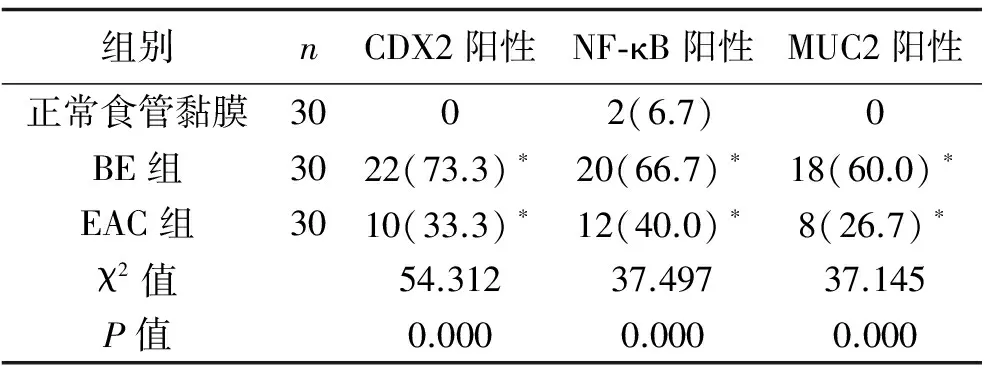
表1 CDX2、NF-κB及MUC2阳性率比较 [n(%)]
注:与正常食管黏膜组比较,*P<0.05。
2.3 Spearman秩相关分析 CDX2阳性率与NF-κB、MUC2阳性率呈正相关,r值分别为0.869、0.820。
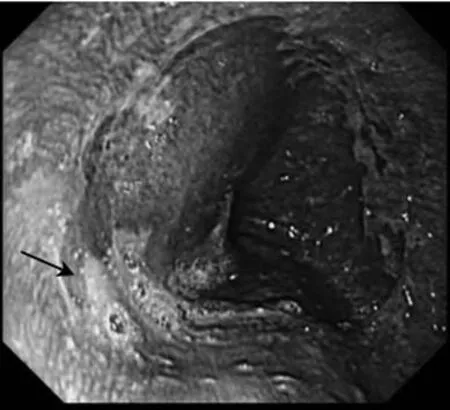
图1 NBI模式下可疑BE并IM
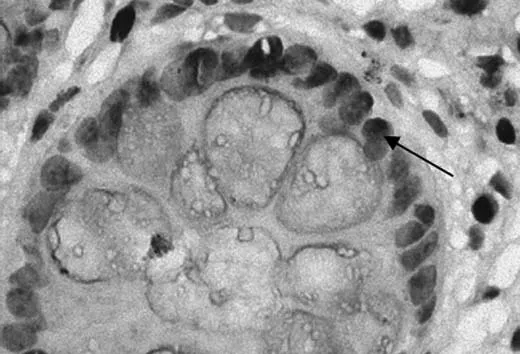
图2 BE中CDX2表达(免疫组化染色×400)
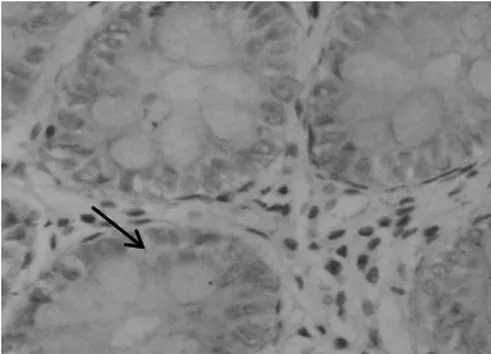
图3 BE中NF-κB(p65)表达(免疫组化染色×400)
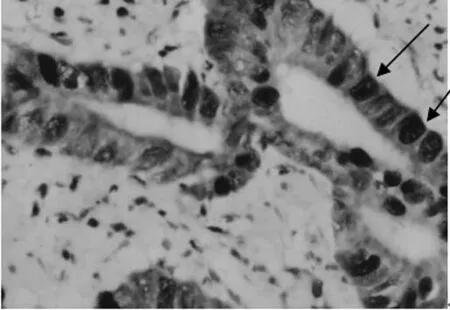
图4 BE中MUC2表达(免疫组化染色×400)
3 讨 论
NBI采用窄带滤光器过滤掉内镜光源的宽带光谱,仅留下红、绿、蓝色窄带光波,其穿透胃肠道黏膜的深度不同,能增加黏膜上皮与其下血管的对比度和清晰度[9]。因具有黏膜染色功效,应用时仅需按键切换,无须喷洒染色剂,被称为电子染色内镜。NBI照射到食管黏膜肠化上皮顶端可产生淡蓝色冠,根据这一特点识别肠化区域,虽不能取代组织学检查,但能预测组织学特征,极大地提高了BE合并IM的检出率。本研究结果显示,NBI能有效提高BE合并IM的检出率,且操作简单,只需一键切换,可随时观察,无色素内镜的并发症。
目前认为BE合并IM为EAC的唯一癌前病变。IM在组织学上类似于肠黏膜,表面有绒毛和腺窝,由柱状细胞和杯状细胞组成。已发现相关肠化病理指标,但具体致病机制不详。有研究[10-12]显示CDX2特异表达于整个肠道绒毛上皮细胞核内,在正常食管和胃黏膜上皮中不表达,除消化系统外,其他系统正常上皮内亦检测不到CDX2。CDX2起着调节肠道上皮正常增殖和分化的作用,其异位表达有可能促成癌前病变甚至肿瘤的发生、发展;也是肠化生的始动因素之一,有较高的敏感性,有助于判断早期肠化的发生。实验中发现CDX2在正常食管黏膜中无表达,在BE中阳性表达率明显增高,提示CDX2在BE肠化中起重要作用。BE组CDX2阳性率与EAC组比较,差异无统计学意义,提示两者“一脉相承”,但在EAC中阳性率低于BE,提示在EAC因异型细胞缺乏分化,肠型上皮表型不能维持,CDX2表达降低。据报道在食管黏膜中由于酸性环境、肿瘤坏死因子和白细胞介素等经转录核因子(NF-κB)信号系统作用激活CDX2启动子,并促进其去甲基化诱导CDX2表达,CDX2的上调促进了BE及EAC的发生。研究发现NF-κB在正常黏膜、BE中表达依次增加,仅在腺癌中表达稍有下降,提示BE、EAC的发生是一个炎症的累积过程,随着炎症的加重,NF-κB的表达增加,而在恶变组织中表达下降同样考虑因细胞缺乏分化,表型不能维持,表达相应下降。
杯状细胞是肠黏膜上皮的特征性细胞,MUC2是其分泌的粘蛋白,肠化以杯状细胞MUC2高强度表达为特征[13]。MUC2蛋白在正常食管黏膜内不表达,在肠化的食管黏膜内丰富表达,提示MUC2蛋白异常表达可作为肠化的标志。Tamagawa等[14]研究发现,转染CDX2的食管上皮细胞通过CDX2蛋白表达上调MUC2的表达水平,应用RT-PCR及EMSA的方法检测到CDX2可特异性结合于MUC2基因启动子MUC2-wT顺式作用元件(bases-201到-162),激活MUC2的转录从而显著提高其表达水平。本研究结果显示BE和EAC组织中CDX2和MUC2的表达模式相似,支持在BE至EAC的演变中CDX2对MUC2的表达起一定调节作用的观点。CDX2与NF-κB及MUC2的阳性率呈正相关,支持这三者具有相关性,根据已知作用机制,笔者考虑NF-κB、CDX2及MUC2可能序贯激活,在BE-EAC渐进发展中起重要作用。
综上所述,在NBI模式下检测BE中CDX2、NF-κB及MUC2的阳性率,对于早期认识和评价肠化生具有较高价值,为早期诊断BE并IM,早期治疗,从而有效阻断后续的EAC进展提供帮助。
[1] 中华医学会病理学分会消化疾病学组筹备组,胃食管反流病、Barrett 食管和食管胃交界腺癌病理诊断共识[J].中华病理学杂志,2017,46(2):79-83.
[2] Amadi C, Gatenby P. Barrett′s oesophagus: Current controversies[J]. World J Gastroenterol,2017,23(28):5051-5067.
[3] Krishnadath KK, Wang KK.Molecular pathogenesis of Barrett esophagus: current evidence[J].Gastroenterol Clin North Am, 2015,44(2):233-47.
[4] 秦娟文,彭卓嵛,樊梅芳,等.不同内镜下活检方法对Barrett食管活检阳性率比较[J].现代医药卫生,2016,32(2):164-166.
[5] 李应杰.内镜下氩离子凝固术联合乌梅汤加减方治疗Barrett食管临床观察[J].陕西中医,2017,38(5):556-557.
[6] 杨世英,余 捷,王梓桦,等.Barrett食管冷冻治疗的研究进展[J].中华消化内镜杂志,2017,34(5):378-380.
[7] Han S,Wani S. Quality Indicators in Endoscopic Ablation for Barrett′s Esophagus[J].Curr Treat Options Gastroenterol,2017,15(2):241-255.
[8] 张 云.内镜窄带成像技术与Lugol液染色诊断Barrett食管的对比研究[J].国际消化病杂志,2017,37(2):114-116,134.
[9] Watanabe G, Ajioka Y, Takeuchi M, et al. Intestinal metaplasia in Barrett's oesophagus may be an epiphenomenon rather than a preneoplastic condition, and CDX2-positive cardiac-type epithelium is associated with minute Barrett's tumour[J]. Histopathology,2015,66(2):201-214.
[10] 黄川锋,刘安丽,贺 生,等.Barret食管组织p53、COX-2基因表达与TNF-α、NF-κB水平的关系[J].社区医学杂志,2017,15(14):16-18.
[11] 赵晓志,胡继春,庆琳琳.肠化生黏膜微细结构与肠化亚型及CDX2、MUC2、MUC5AC异常表达的关系[J].海南医学,2016,27(1):79-81.
[12] 杨建杰,张玉林.COX2、CDX2在糜烂性食管炎、Barrate食管及食管腺癌中的表达及意义[J].检验医学与临床,2017,14(11):1621-1623.
[13] Zhang X, Westerhoff M, Hart J.Expression of SOX9 and CDX2 in nongoblet columnar-lined esophagus predicts the detection of Barrett′s esophagus during follow-up[J].Mod Pathol,2015,28(5):654-661.
[14] Tamagawa Y, Ishimura N, Uno G, et al. Bile acids induce Delta-like 1 expression via Cdx2-dependent pathway in the development of Barrett′s esophagus[J].Lab Invest,2016,96(3):325-337.

