长江下游狼山沙和新开沙水域渔业资源群落结构特征分析
汪雷, 徐东坡
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院淡水渔业研究中心,江苏无锡214081)
中华绒螯蟹Eriocheir sinensis隶属于节肢动物门Arthropoda、甲壳纲 Crustacca、十足目 Decapoda、方蟹科 Grapisidae、绒螯蟹属 Eriocheir[1],俗称河蟹、大闸蟹等。中华绒螯蟹在中国分布较为广泛[2-3],以长江水系中华绒螯蟹品质最优、经济价值较高。但近年来受水环境恶化[4]、生境破碎化、捕捞强度高[5],以及涉水工程、航运等多方面影响,导致中华绒螯蟹资源量衰退和栖息地被破坏。
渔业资源群落结构是指在一定时间和地理区域内,生活在同一环境下具有相互联系的不同渔业生物种群的集合体[6]。通过对渔业资源群落结构的研究,可以反映部分水生生态系统健康状况,可为修复水生生态系统提供理论依据,也可作为各种生态修复方法与效果的衡量标尺。目前,针对长江下游渔业资源群落结构的研究主要集中在描述多样性指数时间序列上的差异[7-8],而此类研究并未涉及生境。对中华绒螯蟹栖息地研究也仅见长江口抱卵蟹栖息地的评估[9];长江下游沙洲众多,是中华绒螯蟹幼蟹索饵栖息的重要场所,渔业资源群落特征是中华绒螯蟹幼蟹栖息地的生物环境要素之一,对其开展研究,有助于科学评估幼蟹栖息地的质量,为中华绒螯蟹栖息地研究提供基础资料,进而为保护中华绒螯蟹资源提供科学依据。
1 材料与方法
1.1 研究区域概况
本试验中,选取长江下游的狼山沙和新开沙水域为研究区域,该水域靠近长江入海口,属于河口区域,受长江径流和潮汐双重影响,每日有2次逆水期,水环境流态复杂。两沙洲位于通州沙下游,受通州沙水道影响,狼山沙历史位置不断下移和西偏,沙尾受徐六径节点的控制下移趋势减小[10]。两沙洲上水生植物植被丰盛,是中华绒螯蟹及刀鲚、鳗鲡等重要鱼类索饵的理想场所[11]。
本研究中根据不同生境类型设置6个采样站位(图1),狼山沙设4个站点 (L-1、L-2、L-3、L-4),新开沙设2个站点 (X-1、X-2)。狼山沙呈D型,新开沙为狭长的I型,两沙洲在夏季丰水期涨潮时水深达2~3 m,退潮时沙洲水生植物均露出水面,冬季水生植物枯萎,枯水期水位消退,沙洲露出水面时间变长。
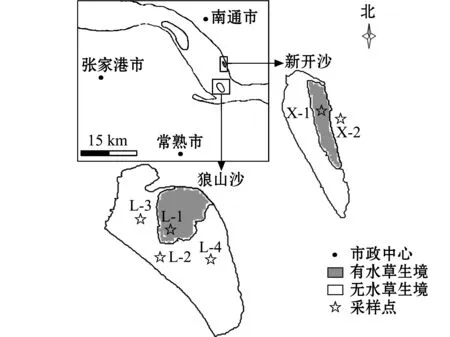
图1 两沙洲站点图Fig.1 Sampling sites in Langshansha and Xinkaisha
1.2 方法
1.2.1 样本的采集 于2016年6月—2017年1月(新开沙始于2016年7月),每月在各站点放置10条以上定制网具,网具长为990 cm、宽为27 cm、高为23 cm、网目为11 mm,网具放置时间为2 d。在放置定制网具的水域,使用便携式 (Mettler FG2-FK)仪器测量水温;渔获物带回实验室查阅相关资料鉴定到种,并记录所有鱼类的全长、体长与体质量。其中,全长和体长精确到0.1 mm,体质量精确到0.1 g。
1.2.2 相关指数的选用及计算[12-14]Margalef指数 (R),反映群落物种丰富度;Wilhm改进指数(H″),基于物种生物量反映群落种类多样性;Shannon-Wiener指数 (H′),基于物种数量反映群落种类多样性;Pielou指数 (J),反映群落均匀度;McNaughton指数 (DN,DW),反映群落物种优势度;Pinkas相对重要性指数 (IRI),反映群落均匀度。各指数计算公式为
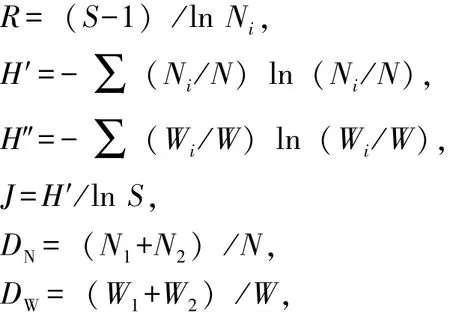
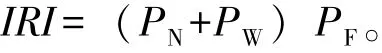
其中:S为群落中所有物种种类数;N为群落中物种的总数量;Ni为第i个物种数量;W为群落中物种总质量 (g);Wi为第i个物种的质量 (g);N1、N2分别为群落中数量排序居于第一、二位的物种数量;W1、W2分别为群落中质量排序居于第一、二位的物种质量 (g);PN为某一种类的数量占总数量的百分比;PW为某一种类的质量占总质量的百分比;PF为某一种类在捕捞中出现的次数占总捕捞次数的百分比;IRI>1000为优势种,IRI=100~1000为重要种[15]。
1.2.3 优势种渔获质量与水温因子的相关分析
水温因子以月为单位取各站点的平均值,然后通过ln(X+1)转换;优势种渔获物质量按月统计,通过PAST计算每月多样性指数,之后用SPSS 19.0软件对上述优势种渔获质量、水温因子和多样性指数进行Pearson相关分析;多样性指数季节间变动通过Excel软件进行绘制。
1.2.4 群落结构分析 根据渔获物情况,构建各站点与各种类数量矩阵,对各物种的数量进行4次方根转换后计算Bray-Curtis相似性系数,进行聚类分析和非参数多维尺度分析 (Non-Metric Multidimensional Scaling,NMDS);以上分析采用Primer 5生态学数据处理软件进行。
1.3 数据处理
采用SPSS 19.0软件的单因素方差分析(One-way ANOVA)对试验数据进行显著性检验。
2 结果与分析
2.1 两沙洲生境概况及渔获物物种组成
本研究中对两沙洲进行初步调查,各站点生境类型区分较明显 (表1),除了草滩生境有水生植物外,其他站点均无水生植物,两处草滩生境类似,其中,狼山沙滩头与新开沙滩坡生境类似,狼山沙滩坡底质泥沙参半,滩尾和草滩底质类似。
本研究中共采集37种渔获物,已鉴定渔业生物36种,隶属于8目16科 (表2),其中,鲤形目种类最多,共有2科15种;狼山沙共捕获34种(已鉴定33种),新开沙共捕获26种;狼山沙渔获物数量占比前三的分别是日本沼虾Macrobrachium nipponense(39.04%)、中华绒螯蟹 (21.41%)和光泽黄颡鱼Pelteobaggrus nitidus(12.53%),渔获质量占比前三的分别是中华绒螯蟹 (39.68%)、中国花鲈Lateolabrax maculatus(18.0%)和无齿螳臂相手蟹Chiromantes dehaani(10.37%);新开沙渔获物数量占比前三的分别是无齿螳臂相手蟹(28.88%)、中华绒螯蟹 (26.32%)和日本沼虾(25.63%),渔获质量占比前三的分别是无齿螳臂相手蟹 (42.42%)、中华绒螯蟹 (38.02%)和日本沼虾 (5.02%)。
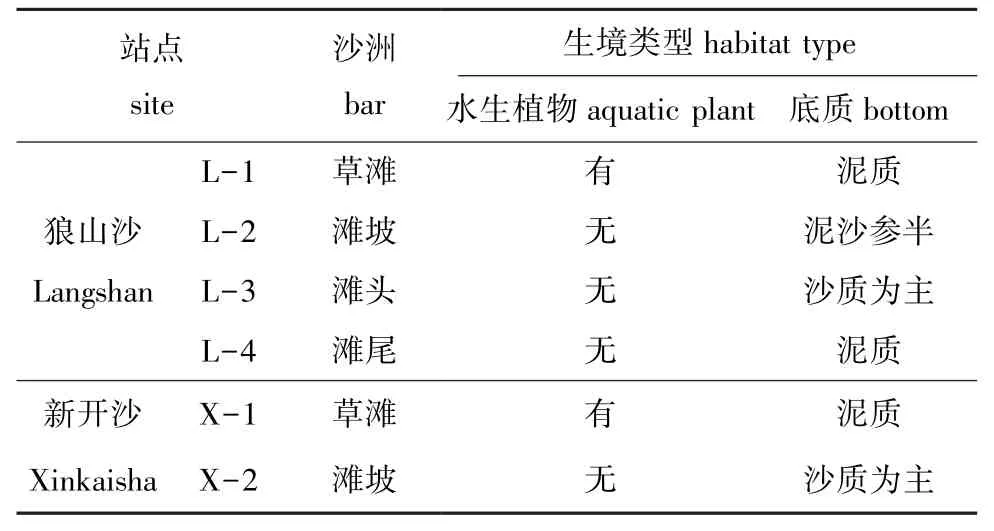
表1 两沙洲生境概况Tab.1 Habitat survey in Langshansha and Xinkaisha
2.2 两沙洲的渔获物生态类型
两沙洲渔获物 (已鉴定种类)从垂直分布上看,均以底层 (中华绒螯蟹、日本沼虾)和中下层 (光泽黄颡鱼)渔业生物为主 (图2),中上层(兴凯鱊、)仅1~2种。从食性来看,杂食性(中华绒螯蟹、棒花鱼)占比最多,植食性 (鳊)和浮游食性 (似鳊)最少;洄游型鱼类 (暗纹东方鲀、日本鳗鲡)占比较少,定居型 (黄颡属、鰕虎鱼科等)鱼类较多,半洄游型 (青鱼)出现次数较少,两沙洲渔获物生态类型组成大体相似。
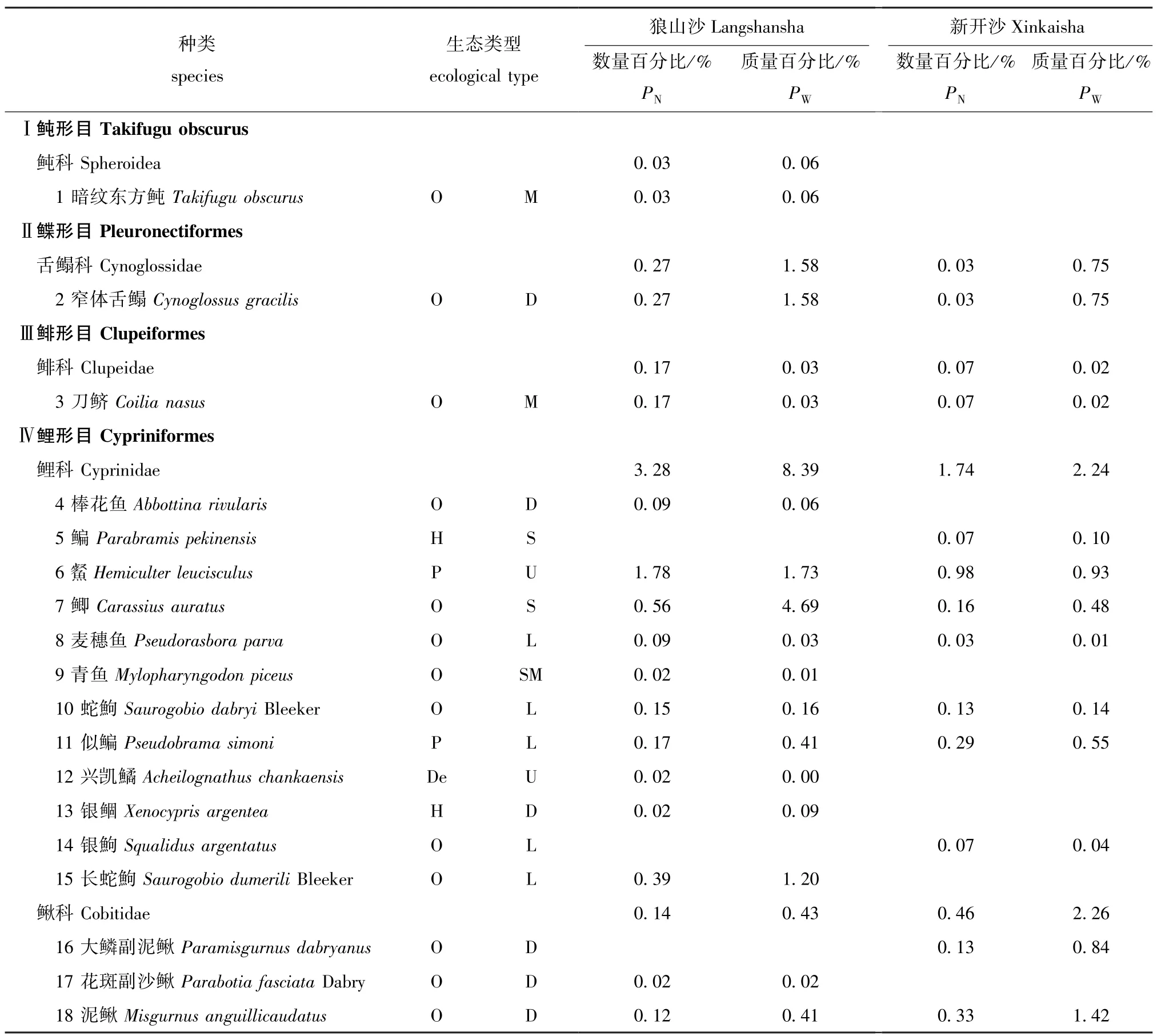
表2 两沙洲渔业资源种类组成、生态类型及所占比例Tab.2 Species composition,ecological guilds and percent in fisheries resources in Langshansha and Xinkaisha
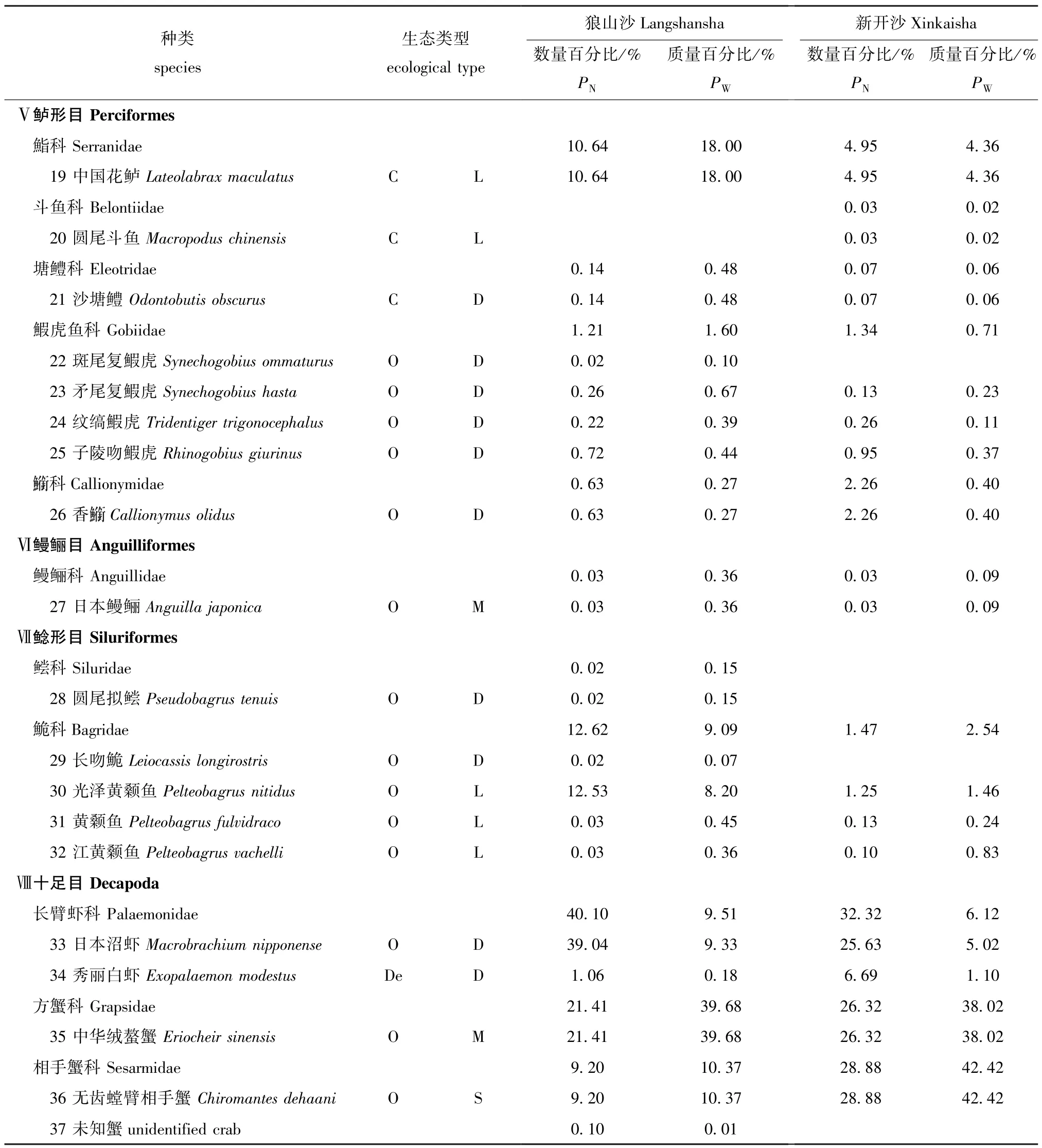
续表2 两沙洲渔业资源种类组成、生态类型和百分比Cont.Tab.2 Species composition,ecological guilds and percent in fisheries resources in Langshansha and Xinkaisha
2.3 两沙洲的渔获物优势种
从表3可见,两沙洲优势种有5种,分别是中华绒螯蟹、日本沼虾、无齿螳臂相手蟹、中国花鲈和光泽黄颡鱼。从表4可见:狼山沙草滩的中华绒螯蟹和无齿螳臂相手蟹数量和质量占比较其他站点高,而日本沼虾在滩坡、滩头和滩尾的数量和质量占比均高于草滩处;新开沙草滩渔获物大半为中华绒螯蟹和无齿螳臂相手蟹,而其他物种出现较少;无水生植物站点的日本沼虾数量占比较高。
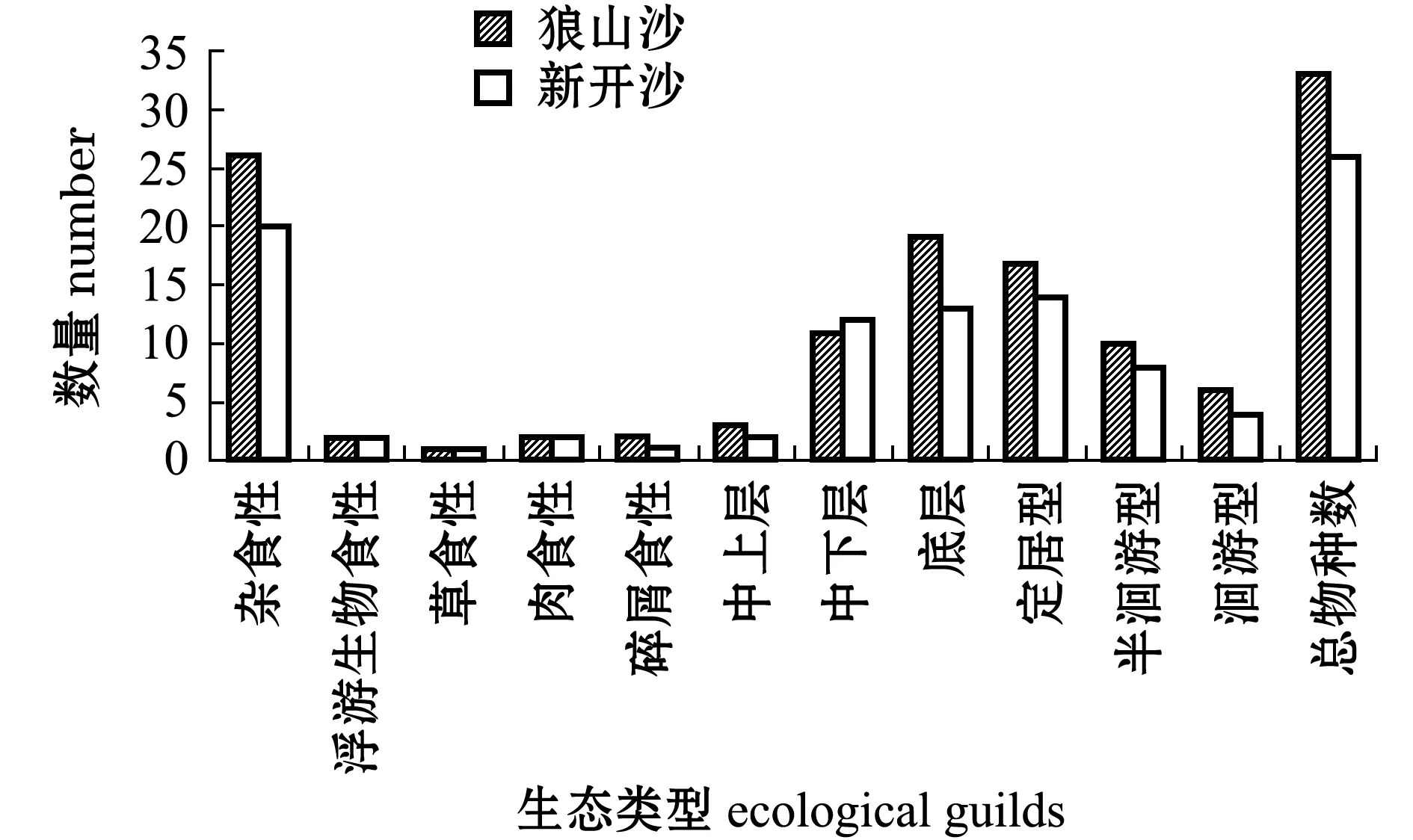
图2 两沙洲各生态类型渔获物种对比图Fig.2 Comparison of different ecological guilds in Langshansha and Xinkaisha
2.4 两沙洲渔获物群落多样性指数
两沙洲不同生境多样性指数见表5,其中,有水生植物站点的Shannon-Wiener指数、Pielou指数和Wilhm改进指数均显著低于无水生植物站点(P<0.05),有水生植物站点的Margalef指数低于无水生植物站点,但不显著 (P>0.05),有水生植物站点的McNaughton指数均高于无水生植物站点,其中基于物种体质量计算的群落物种优势度显著高于无水生植物站点 (P<0.05)。
两沙洲草滩处 (除狼山沙夏季草滩外)物种丰富度Margalef指数 (图3)均较低,其他站点丰富度指数在夏、秋季节较高,冬季新开沙滩坡处达到最大值;两沙洲草滩处群落均匀度Pielou指数不高,其他站点 (除狼山沙秋季滩尾外)均匀度指数较高;种类多样性Wilhm指数变化基本与物种丰富度指数相似;两沙洲草滩群落物种优势度Mc-Naughton(DW)均较高,新开沙滩坡每个季节均最低。说明有水生植物生境站点捕获的渔业生物种类比无水生植物站点少,但其中绝对优势种捕获数量和质量都占较高比例。
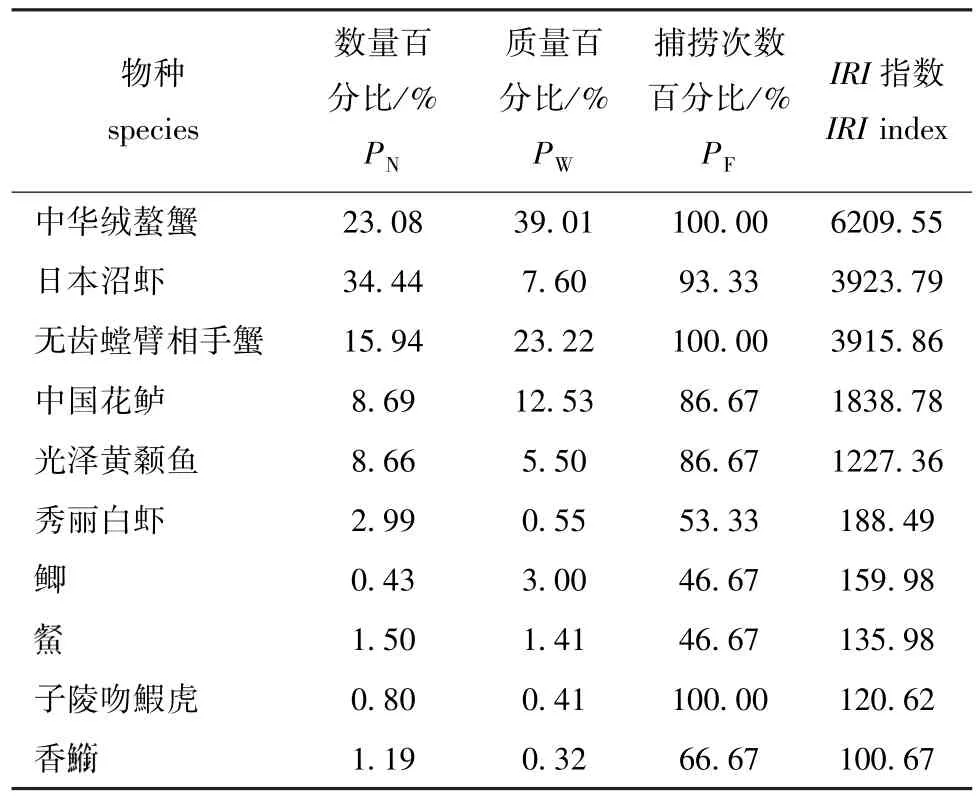
表3 部分渔业生物IRI值及其参数Tab.3 Relative importance indices and parameters in some fisheries
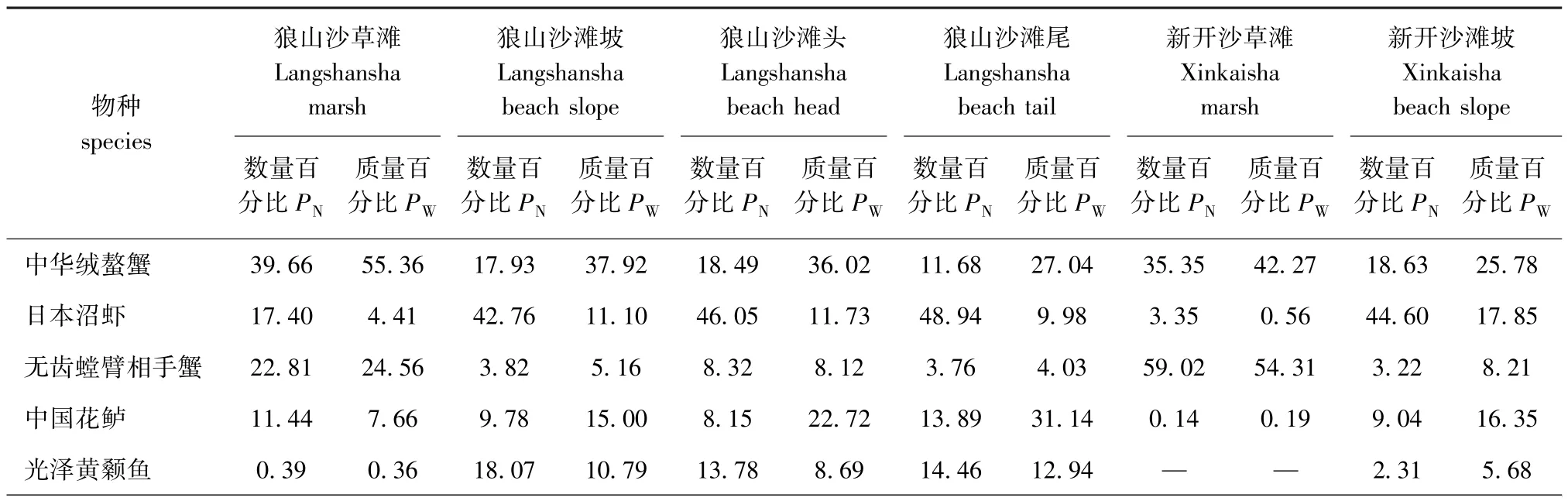
表4 两沙洲各站点优势种数量和生物量捕捞占比例Tab.4 Number of dominant species and the proportion of biomass catches in each site of Langshansha and Xinkaisha%
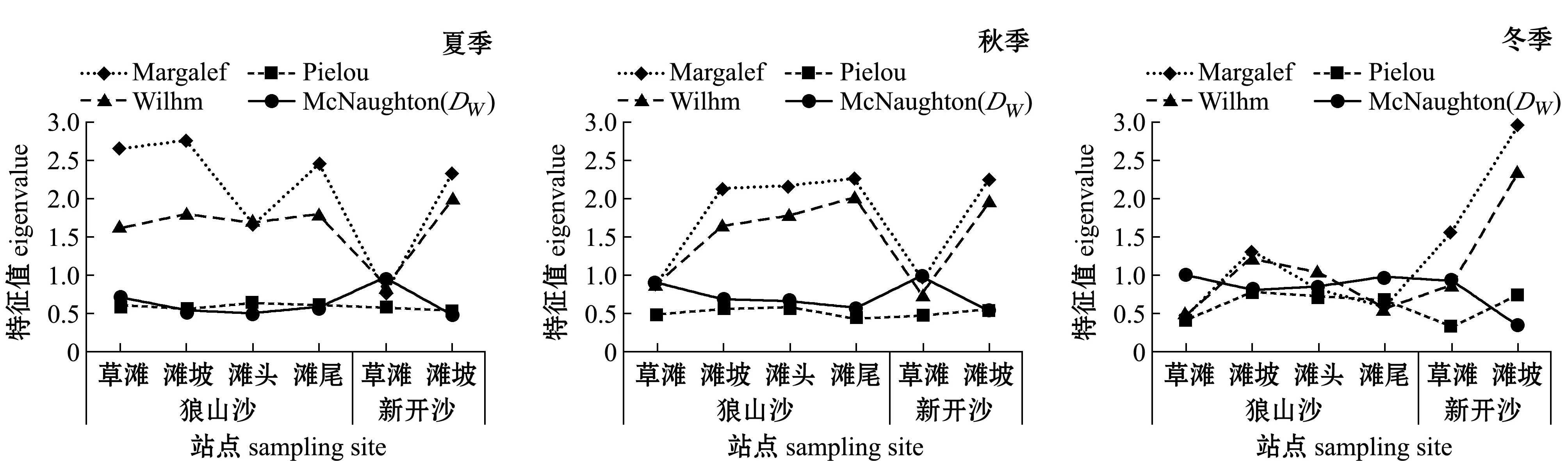
图3 两沙洲渔业生物群落结构多样性指数随季节变动图Fig.3 Variation in fisheries community biodiversity index with season in Langshansha and Xinkaisha
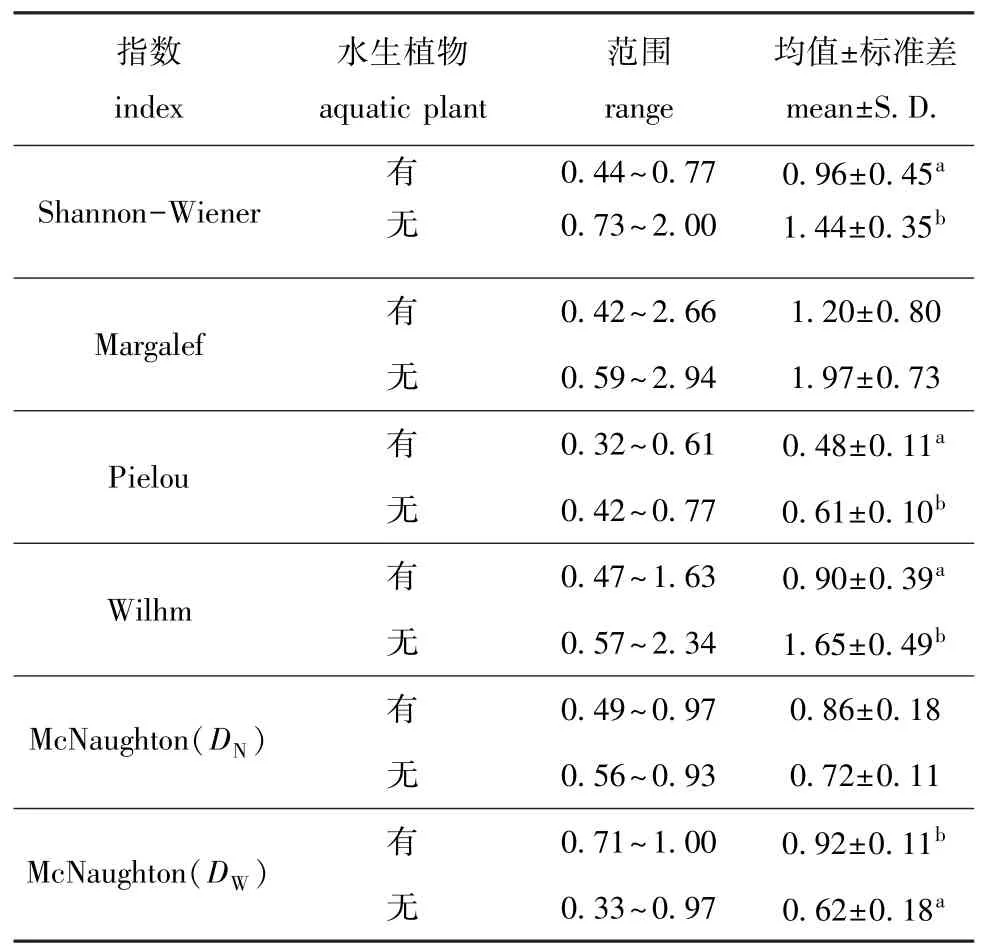
表5 两沙洲不同生境渔业生物群落结构多样性Tab.5 Diversity indices of fisheries in Langshansha and Xinkaisha
相关分析结果表明 (表6):物种丰富度指数与中华绒螯蟹捕获质量呈负相关;群落均匀度指数与水温呈正相关,与无齿螳臂相手蟹捕获质量呈负相关;种类多样性指数与水温、中国花鲈捕获量呈正相关,与光泽黄颡鱼与日本沼虾捕获量呈显著正相关 (P<0.05),与无齿螳臂相手蟹和中华绒螯蟹捕获量呈负相关;物种优势度指数与水温呈负相关。
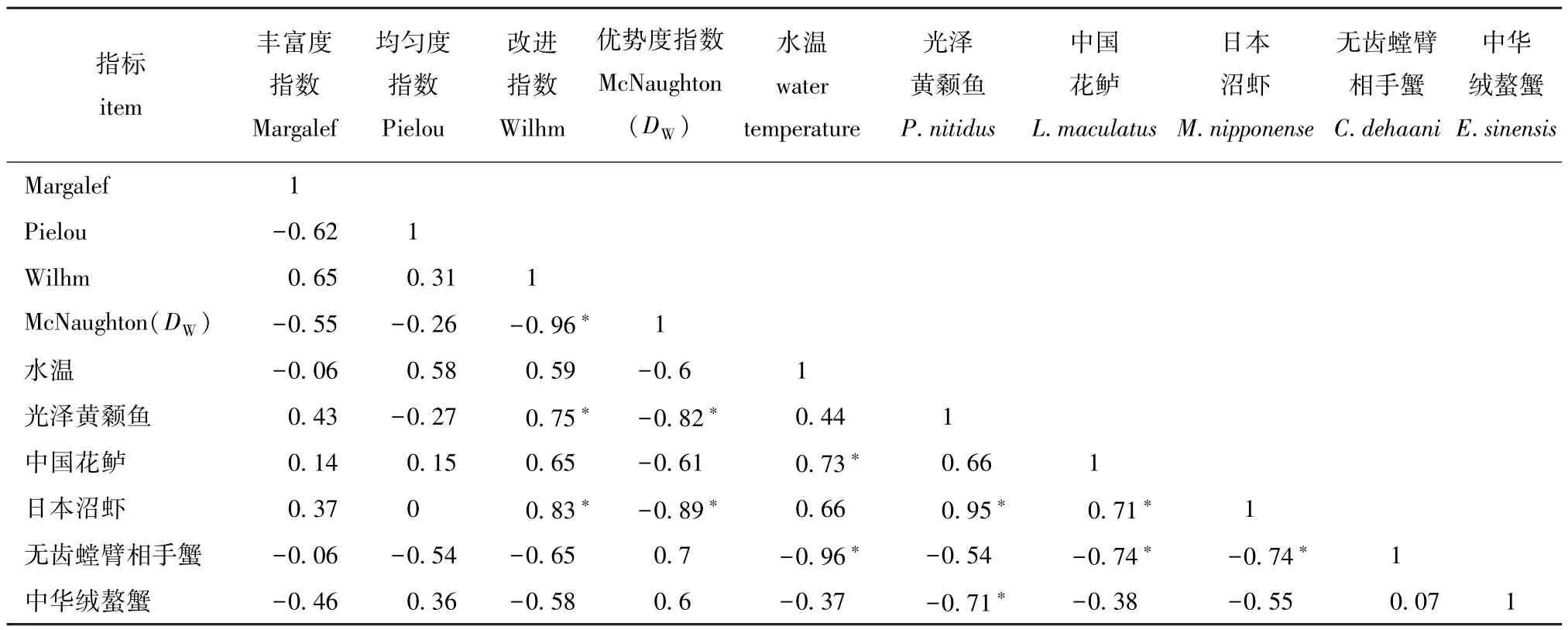
表6 优势种渔获质量、多样性指数与水温因子的Pearson相关性系数Tab.6 Pearson correlation among catch biomass of dominant species,diversity index and water-temperature
2.5 两沙洲渔业生物群落结构时空对比
两沙洲渔业生物群落结构在相似度为52.17时分为3大类 (图4),其特征及成因如下:
类别Ⅰ:该类别以冬季为主,包含了狼山沙冬季的滩坡、滩头和滩尾3个站点;渔获物种类较少,各站点渔获物种数为3~6种,该类别未捕获的绝对优势种有两种,分别为中国花鲈和无齿螳臂相手蟹;各物种捕获数量均较低,其中中华绒螯蟹捕获数量平均每网2只。
类别Ⅱ:该类别的基本特征是每个站点有水生植物;各站点渔获物物种数为3~11种;该类别有一个站点捕获到光泽黄颡鱼,两个站点捕获到中国花鲈,中华绒螯蟹和无齿螳臂相手蟹捕获量均高于其他站点,中国花鲈和日本沼虾捕获数量与质量均低于类别Ⅲ。
类别Ⅲ:该类别的主要特征是渔获种类多,且各种类分布较为均匀;各站点捕获种类均超过12种,最高为20种;除新开沙冬季滩坡未捕获到中华绒螯蟹外,5种优势种在其他站点均有捕获。
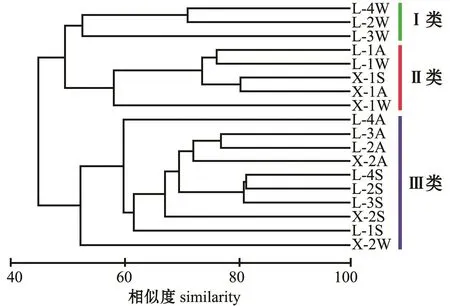
图4 两沙洲渔获生物群落结构聚类图Fig.4 Cluster analysis of fisheries community structure in Langshansha and Xinkaisha
非参数多维尺度分析 (图5)与聚类分析结果一致;新开沙冬季滩坡偏离群落类别Ⅲ的中心,渔获物种类较多,达16种,但各种渔获数量较少且接近,均匀度较高,故丰富度指数在该类别中达到最大。
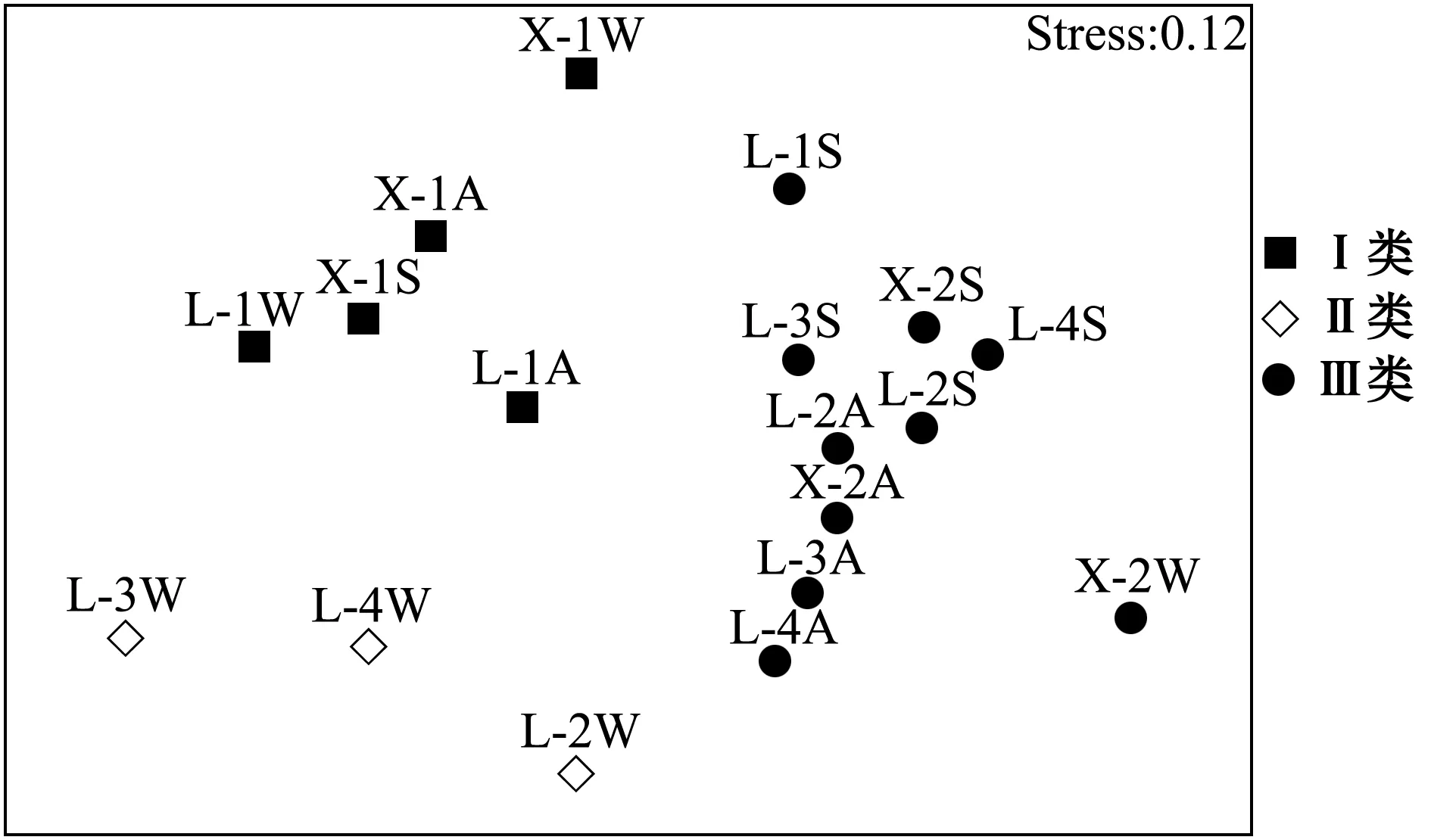
图5 两沙洲渔获生物群落结构NMDS分析图Fig.5 Non-Metric multidimensional scaling of fisheries community structure in Langshansha and Xinkaisha
3 讨论
3.1 渔获生物种类与优势种组成分析
狼山沙和新开沙靠近河口区,该水域营养物质丰富,多数淡水和半咸水鱼类均能在此栖息、繁殖和索饵。张敏莹等[7-8]、徐东坡等[16]在铁黄沙监测共记录了55种,隶属于12目23科,其调查工具为插网,插网能捕获多种类、多规格、多层次的渔业生物,故铁黄沙监测中鲤形目占绝对优势,而本研究中绝对优势种为底层无脊椎动物,大型的中上层鱼类均未捕获,说明不同网具对渔获物会产生重要影响。本研究中定制网具类似地笼网和捕虾网,地笼网具捕捞的多样性指数低于刺网和拖网[17],但更为稳定,渔获物中底层渔业生物远多于中上层。另外,除了网具的高度选择性外,尚有其他因素影响,沙洲的地理位置、水文和生境等也存在差异,铁黄沙处于望虞河与长江交汇处,而本研究中沙洲位于江中心,且沙洲上水生植被丰富。有研究表明,有水生植物覆盖的水域鱼类多样性高于非水生植物覆盖的区域[18-19];这与本研究结果相反,可能与沙洲的独特地理位置有关,两沙洲均受到了潮汛影响。
优势种中,中华绒螯蟹幼蟹和无齿螳臂相手蟹等在水生植物丰盛处索饵、生长发育。有学者发现,鱼类栖息分布有避光行为[20];水生植物可以为甲壳类蜕壳提供安全环境[21]。中国花鲈喜栖息河口咸淡水区,属于半洄游种类[22-23];光泽黄颡鱼[23-24]栖息于缓流且多水生植物的近岸浅水区,营底栖生活,尤喜欢生活在静水或缓流的浅滩处,具腐殖质和淤泥多的地方。优势种的捕获量与优势种的生活习性相一致,优势种和重要种中多见杂食性物种。李忠义等[25]发现,杂食性鱼类不会因食物网结构的变化而被淘汰,可见杂食性鱼类在群落结构中提供重要支撑。
渔获物种类不仅与网具、生境有关,过度捕捞也会直接引起生态系统中物种的捕食与被捕食者关系不匹配,从而造成渔业资源和补充量的关系失衡,渔业资源生物种群退化和数量下降,种群稳定性降低、波动性增大[26];水工程、漏油等也会对渔业种类产生影响[27]。
3.2 渔获生物群落结构及其与生境的关系
物种多样性指数是反映群落特征的重要指标。本研究中,两沙洲夏、秋季的渔业生物物种多样性指数总体高于冬季;有水生植物站点中,物种丰富度指数、种类多样性和群落均匀度总体低于无水生植物站点,仅物种优势度较高。
季节间变动较大的是水温、水位和沙洲水生植物丰盛程度。夏季水温较高,此时处于丰水期,秋季和冬季温度逐渐降低,江水也渐渐转变为枯水期,沙洲上的水生植物于十月左右开始枯萎。水生植物的存在,不仅为草食性鱼类提供饵料,同时也能净化水质[28],影响仔幼鱼的分布[29]。水温是控制鱼类生理、生化和生活史过程的关键非生物因子[30-31],鱼类于冬季减少摄食并进入深水区越冬,洄游性鱼类也多见于夏、秋季。同时,水深也会对渔业生物群落结构产生影响[32],两沙洲草滩水深平均低于滩坡约2 m,水深越浅,其空间容纳量也越小。
聚类和NMDS分析将两沙洲时空群落特征分为3类,有水生植物站点群落结构相似,与多样性指数呈现结果相一致。聚类分析采用一级物种数据,Ulrich等[33]认为,在分析群落结构共存格局时,丰度数据比二元数据更有意义,其提供的信息量更大,因为物种的灭绝、洄游等均为个体水平的行为。刘凯等[34]研究发现,刀鲚捕捞量与潮汛、水温关系密切,低潮期捕捞量显著高于高潮期,研究期间由于天气等因素的影响,未能保证每月在同一潮汛收网,因此,潮汛也可能影响渔获物种类。陈强等[35]研究发现,长江口及邻近水域滩涂大型底栖动物分布和丰富度与调查水域的底质存在一定的关系。综合来说,底质类型、沙洲形态、沙洲的海拔和沙洲水生植物种类数量等因素对渔业资源群落结构均有影响,在以后的调查和分析中应加大重视程度。
综上所述,两沙洲渔业生物种类较少,渔业生物群落结构简单,急需加大保护力度。
3.3 中华绒螯蟹幼蟹栖息地的保护
中华绒螯蟹幼蟹在草滩处占较大比例,说明长江近河口段沙洲水域适宜中华绒螯蟹幼蟹栖息。中华绒螯蟹有些于每年3月左右自河口区向中游水域洄游[36],经过本研究区域,而同属底栖甲壳类的生物如无齿螳臂相手蟹和日本沼虾在本区域也有较高的渔获量,它们与中华绒螯蟹幼蟹之间可能存在竞争关系,是否影响中华绒螯蟹的生存尚须进一步的研究。同时,潮汐、水流、水深等因素同样影响着中华绒螯蟹幼蟹的栖息选择,这些因素与渔业生物群落结构、有无水生植物、底质类型等共同决定着中华绒螯蟹的栖息地质量。
长江中华绒螯蟹幼蟹捕捞开始于20世纪80年代中期,并延续至21世纪初,在此期间天然蟹苗资源被过度捕捞,能够洄游至育肥地的幼蟹极少[37],中华绒螯蟹资源量有萎缩的风险[38];同时,长江下游沙洲水域多是传统的渔场,尤其是近年来日本沼虾和中华绒螯蟹经济价值陡升,这些水域有大量的拖虾作业和地笼网作业,对中华绒螯蟹幼蟹的资源破坏较大,相关部门应根据渔业管理法律法规,严厉打击非法捕捞,同时,应积极组织有关科研部门,开展渔业资源可持续利用的相关研究,制定限额捕捞措施并严格执行。
致谢:感谢常熟市渔政监督大队、南通经济技术开发区水务和渔政管理处对调查工作的支持和帮助!感谢淡水渔业研究中心水生生物资源研究室的同窗对采样工作的协助!
[1] 赵乃刚.长江河蟹种质资源混杂对养蟹业影响[J].内陆水产,1998,23(5):2-4.
[2] 崔江华.黄河口中华绒螯蟹养殖技术研究与应用[D].北京:中国农业科学院,2010.
[3] 堵南山.中华绒螯蟹在欧洲[J].水产科技情报,2003,30(1):7-9,12.
[4] 范立民,徐东坡.长江徐六泾段渔业水环境现状初步调查[J].长江大学学报:自科版 农学卷,2007,4(1):36-38.
[5] 施炜纲,周昕,杜晓燕.长江中下游中华绒螯蟹亲体资源动态研究[J].水生生物学报,2002,26(6):641-647.
[6] Evans D O,Henderson B A,Bax N J,et al.Concepts and methods of community ecology applied to freshwater fisheries management[J].Canadian Journal of Fisheries and Aquatic Sciences,1987,44(S2):S448-S470.
[7] 张敏莹,刘凯,徐东坡,等.春季禁渔对常熟江段渔业群落结构及物种多样性影响的初步研究[J].长江流域资源与环境,2006,15(4):442-446.
[8] 张敏莹,徐东坡,段金荣,等.长江常熟江段渔业群落结构及物种多样性初步研究[J].生态科学,2007,26(6):525-530.
[9] 蒋金鹏,冯广朋,章龙珍,等.长江口中华绒螯蟹抱卵蟹生境适宜度初步评估[J].海洋渔业,2014,36(3):232-238.
[10] 周祥恕,刘怀汉,杨芳丽,等.长江下游通州沙水道和白茆沙水道演变关联性及治理建议[J].水运工程,2013(1):1-4.
[11] 长江水系渔业资源调查协作组.长江水系渔业资源[M].北京:海洋出版社,1990.
[12] Pielou E C.Ecological Diversity[M].New York:Wiley,1975.
[13] Simpson E H.Measurement of diversity[J].Journal of Cardiothoracic & Vascular Anesthesia,1997,11(6):812.
[14] Wilhm J L.Use of biomass units in Shannon's formula[J].Ecology,1968,49(1):153-156.
[15] 董婧,刘海映,许传才,等.黄海北部近岸鱼类的群落结构[J].大连水产学院学报,2004,19(2):132-137.
[16] 徐东坡,刘凯,张敏莹,等.长江常熟江段近岸小型鱼类群落结构及多样性探析[J].长江流域资源与环境,2012,21(4):448-453.
[17] 徐胜南,汪振华,梁金玲,等.不同网具在人工鱼礁水平方向上诱集效果的比较[J].水产学报,2016,40(5):820-831.
[18] 程琳.长江流域湖泊鱼类群落与主要环境因子关系及其预测模型[D].北京:中国科学院研究生院,2011.
[19] 冯广朋.牛山湖鱼类年龄结构及群落多样性的研究[D].武汉:华中农业大学,2003.
[20] Ryer C H,Stoner A W,Iseri P J,et al.Effects of simulated underwater vehicle lighting on fish behavior[J].Marine Ecology Progress Series,2009,391:97-106.
[21] 张列士,陆锦天.中华绒螯蟹(Eriocheir sinensis)蜕壳和生长的研究进展[J].水产科技情报,2001,28(6):246-250.
[22] 陈大刚,高天翔,曾晓起,等.莱州群体花鲈渔业生物学特征的研究[J].海洋学报,2001,23(4):81-86.
[23] 倪勇,伍汉霖.江苏鱼类志[M].北京:中国农业出版社,2006.
[24] 倪勇,朱成德.太湖鱼类志[M].上海:上海科学技术出版社,2005.
[25] 李忠义,吴强,单秀娟,等.渤海鱼类群落结构的年际变化[J].中国水产科学,2017,24(2):403-413.
[26] Bianchi G,Gislason H,Graham K,et al.Impact of fishing on size composition and diversity of demersal fish communities[J].ICES Journal of Marine Science,2000,57(3):558-571.
[27] 线薇薇,刘瑞玉,罗秉征.三峡水库蓄水前长江口生态与环境[J].长江流域资源与环境,2004,13(2):119-123.
[28] 李冬林,王磊,丁晶晶,等.水生植物的生态功能和资源应用[J].湿地科学,2011,9(3):290-296.
[29] 封文利,吴志强,黄亮亮,等.漓江中游近岸水域仔稚鱼物种组成及其与生境的关系[J].中国科学院大学学报,2015,32(6):769-774.
[30] Harrison T D,Whitfield A K.Temperature and salinity as primary determinants influencing the biogeography of fishes in South African estuaries[J].Estuarine,Coastal and Shelf Science,2006,66(1-2):335-345.
[31] 刘潇,张崇良,任一平,等.黄河口及邻近水域矛尾虾虎鱼资源丰度的时空分布[J].中国水产科学,2015,22(4):791-798.
[32] 董静瑞,胡成业,水玉跃,等.温州南部沿岸海域鱼类群落特征及其与环境因子的关系[J].中国水产科学,2017,24(2):209-219.
[33] Ulrich W,Gotelli N J.Null model analysis of species associations using abundance data[J].Ecology,2010,91(11):3384-3397.
[34] 刘凯,段金荣,徐东坡,等.长江口刀鲚渔汛特征及捕捞量现状[J].生态学杂志,2012,31(12):3138-3143.
[35] 陈强,郭行磐,周轩,等.长江口及其邻近水域滩涂底栖动物多样性的研究[J].大连海洋大学学报,2016,31(1):103-108.
[36] 堵南山.中华绒螯蟹的洄游[J].水产科技情报,2004,31(2):56-57,94.
[37] 李晓晖,许志强,葛家春,等.长江水系中华绒螯蟹种质资源研究进展[J].水产养殖,2009,30(10):42-47.
[38] 徐东坡,刘凯,段金荣,等.长江下游中华绒螯蟹成蟹资源现状(2007~2011 年)[J].长江流域资源与环境,2015,24(1):39-44.

