颗粒体病毒(CnmeGV)对稻纵卷叶螟的感染及害虫种群增长的影响
徐 健, 李传明, 韩光杰, 徐 彬, 祁建杭, 孙 俊, 刘 琴
(1.江苏里下河地区农业科学研究所,江苏 扬州 225007; 2.扬州绿源生物化工有限公司,江苏 扬州 225008)
杆状病毒(Baculovirus)是特异性感染节肢动物的环状双链DNA病毒,主要分为核型多角体病毒(Nucleopolyhedtovirus,NPV)和颗粒体病毒(Granulovirus,GV)。宿主以昆虫纲中的鳞翅目、双翅目、膜翅目、鞘翅目和毛翅目昆虫为主,其中寄生鳞翅目昆虫的杆状病毒多达400余种[1]。由于杆状病毒对人类和环境安全、寄主专一以及在害虫种群中的扩散传播形成对害虫种群的自然调控作用,杆状病毒作为重要的生防因子在害虫综合治理中受到广泛关注[2]。苹果蠹蛾(Cydiapomonella)颗粒体病毒(CpGV)、甜菜夜蛾(Spodopteraexigua)核型多角体病毒(SeNPV)、黎豆夜蛾(Anticarsiagemmatalis)核型多角体病毒(AgNPV)、棉铃虫Helicoverpaarmigera核型多角体病毒(HaNPV)等多种杆状病毒被深入研究并推广应用[3-4]。
稻纵卷叶螟(Cnaphalocrocismedinalis(Guenée))是东南亚和中国水稻上的重要害虫[5-8]。多种化学农药品种多次大量的使用不仅并未从根本上控制稻纵卷叶螟的爆发危害,还造成了水稻农药残留和严重的面源污染。庞义等[9]首次报道广州恩平县稻纵卷叶螟幼虫感染流行性病毒病,病原为稻纵卷叶螟颗粒体病毒(C.medinalisgranulovirus,CnmeGV)。张珊等[10]在时隔30多年CnmeGV的首次采集地恩平县,再次发现感染CnmeGV死亡的稻纵卷叶螟幼虫,表明该病毒具有田间控制目标害虫的持效性能。江苏里下河地区农科所在野外稻田自然罹病死亡的稻纵卷叶螟幼虫体内分离获得稻纵卷叶螟病毒,扫描电镜、病理学和分子生物学鉴定为颗粒体病毒[11],同时首次完成了全基因组测序分析[12]。CnmeGV对稻纵卷叶螟具有较强的侵染力,105OB/mg浓度处理害虫感染率达92%,作为潜在的生物控制因子具有重要的应用价值[13]。CnmeGV是侵染稻纵卷叶螟的专性杆状病毒,相关研究特别是稻田自然条件下病毒对害虫的致病性及种群动态的影响报道较少。本研究拟通过田间应用CnmeGV结合组建自然种群生命表进一步明确CnmeGV对稻纵卷叶螟的侵染及种群的干扰调控作用,为应用杆状病毒生物防治稻纵卷叶螟提供依据。
1 材料与方法
1.1 CnmeGV的增殖
以江苏里下河地区农业科学研究所实验室保存的CnmeGV原始病毒液接种感染稻纵卷叶螟幼虫。幼虫繁殖参考Xu 等[14]方法采用人工饲料饲养。选择2龄中期稻纵卷叶螟幼虫预饥6 h后,接种于均匀混合1×105OB/g浓度CnmeGV的人工饲料上,在 (25.0±0.5) ℃、相对湿度80%、光照度2 000 lx的恒温昆虫饲养室饲养2 d后,隔日更换新鲜人工饲料并观察虫体感病情况。饲养8~15 d,收集感病死亡的虫尸,研磨、匀浆、过滤,滤液经差速离心,得纯化的颗粒体病毒。用血球计数板计数颗粒体病毒含量,以无菌水稀释至1×1010OB/ml后置4 ℃保存备用。
1.2 田间试验
试验地位于扬州市甘泉镇,常年稻麦轮作,规律性发生稻纵卷叶螟危害。第1代害虫于当年6月底迁入,繁殖代及7月下旬迁入的稻纵卷叶螟构成第2代成为主要危害代。试验地约0.2 hm2,种植水稻品种为扬稻6号(江苏里下河地区农业科学研究所选育)。试验设CnmeGV不同浓度和空白对照3个处理,每处理重复3次,共9个小区,每小区150 m2(10 m×15 m),移栽水稻秧苗4 500穴。小区间间隔1 m,栽插4行水稻作为保护行,小区统一肥水管理。7月下旬稻纵卷叶螟第2代幼虫孵化高峰期施药,CnmeGV设 7.500×105OB/m2和1.125×106OB/m22个浓度,按75 ml/m2用水量稀释喷雾,对照组以等量清水喷雾。
1.3 田间取样和调查
施药后隔日田间调查不同处理区稻纵卷叶螟幼虫的存活率、病毒感染率。每小区随机5点取样,每点10穴,逐穴调查幼虫的残留存数,并根据稻纵卷叶螟幼虫感染CnmeGV虫体浊白、体节臃肿的感病症状区分记录感染虫数。设定对照组幼虫自然死亡率为0,处理组虫口减退率则计算为其相对死亡率。处理区幼虫感染数除以总活虫数则计算为CnmeGV感染率。幼虫发育历期3~4龄期,不同处理区采集50头幼虫于实验室饲养,观察计算绒茧蜂、寄生蝇等天敌寄生率。施药后20 d,各小区分别记录残存幼虫虫龄,参考实验种群各龄历期[14],各处理组调查总虫龄历期以对照组总虫龄历期校正计算获得预期发育历期。另采集高龄幼虫50头,室内饲养直至羽化,观察记录化蛹羽化情况,计算化蛹率、羽化率。
施药前3 d田间成虫盛发期,用捕虫网采集50对成虫,市售体积为125 ml的一次性塑料杯中置1对成虫,加入浸有10%蜂蜜水的脱脂棉供其补充营养,用保鲜膜封口,每日更换脱脂棉,让成虫交配产卵。成虫交配后产卵于杯壁上,逐日记录成虫的存活数和杯壁上的卵粒数,直至全部成虫死亡,计算成虫寿命及产卵量及孵化率。施药后25 d,在不同处理区用捕虫网采集成虫,形态区分并计算性比,另取50对成虫,按上述方法产卵并计算产卵量及孵化率。
1.4 数据分析
1.4.1 幼虫存活曲线分析 以病毒处理区幼虫虫口相对减退率为处理区幼虫死亡率,根据威布尔频数分布理论模型(Weibull frequency distribution)[15],参考周郁斌等[16]方法,采用Origin pro 8.0拟合稻纵卷叶螟幼虫感染CnmeGV生长发育过程特定阶段存活率曲线方程:S(t)=a-(a-b)exp[-(tk)d]。拟合后采用Log-Rank test分析种群存活率曲线间的差异性[17]。同时通过曲线方程计算幼虫感染病毒后死亡起始、50%死亡预期时间,明确CnmeGV对稻纵卷叶螟幼虫的致死作用。
1.4.2 自然种群生命表参数分析 参照昆虫种群生命表的制作方法[18],根据田间调查的数据及同期饲养所获的数据,估算稻纵卷叶螟种群不同时期幼虫、各虫态的存活率,组建得到自然种群生命表,按如下方法计算生命表参数:
种群净增殖率R0=∑lxmx
内禀增长率rm=(lnR0)/T
周限增长率λ=erm
世代平均周期T=∑lxmxx/∑lxmx
种群加倍时间DT=ln2/rm=0.693 1/rm
公式中lx表示x期间的存活率,mx表示x期间平均每雌产雌数。稻纵卷叶螟的幼虫历期、成虫寿命、产卵量等均用DPS v7.05数据处理系统进行t-测验。
种群趋势指数I=N2/N1=S1S2S3,…,SkPFP♀,式中N1、N2为当代和下代的种群数量,S1S2S3,…,Sk为各作用因子相对应的存活率,P♀为雌虫比率,PF为实际产出率。
种群控制指数IPC=I′/I,式中I为原有自然种群数量发展趋势指数,I′为CnmeGV干扰作用下种群数量发展趋势指数,用以比较CnmeGV干扰条件下对种群数量发展趋势的控制作用。
2 结果与分析
2.1 CnmeGV在稻纵卷叶螟种群中的感染
稻纵卷叶螟接触感染CnmeGV后,初始并不表现明显的病毒感染症状,随时间的推移,感病症状逐步呈现,表现出明显的杆状病毒感病症状,感病幼虫体节肿胀,行动迟缓,体色由正常的绿色半透明状逐渐变成灰白色而不透明,后期呈乳白色或略带黄色,罹死病虫从气孔释放出乳白色病毒液。田间应用CnmeGV后6 d田间始见感染病毒显症幼虫,8 d感病虫量显著增加,显症感染率达17.6%~19.53%,18 d田间虫龄处于3~4龄,表现感病症状的虫量达51.63%~54.23%,24 d调查田间虫态主要以5龄和老熟幼虫为主,感病显症幼虫比例达69.16%~70.77%。CnmeGV不同浓度处理稻纵卷叶螟幼虫感染程度及变化规律基本一致(图1)。
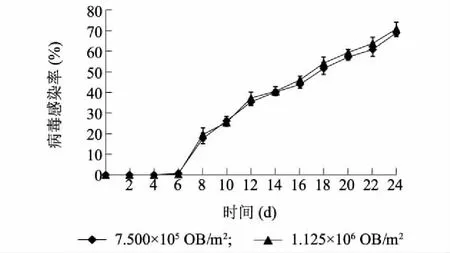
图1 不同浓度CnmeGV处理后田间稻纵卷叶螟幼虫的病毒感染动态Fig.1 The dynamic of rice leaffolder larvae infected by virus after spraying different concentration of CnmeGV
2.2 CnmeGV感染幼虫存活曲线
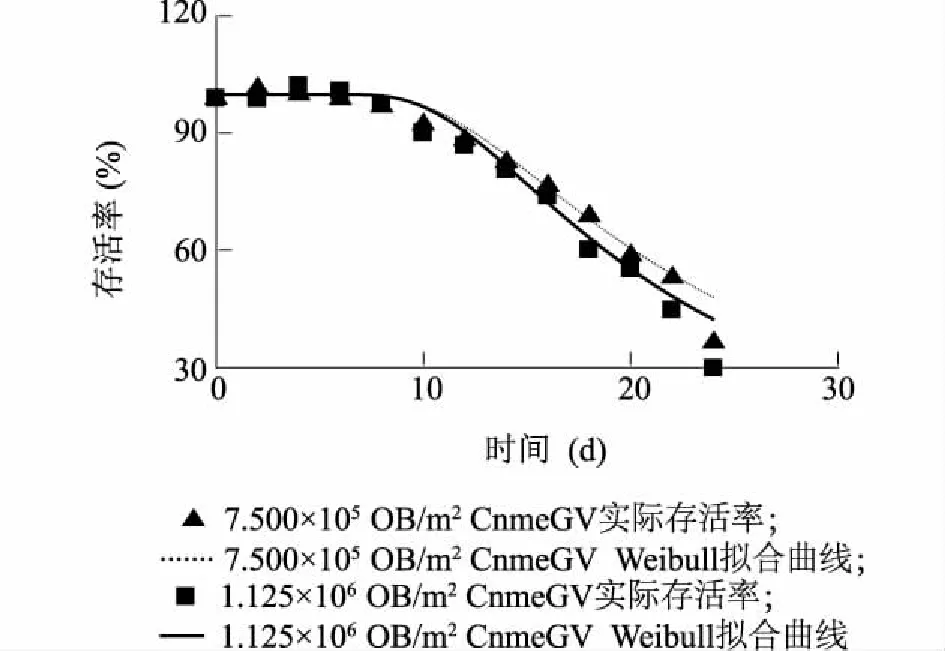
图2 CnmeGV感染稻纵卷叶螟幼虫拟合威布尔分布方程存活曲线Fig.2 Survival curve of CnmeGV infecting population fitting with the model of Weibull frequency distribution
2.3 CnmeGV对稻纵卷叶螟种群的控制作用
根据田间调查结果结合室内饲养观察结果,组建了稻纵卷叶螟田间的自然种群生命表,得到CnmeGV为作用因子的稻纵卷叶螟自然种群生命表参数。由表1可以看出,CnmeGV对稻纵卷叶螟种群具有明显的调控作用,感染CnmeGV的稻纵卷叶螟种群平均世代周期(T)延长了 2.45~2.79 d,内禀增长率(rm)下降了40.21%~42.27%,致使子代稻纵卷叶螟种群增长趋势指数(I)从20.03下降至6.30左右,同时种群加倍时间(DT)增加了 4.79~5.14 d。采用种群干扰作用控制指数分析表明,CnmeGV对稻纵卷叶螟种群控制作用明显。CnmeGV不同浓度病毒处理区的种群控制指数(IPC)为 0.31~0.32,说明稻纵卷叶螟种群在CnmeGV干扰下子代种群增长趋势下降为对照的0.3倍。
3 讨 论
CnmeGV是感染稻纵卷叶螟幼虫的专性杆状病毒,田间害虫卵孵化高峰期喷施病毒,CnmeGV通过稻纵卷叶螟幼虫取食感染并逐步显症,后期田间种群感病率达70%左右,表明CnmeGV在一定浓度条件下对稻纵卷叶螟具有较强的致病性,这种侵染致病能力有助于病毒在稻纵卷叶螟种群中传播扩散[19]。
表1田间CnmeGV不同浓度处理稻纵卷叶螟自然种群生命表参数
Table1ThelifetableparemetersofnaturalpopulationofriceleaffoldertreatedwithCnmeGV
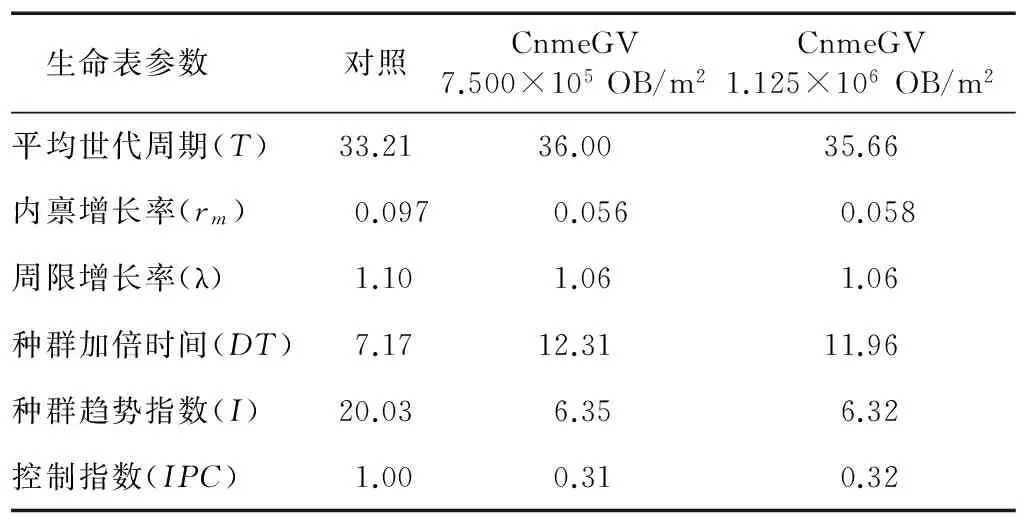
生命表参数 对照CnmeGV7.500×105OB/m2CnmeGV1.125×106OB/m2平均世代周期(T)33.2136.0035.66内禀增长率(rm)0.0970.0560.058周限增长率(λ)1.101.061.06种群加倍时间(DT)7.1712.3111.96种群趋势指数(I)20.036.356.32控制指数(IPC)1.000.310.32
昆虫感染杆状病毒到死亡需要经过一个缓慢的周期,杆状病毒DNA进入细胞核经过复制、组装、转移侵染而增殖感染引起宿主死亡[20]。稻纵卷叶螟幼虫感染CnmeGV一般在感病显症8.39~8.40 d开始死亡,感病幼虫前期和中期仍能卷叶取食造成危害,感病幼虫存活率曲线预期致死中时间需20 d以上。刘琴等[13]通过CnmeGV结合苏云金杆菌防治稻纵卷叶螟,不仅显著提高了田间稻纵卷叶螟的死亡率,而且病毒感染显症时间缩短了3 d,感染死亡率增加了20.23%。这种增效作用可能源于稻纵卷叶螟取食Bt毒素蛋白后直接造成害虫中毒死亡,未死亡的个体虫体免疫能力下降,提高了病毒的致病性[21],因此可以考虑田间应用CnmeGV防治稻纵卷叶螟时结合苏云金杆菌等生物农药,以提高对稻纵卷叶螟的直接防治效果,同时提高害虫的病毒感染率。
单一以虫口减退率或卷叶率等直接防治指标并不能全面反映杆状病毒对靶标害虫的控制作用[22]。通过构建稻纵卷叶螟感染CnmeGV田间种群生命表,应用种群控制指数评价害虫控制效果,进一步反映了杆状病毒对稻纵卷叶螟种群发展趋势的实际干扰控制作用。试验结果表明,以种群趋势指数和种群控制指数进行评价,CnmeGV对稻纵卷叶螟种群动态具有明显的影响,应用CnmeGV后子代种群趋势指数下降了3倍,可以有效控制稻纵卷叶螟的种群增长和爆发危害。
杆状病毒在野外昆虫种群中能引起流行病,导致继代持续带毒、感病死亡,长时间内自然控制种群消长[23]。目前杆状病毒在昆虫种群中的流行性研究主要集中在森林、果园等连续、稳定生态系统的害虫防治中[24]。农作物由于周期性的收获,直接干扰了杆状病毒的侵染和传播,相关报道较少。水稻(单季稻)一般生育期长达150 d,水稻生长周期中稻纵卷叶螟持续危害,一般发生3~5代,害虫种群生态相对稳定,有利于CnmeGV在稻纵卷叶螟种群中扩散,在子代种群中持续传播,从而控制种群增长,降低危害程度,减少稻田农药使用量。
[1] ROHRMANN G F. Baculovirus molecular biology (3rd edition) [M]. Corvallis: Department of Microbiology Oregon State University, 2014.
[2] POPHAM H J, NUSAWARDANI T, BONNING B C. Introduction to the use of baculoviruses as biological insecticides [J]. Methods in Molecular Biology, 2007,1350(388): 359-366.
[3] SZEWCZYK B, HOYOS-CARVAJAL L, PALUSZEK M, et al. Baculoviruses—re-emerging biopesticides [J]. Biotechnology Advances, 2006, 24(2): 143-160.
[4] 秦启联,程清泉,张继红,等.昆虫病毒生物杀虫剂产业化及其展望[J]. 中国生物防治学报, 2012, 28(2): 157-164.
[5] SHEPARD B M, BARRION A T, LISTINGER J A. Rice feeding insects of tropical Asia[M]. Philippines:IRRI,1995.
[6] 程家安. 水稻害虫 [M]. 北京: 中国农业出版社,1996.
[7] 周奋启,康晓霞,陈银凤,等.扬州市邗江区稻纵卷叶螟发生特点及防治技术[J].江苏农业科学,2016,44(3):140-145.
[8] 王 琳,包云轩,谢晓金,等.基于地统计法的稻纵卷叶螟时空变化特征[J].江苏农业学报,2017,33(1):50-55.
[9] 庞 义,濑涌流,刘 炬,等.稻纵卷叶螟颗粒体病毒[J]. 微生物学通报,1981, 8(3): 103-104.
[10] 张 珊,贾茜雯,孙士锋,等.一株稻纵卷叶螟颗粒体病毒的系统发育和流行病学调查 [J]. 环境昆虫学报, 2014,36(5): 756-776.
[11] XU J, LI C M, HAN G J, et al.Cnaphalocrocismedinalis(Guenée) Granulovirus, a potential microbial agent against the rice leaffolderCnaphalocrocismedinalisGüenée (Lepidoptera: Pyralidae) [J]. Egyptian Journal Biological Pest Control, 2016, 26(4): 675-681.
[12] HAN G J, XU J, LIU Q, et al. Genome ofCnaphalocrocismedinalisgranulovirus, the first crambidae-infecting Betabaculovirus isolated from rice leaffolder to sequenced [J]. PLoS ONE, 2016, 11(2): e0147882.
[13] 刘 琴,徐 健,王 艳,等. CmGV与Bt对稻纵卷叶螟幼虫的协同作用研究 [J]. 扬州大学学报(农业与自然科学版), 2013,34(4): 89-93.
[14] XU J, LI C M, YANG Y J, et al. Growth and reproduction of artificially fedCnaphalocrocismedinalis[J]. Rice Science, 2012, 19(3): 247-251.
[15] PINDER J E, WIENER J G, SMITH M H. The weibull distribution: A new method of summarizing survivorship data [J]. Ecology, 1978, 59(5):175-179.
[16] 周郁斌,袁中文,李海刚,等. 用Origin软件计算药物溶出度Weibul1分布参数[J].医药导报, 2011, 30(6): 721-723.
[17] SOKAL R R, ROHLF F J. Biometry(3rd edition) [M]. New York: W H Freeman and Company, 1998.
[18] 庞雄飞. 害虫种群的生态控制 [M]. 北京: 高等教育出版社, 2002.
[19] LACEY L A, THOMSON D, VINCENT C, et al. Codling moth granulovirus: a comprehensive review [J].BiocontrolScience and Technology, 2008, 18: 639-663.
[20] CORY J S, FRANKLIN M T. Evolution and the microbial control of insects [J]. Evolutionary Applications, 2012, 5(5): 455-469.
[21] HAN G J, LI C M, LIU Q, et al. Synergistic effect of combiningPlutellaxylostellagranulovirus andbacillusthuringiensisat sublethal dosages on controlling of diamondback Moth (Lepidoptera:Plutellidae) [J]. Journal of Economic Entomology, 2015, 108(5):2184-2195.
[22] 冼继东,卢传全,庞雄飞. 颗粒体病毒对小菜蛾种群控制作用的评价 [J]. 海南大学学报(自然科学版), 1997, 15(2): 138-140.
[23] FUXA J R. Ecology of insect nucleopolyhedroviruses [J]. Agriculture, Ecosystems and Environment,2004, 103(1): 27-43.
[24] CORY J S, MYERS J. The ecology and evolution of insect baculoviruses [J]. Annual Review of Ecology Evolution and Systematics, 2003, 34(1): 239-272.

