维生素E对绵羊原代睾丸间质细胞睾酮合成的影响
修 朋,曲扬华,高月锋,刁志成,罗海玲
(动物营养学国家重点实验室,中国农业大学动物科技学院,北京 100193)
维生素E又称生育酚,是一种与繁殖密切相关的脂溶性维生素,维生素E作用于公畜、母畜及胎儿调控繁殖[1-3],对雄性繁殖主要影响性器官的发育以及精液品质。维生素E通过抗氧化作用调节激素合成及分泌、生殖相关酶活性和基因表达量,改善动物的繁殖性能。
睾酮是一种重要的雄激素,本团队前期研究发现,维生素E有提高绵羊睾酮合成相关蛋白GATA-4 和CYP11A1表达量的趋势,并且显著提高了睾酮合成快速调节蛋白(StAR)的表达量[4]。但也有研究发现,饲喂维生素E对羔羊血清睾酮浓度无显著影响[5]。睾酮合成是一个复杂的过程,雄性动物体内大部分睾酮由睾丸间质细胞分泌[6]。动物体内的睾酮合成存在基础分泌和下丘脑-垂体-睾丸轴诱导2种形式[7],后者主要受促黄体生成素(LH)刺激。动物体内的睾酮分泌受到内分泌调节、旁分泌调节和自分泌调节[7]。睾酮合成与调节过程受体内外多种因素如激素分泌、睾丸内其他细胞及其分泌的细胞因子的作用[8],因此难以探究维生素E对于睾丸间质细胞的睾酮合成作用。本研究以绵羊原代睾丸间质细胞为试验材料,从细胞水平探究维生素E对睾丸间质细胞睾酮基础分泌的影响。
1 材料与方法
1.1 试验动物及样品采集 选择健康无病、体况良好的2月龄小尾寒羊(♀)×杜泊(♂)杂交公羔(购自北京市昌平区金燕都绿叶农场),屠宰后分离两侧睾丸组织,用于睾丸间质细胞分离培养。
1.2 主要试剂及仪器 胎牛血清(康源生物)、台盼蓝染液(索莱宝)、RIPA组织/细胞裂解液(Coolaber)、CCK-8试剂盒(南京建成生物工程研究所有限公司)、水溶性维生素E、DMEM/F12培养液、PBS、0.25%胰蛋白酶购自Hyclone,氯化硝基四氮唑蓝(NBT)、辅酶ⅠNAD购自上海生工,二甲基亚砜(DMSO)、脱氢表雄酮(DHEA)、一型胶原酶购自Sigma,绵羊 3β-羟基类固醇脱氢酶(3β-HSD)、17β-羟基类固醇脱氢酶(17β-HSD)、17α-羟化酶(CYP17)、胆固醇侧链裂解酶(P450scc)、睾酮ELISA检测试剂盒购自北京冬歌生物,动物细胞RNA提取试剂盒、Fast Quant cDNA 第一链合成试剂盒(去基因组)、Super Real 荧光定量预混试剂增强版,均购自天根生物。手术器械(眼科剪、眼科镊)、血细胞计数板、离心机、酶标仪、恒温培养箱、细胞摇床、超净工作台、电子天平、恒温浴锅、荧光定量基因扩增仪。
1.3 睾丸间质细胞的分离培养 用无菌PBS清洗至无血污,在75%酒精内浸泡30 s消毒,再用PBS清洗3~4次。用眼科剪及镊子剥除睾丸表面被膜,取1 cm³左右小块置于装有2 mL 0.25% I型胶原酶的离心管内,封口后置于摇床内,37℃,100 r/min,震荡12 min。取出后加入与酶等量的含血清的DMEM/F12培养基,静置5 min,用200目与400目组合细胞筛进行过滤。收集滤液于离心管内,1 200 r/min离心5 min,细胞位于离心管底部,用无菌PBS清洗3次。加入含血清的DMEM/F12培养基获得细胞悬液。然后将细胞悬液接种于适当培养皿内,观察细胞形态,根据试验需要进行相应的处理。
1.4 睾丸间质细胞的活率鉴定 细胞悬液稀释至适宜浓度,取适量细胞悬液加入等量的0.4%台盼蓝染液,混匀后吸取10 μL,从计数板上盖玻片的一侧加样,置于显微镜下计数,活细胞会呈无色透明状,死细胞被染成蓝色,记录其中的活细胞和死细胞数。
1.5 绵羊睾丸间质细胞纯度鉴定 由于3β-HSD在睾丸内特异性的存在于间质细胞内,间质细胞的鉴定采用3β-HSD染色法进行,A染液配方:NBT 1 mg,DHEA 0.6 mg,溶于0.6 mL DMSO内;B染液配方:NAD 10 mg溶于9.5 mL PBS内。调整细胞浓度,将细胞接种于48孔板内,每孔0.25 mL(3×105个细胞),培养箱内培养24 h后,每孔加入200 μL 3β-HSD染色液,培养箱内孵育1 h左右,间质细胞被染成蓝色,计算间质细胞纯度。
1.6 维生素E处理与睾酮含量测定 将分离收集的睾丸间质细胞接种于6 cm皿内,细胞浓度调整为106个/mL,培养液为含15%胎牛血清的DMEM/F12培养基。试验设计为 4个维生素 E处理(0、40、80、160 μg/mL),每个浓度3个复孔,每个培养皿内培养基含量为5 mL。37℃,5%CO2,培养48 h。48 h后更换含有不同浓度维生素E(0、40、80、160 μg/mL)的培养基。继续培养24 h后,收集培养基上清测定睾酮含量。睾酮含量的测定用绵羊睾酮ELISA试剂盒,试验重复3次,具体操作方法参考说明书。
1.7 睾酮合成相关酶含量测定 将1.6中收集完培养基的培养皿用PBS清洗,加入350 μL细胞裂解液,用枪吹打数下,使裂解液和细胞充分接触。充分裂解后,12 000×g离心5 min,取上清,用ELISA试剂盒测定睾酮合成相关酶(P450scc、3β-HSD、17β-HSD、CYP17)的含量。1.8 睾酮合成关键基因表达水平检测 细胞分离培养方法同1.3,培养48 h后更换含有不同浓度维生素E(0、40、80、160 μg/mL)的培养基,继续培养24 h。24 h后收集细胞并提取细胞总RNA,测定RNA浓度,调整至每个反应管内2 μg RNA。去除总RNA内的基因组DNA后,进行反转录,将cDNA稀释1倍后进行荧光定量。以18S与GAPDH作为内参,荧光定量目的基因为3β-HSD、17β-HSD、P450scc、CYP17、StAR。 引物序列见表1。

表1 荧光定量引物序列
1.9 统计分析 对于睾酮含量以及酶含量测定的试验,采用Logistics曲线(4参数)来拟合不同浓度标准品的OD值,以OD值为横坐标,睾酮浓度以及酶含量为纵坐标,计算出标准曲线的方程式,通过此方程式,结合样品的OD值,计算出各个样品的睾酮浓度以及酶含量。将获得的数据使用SPSS 19.0软件进行分析,采用单因素方差分析(One-Way ANOVA),多重比较采用Duncan´s法,结果用平均值±标准误表示。对于荧光定量基因,以得到的CT值为统计参数,按2-△△CT法,算出相对表达量。以相对表达量的数据进行统计分析,使用SPSS19.0软件进行分析,采用单因素方差分析法,多重比较采用Duncan´s法,以P<0.05为差异显著性判断标准,以0.05≤P<0.10为有差异显著趋势。
2 结 果
2.1 睾丸间质活率、纯度及形态观察 分离得到的细胞,用台盼蓝进行染色,活的细胞呈无色透明泡状,死细胞则被染成蓝色,经计算细胞活率达96%。如图1所示,采用3β-HSD特异染色,睾丸间质细胞被染成蓝色,细胞纯度达95%以上。如图2所示,接种后4 h左右,睾丸间质细胞开始贴壁,铺展在细胞培养皿的底部。培养24 h后,大部分细胞贴壁,贴壁细胞间连结成网状(图3)。继续培养一段时间,细胞能够增殖,细胞数量增多,密度变大,可以传代培养。
图1 绵羊睾丸间质细胞纯度鉴定结果(10×40)

图2 接种4 h后绵羊睾丸间质细胞贴壁情况(10×10)
2.2 维生素E对睾丸间质细胞睾酮分泌的影响 如图4所示,添加40 μg/mL维生素E睾酮浓度有增加的趋势(P=0.061),其余浓度均无显著差异(P>0.05)。

图3 接种24 h后绵羊睾丸间质细胞贴壁情况(10×10)
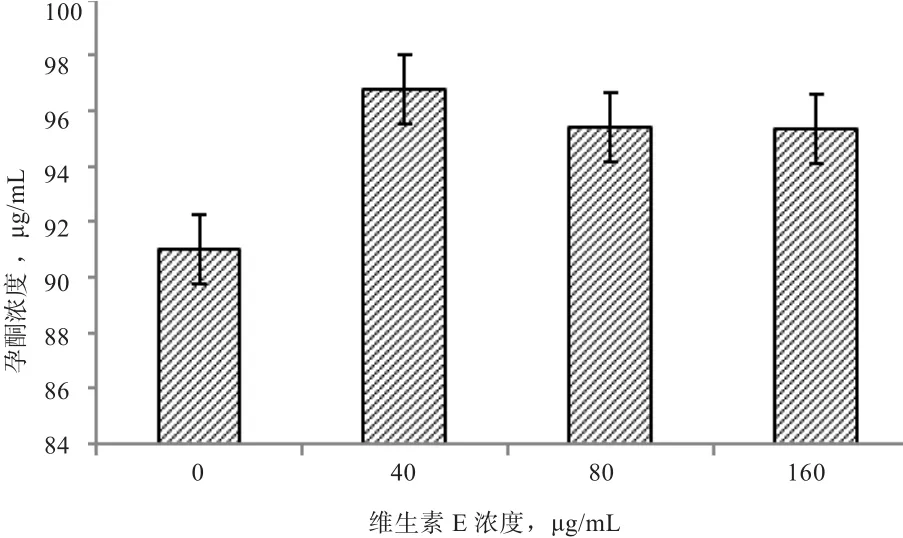
图4 维生素E对绵羊睾丸间质细胞睾酮分泌的影响
2.3 维生素E对睾丸间质细胞睾酮合成相关酶含量的影响 如表2所示,添加维生素E显著影响绵羊睾丸间质细胞内睾酮合成酶3β-HSD和P450scc的含量(P<0.05),其中 40 μg/mL处理组 3β-HSD含量较对照组显著升高(P<0.05),同时P450scc含量显著高于对照组和160 μg/mL维生素E组(P<0.05),而其余各组间未见有显著差异(P>0.05);此外,维生素E的添加有提高间质细胞17β-HSD(P=0.084)和CYP17α(P=0.071)酶含量的趋势,其中以40 μg/mL处理组效果最高。二次项分析显示,4种酶差异显著(P<0.05),其中P450scc酶差异极显著(P<0.01),随维生素E添加,酶含量呈先上升后下降的趋势。
2.4 维生素E对睾丸间质细胞睾酮合成关键基因表达水平的影响 如图5所示,添加维生素E可显著影响绵羊睾丸间质细胞内睾酮合成3β-HSD和P450scc基因相对表达量(P<0.05),其中 40 μg/mL处理组3β-HSD活性较对照组显著升高,而其余各组间未见显著差异(P>0.05);添加40 μg/mL维生素E有提高间质细胞17β-HSD基因表达的趋势(P=0.067),添加40 μg/mL和80 μg/mL维生素E 组StARmRNA相对表达量有增加趋势(P=0.063,P=0.07),而维生素E对CYP17mRNA 相对表达量无显著影响(P>0.05)。

表2 不同维生素E添加对绵羊睾丸间质细胞内睾酮合成相关酶含量的影响
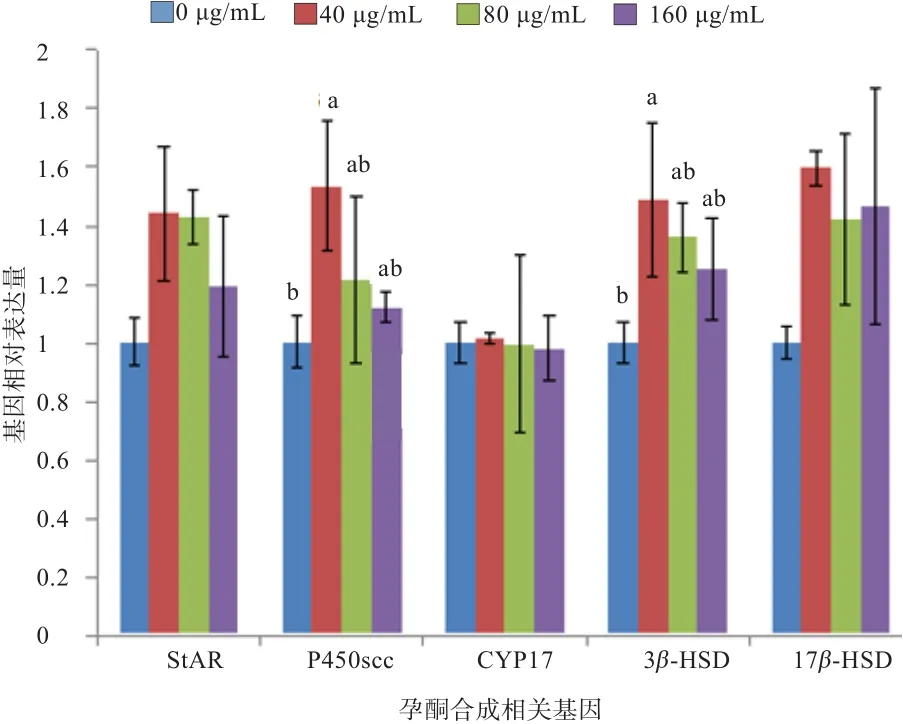
图5 维生素E对绵羊睾丸间质细胞睾酮合成相关基因相对表达的影响
3 讨 论
3.1 绵羊原代睾丸间质细胞分离 睾丸间质细胞存在于睾丸曲细精管间的结缔组织内,本试验利用睾丸间质细胞的位置特性,避免破坏曲细精管,将曲细精管间的间质细胞消化震荡为单细胞,获得的细胞活率达96%以上,细胞纯度达95%以上,较简单的机械分离法[20]及酶消化法[21],有效减少了对原代细胞的损伤,分离的细胞能够贴壁生长,并稳定传代培养。
3.2 维生素E对绵羊原代睾丸间质细胞睾酮合成影响缺乏维生素E影响睾丸发育,造成血清中总睾酮浓度降低[9]。日粮中添加维生素E可以缓解应激造成的异常睾酮分泌[10],与本试验结果一致,添加40 μg/mL维生素E有促进睾酮合成的趋势。
3.3 维生素E对睾酮合成关键酶及基因表达的影响 底物胆固醇从线粒体外膜转运至线粒体内膜是类固醇激素合成的限速步骤,StAR介导胆固醇的跨膜转运。在睾丸间质细胞中,StAR表达主要由LH介导的cAMP依赖性通路的激活调控,导致转录激活[11]。StARmRNA表达降低会干扰睾酮合成,导致睾丸内睾酮水平降低[12]。研究发现,在绵羊日粮中添加维生素E显著提高了StAR的表达[4]。缺氧造成的氧化剂增多会导致睾丸中StAR的表达下降[13]。而当睾丸间质细胞应激情况下,添加维生素E可以抑制应激对睾酮的影响,同时对StAR蛋白表达抑制有显著作用[10]。本试验发现,添加40、80 μg/mL维生素E对绵羊睾丸间质细胞内StARmRNA表达有提高趋势,可能是由于维生素E通过抗氧化途径,提高StAR的表达,促进胆固醇的转运。
睾丸间质细胞内有较高的P450scc表达水平,P450scc是胆固醇转化为孕烯醇酮的关键因子[12]。研究发现,化学试剂会影响P450scc含量,进而影响睾酮合成;P450sccmRNA水平下降也会造成睾酮合成下降[14]。但与StAR不同,P450scc在合成的早期阶段不受激素的调节[12]。在没有LH的刺激下P450scc仍维持一定的表达水平[15]。本试验中,添加40 μg/mL维生素E显著提高了P450scc酶的含量与基因表达量。推测其酶含量的提高可能是由于维生素E直接作用于P450scc,调节酶的含量,提高酶活性;也可能是由于P450sccmRNA表达量的提高,增加了胆固醇转化为孕烯醇酮。
3β-HSD催化孕烯醇酮为孕酮,在睾丸间质细胞中表达,是特异性的间质细胞鉴定指标,其活性可衡量间质细胞合成睾酮的能力[16]。研究发现,腹腔注射多氯联苯造成小鼠3β-HSDmRNA表达下降,添加维生素E能够显著恢复3β-HSDmRNA表达[17]。本试验中添加适量(40 μg/mL)维生素E 显著提高3β-HSD酶含量与基因表达,加速孕烯醇酮转化为孕酮。
孕酮在滑面内质网上形成后在CYP17作用下形成雄烯二酮,CYP17的合成需要LH或cAMP的刺激,在无激素刺激的情况下,CYP17的合成会停止[15,18]。此外,在睾酮的介导下,CYP17与自由基结合成复合物,增加了CYP17酶的分解,使其活性降低[18]。本试验中发现,添加维生素E对于CYP17酶含量与基因表达均无显著影响,可能是缺少相应的激素刺激,CYP17合成终止,但添加40 μg/mL维生素E组 CYP17酶含量有增加的趋势,可能是由于维生素E清除自由基的作用,促进雄烯二酮的形成。
睾酮生物合成的最后一步是17β-HSD 催化雄烯二酮还原为睾酮[15],17β-HSD主要在睾丸中表达。线粒体释放的活性氧刺激CYP17、3β-HSD和17β-HSD的活性,从而刺激睾酮的合成[19]。本试验中40 μg/mL维生素E组 17β-HSD的含量有提高趋势,可以刺激睾酮的合成。有研究发现,由于腹腔注射多氯联苯造成的小鼠17β-HSDmRNA表达的下降,对其施加一定剂量的维生素E能够显著恢复17β-HSDmRNA表达[17]。可知维生素E对于睾酮合成中关键酶的mRNA表达有提高作用。本研究发现,40 μg/mL维生素E组 17β-HSDmRNA表达有增加趋势,提高雄烯二酮还原为睾酮的速率。
4 结 论
维生素E通过提高P450scc和3β-HSD基因表达和酶活含量,影响CYP17酶含量与StAR基因表达,从而调控睾丸间质细胞睾酮合成。综合本试验各指标,以40 μg/mL维生素E添加量效果较优。
[1] 罗海玲, 贾志海, 朱士恩, 等. 稀释液中添加维生素E对绵羊冷冻精液品质的影响[J]. 中国畜牧杂志, 2004, 40(11): 7-9.
[2] 王丽. 围产期奶牛日粮添加不同水平维生素E对其生产性能、免疫功能及繁殖机能的影响[D]. 呼和浩特: 内蒙古农业大学, 2010.
[3] 李苏. 不同剂量维生素E对更年期大鼠卵巢功能的影响[D].济南: 山东大学, 2008.
[4] 左兆云. 日粮维生素E对绵羊睾丸繁殖机能影响的分子机制初探[D]. 北京: 中国农业大学, 2014.
[5] Gökdal O, Atay O, Eren V,et al. Fattening performance, carcass and meat quality characteristics of Kivircik male lambs[J]. Trop Anim Health Prod, 2012, 44(7): 1491-1496.
[6] Kelly D M, Jones T H. Testosterone: a metabolic hormone in health and disease[J]. J Endocr, 2013, 217(3): 25-45.
[7] Glade M J, Smith K, Meguid M M. A glance at…nutritional antioxidants and testosterone secretion[J]. Nutrition, 2015,31(10): 1295.
[8] Kim G Y, Hong G L, Kim E J. Effects of extracts from oja on testosterone synthesis in leydig cells[J]. J Physiol Pathol Korean Med, 2015, 29(5): 403.
[9] Akindele O O, Kunlealabi O T, Adeyemi D H,et al. Effects of vitamin E and melatonin on serum testosterone level in sleep deprived Wistar rats[J]. Afr J Med Med Sci, 2014, 43(4): 295-304.
[10] 刘姗姗.β-氯氰菊酯影响雄性小鼠生殖功能作用机制研究[D]. 重庆: 西南大学, 2008.
[11] Martin L J, Tremblay J J. Glucocorticoids antagonize cAMP-induced Star transcription in Leydig cells through the orphan nuclear receptor NR4A1[J]. J Mol Endocrinol, 2008, 41: 165-175.
[12] Kallen C B, Arakane F, Christenson L K,et al. Unveiling the mechanism of action and regulation of the steroidogenic acute regulatory protein[J]. Mol Cell Endocrinol, 1998, 145: 39-45.
[13] Zhang G L, Dai D Z, Zhang C,et al. Apocynin and raisanberine alleviate intermittent hypoxia induced abnormal StAR and 3β-HSD and low testosterone by suppressing endoplasmic reticulum stress and activated p66Shc in rat testes[J]. Reprod Toxicol, 2013, 36: 60-70.
[14] Akingbemi B T, Ge R S, Klinefelter G R,et al. A metabolite of methoxychlor, 2,2-bis(p-hydroxyphenyl)-1,1, 1-trichloroethane,reduces testosterone biosynthesis in rat leydig cells through suppression of steady-state messenger ribonucleic acid levels of the cholesterol side-chain cleavage enzyme[J]. Biol Reprod,2000, 62(3): 571-578.
[15] Raucci F, D'Aniello A, Di F M. Stimulation of androgen production by D-aspartate through the enhancement of StAR,P450scc and 3β-HSD mRNA levels in vivo rat testis and in culture of immature rat Leydig cells[J]. Steroids, 2014, 84: 103-110.
[16] Lai M S, Cheng Y S, Chen P R,et al. Fibroblast Growth factor 9 activates akt and MAPK pathways to stimulate steroidogenesis in mouse leydig cells[J]. PLoS One, 2014, 9(3): e90243.
[17] Murugesan P, Muthusamy T, Balasubramanian K,et al.Effects of vitamins C and E on steroidogenic enzymes mRNA expression in polychlorinated biphenyl (Aroclor 1254) exposed adult rat Leydig cells[J]. Toxicology, 2007, 232(3): 170-182.
[18] Georgiou M, Perkins L M, Payne A H. Steroid synthesisdependent, oxygen-mediated damage of mitochondrial and microsomal cytochrome P-450 enzymes in rat Leydig cell cultures[J]. Endocrinology, 1987, 121(4): 1390.
[19] Diemer T, Allen J A, Hales K H,et a1. Reactive oxygen disrupts mitochondna in MA-10 tumor Leydig cells and inhibits steroidogenic acute regulatory(STAR) protein and steroidogenesis[J]. Endocrinology, 2003, 144(7): 2882-2891.
[20] 龚淼, 张雷, 赵昱, 等. 小鼠生精细胞的体外双室无血清培养[J]. 河北医科大学学报, 2016 (1): 1-4.
[21] 卿利娟, 魏泓, 李婧, 等. 仔猪睾丸间质细胞培养方法的比较[J]. 中国兽医杂志, 2013(11): 29-31.

