氮杂螺环酸毒素的生态分布、蓄积代谢与检测技术监控研究进展
吴海燕,郭萌萌,郑关超,彭吉星,翟毓秀,谭志军
(中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验室, 山东 青岛 266071)
赤潮灾害是中国近海四大主要自然灾害之一[1]。近几年,中国贝类毒素呈现出常态性和普遍性的多毒素复合污染现状[2-5],且多次造成重大突发性中毒事件。现有八大类毒素中,氮杂螺环酸毒素(azaspiracids,AZAs)是在中国海域最新发现的毒性强、残留高且代谢慢的一类脂溶性贝类毒素[6-8],其具有以下特点:1)毒性强,对人类观察到的最小效应剂量(LOAEL)为0.4 μg/kg,远低于麻痹性贝类毒素(paralytic shellfish toxins, PSTs)2.0 μg/kg的水平[6];2)残留高,多种贝类对AZAs的富集能力均极强,现有观察到的最高含量达到限量标准的56倍之多[9];3)代谢慢,AZAs在贝类中消除半衰期则长达11 d,自然条件下可长时间存在于贝类中[10]。目前,部分发达国家或国际组织将AZAs设定安全限量为0.16 mg/kg (以AZA1计),限定对象为AZA1、AZA2和AZA3。然而,中国仍未系统开展该毒素的科学研究,且未设定安全限量,对中国水产品国际贸易与质量安全存在潜在不利影响。近几年,多位中国学者相继开展中国海域贝类毒素污染现状调查,研究对象主要是腹泻性贝类毒素(diarrhetic shellfish toxins,DSTs)和麻痹性贝类毒素[3,5,11-13],对于AZAs的研究多局限于关注AZA1[4-5]。研究表明,AZAs产毒藻腹孔环胺藻(Azadiniumpoporum)广泛分布于中国近海海域,超过86%的藻株均可产生AZAs[14-15],甚至双壳贝类中的AZAs也多次检出[4,16]。产毒藻与市售贝类中毒素的先后发现表明AZAs已对中国近海生态和食用安全带来严重的潜在威胁。鉴于AZAs的高风险性,开展中国AZAs风险评估,设定合理限量以确保食品安全已迫在眉睫。因此,本文总结了AZAs的理化性质、分布现状与检测方法的进展,并分析了该毒素的分布规律与风险形成机制,以期为科学开展相关风险评估研究提供背景资料和参考依据。
1 氮杂螺环酸毒素概况
1.1 理化性质
AZAs是一类具有独特聚醚类螺环结构的脂溶性海洋生物毒素,含杂环胺(哌啶)和羧酸结构(图1),分子质量为716~902 Da。2008年李爱峰等[17]首次将原多甲藻多产的Azaspiracid毒素,翻译为“原多甲藻酸”,后经证实该毒素是由环胺藻属的甲藻产生的,故现遵循其毒素的化学结构特点,更正为“氮杂螺环酸”。AZAs目前已分离鉴定40余种,其中产毒藻中主要产生AZA1~3中的一种或者两种[10],另有30余种AZAs产毒藻被海洋生物摄食后经过复杂的代谢转化反应形成的AZA代谢产物[18]。AZAs在生物基质中主要发生两种形式的Ⅰ相代谢转化反应:1)C3和C23位点的羟基化(图1); 2)C8和C22位点的甲基化以及羧基化[19]。而AZAs II相代谢过程的相关研究较少,仅见关于AZA1的葡萄糖醛酸复合型代谢产物[20]和AZAs谷胱甘肽型代谢产物[21]的报道。AZA毒素具有热稳定性,受毒素结构差异影响,耐受温度从90~130 ℃不等,因此常规的加热方式不能破坏其毒性。常规烹调也会造成AZA代谢产物之间的转换[22-23],如C22位点去甲基化代谢物(AZA3,AZA4,AZA6和AZA9)即为加热条件下生成的产物。AZAs虽被划分为脂溶性贝类毒素,但其兼具水溶性和脂溶性,主要溶解于甲醇、乙腈或丙酮,不溶于正己烷,可以溶解于中性海水和产毒藻培养液中[24]。AZAs在甲醇溶液中易发生甲基化反应,低温条件下反应较慢,而高温碱性或者酸性条件下反应迅速。因此,单独检测AZAs的方法中应避免使用甲醇,改用丙酮或乙腈水溶液。
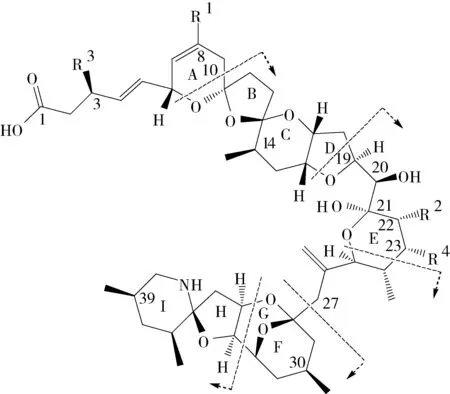
图1 AZAs的化学结构Fig.1 Chemical structure of AZAs
1.2 致毒机理
AZAs与腹泻性贝毒DSTs的临床症状相似,主要作用靶器官为肠道,中毒症状包括恶心、呕吐、严重腹泻和胃肠部痉挛等,通常在食后12~24 h后发作,持续时间为1~5 d,尚未发现致死案例。AZAs比其他含氮类生物毒素毒性更强、更稳定,急性致毒的参考剂量ARfD值为0.2 AZA1 μg/kg b.w.,低于其他贝类毒素(okadaic acid,OA)ARfD值(0.33 μg/kg b.w.)[25]。目前为止,世界3个主要风险评估机构(FAO,ICO/WHO和EFSA)已对AZAs开展风险评估研究[26-28],其中FAO和EFSA强烈建议将目前的限量(0.16 mg/kg,以AZA1计)大幅度降低(至30 μg/kg,以AZA1计)。研究发现,常规的烹饪和加工处理无法降低AZAs毒性,迄今尚未找到有效的治疗方法和治疗药物。虽然AZAs与氢氧化钠溶液在76 ℃下反应10 min后可显著降低其毒性,但因该方法对贝类品质和可食用性造成的显著性破坏,从而未被实际采用。
AZAs毒性作用机制非常独特,目前仍未得到充分证实。虽然AZAs的细胞毒性作用可通过抑制钾离子和钠离子通道实现,但AZAs并不具有蛋白磷酸酶、激酶、G蛋白偶联受体以及肌动蛋白聚合/解聚合抑制作用[29],因此其致毒机理与其他贝类毒素不同。研究发现,乳猪注射高剂量AZA毒素纯品时,没有出现典型的AZA毒素中毒症状[30],而含AZAs的贝类组织粗提物却表现出了强毒性。为了解释这一异常现象,Chevallier等[31]应用代谢组学方法首次证实了贝类基质中的戊二酸是重要的AZAs毒性作用催化剂,能显著提高50%以上的钠离子通道阻断率,且在实际阳性AZAs样品中也检出了戊二酸。由此可见,AZAs是与特定物质通过协同作用从而发挥毒性作用。
1.3 细胞毒性与协同作用
AZAs具有显著的组织、细胞和基因毒性,且毒性大小与时间、浓度以及其结构有显著的相关性。研究发现,AZAs依靠自身特有的ABCDE和FGHI环结构基团(图1),与人神经母细胞瘤作用靶点结合,使得纤维肌动蛋白发生重排,从而改变细胞骨架。并且这一过程不受天冬氨酸特异性半胱氨酸蛋白酶(Caspases)系的细胞凋亡调控,与DSTs相比可明显提高人淋巴细胞内环磷酸腺苷(cAMP)和胞液内Ca2+浓度。由此看来,AZAs的细胞毒性作用机制与OA是不同的,是通过特殊的结构基团与细胞结合,具有特定的细胞作用靶点。另外,毒素的基因毒性研究表明,AZA1~3对细胞DNA片段存在显著的时间-剂量依赖关系。AZA1~3三种成分对于细胞毒素毒性灵敏度为CaCo-2 自然海域中,无论是正常情况还是赤潮爆发时,往往是多种产毒藻并存,从而造成双壳贝类中多毒素复合污染的现象。由于各种毒素致毒机理上的差异,多种毒素的复合污染可能会出现毒素间的协同或抑制作用。AZAs与DSTs均作用于胃肠道上皮细胞,因此可能存在毒性的协同作用,从而给机体造成更大的损害。研究表明,小鼠同时口服暴露OA和AZA1(相当于LD10剂量570 μg/kg),毒素的吸收率显著降低[33]。在研究OA、 YTX和AZA1对Caco-2和HIEC(human intestinal epithelial crypt-like cells)的复合毒性时,发现AZA1与YTX的毒性具有协同作用[34]。目前关于复合毒素污染之间的毒性协同作用研究尚处于起步阶段,因此仍有大量的研究工作急需开展。 AZAs检测的生物检测方法主要包括小鼠腹腔注射法、大鼠口服法以及酶联免疫检测方法。由于AZAs与DSTs均是作用于消化系统且具有急性毒性的毒素,自2002年欧盟设定AZAs限量后,即暂定采用DSTs毒素的小鼠生物法进行检测。但该方法仅能提供DSTs和AZAs的有无及总量大小,不能区分毒素类型及含量。 酶联免疫法是利用抗原与抗体反应,微孔板包被有针对各类毒素抗体的捕捉抗体,加入酶标记物,游离的酶标记物与毒素抗体竞争连接捕捉抗体,通过对特定吸收波长的吸收强度比对,对毒素进行定性定量的检测。此方法具有专一性强、使用方便、检测时间短等优点。应用ELISA免疫检测方法[35],可同时检测AZA1~10等10余种同系物,检出限为57 μg/kg。 AZAs在波长大于210 nm的范围缺少特征吸收峰,不能用常规液相色谱方法检测。通过使用9-蒽基重氮甲烷(9-anthryldiazomethane,ADAM)对AZAs结构上的羧酸基团进行衍生化,可应用LC-FLD进行检测。由于该方法操作复杂,目前应用较少。AZAs属于脂溶性贝类毒素,自2015年欧盟全面废止小鼠生物检测方法,已改用了包括3种AZAs的脂溶性贝类毒素目标物筛查方法[36]——液相色谱串联质谱检测方法[23, 37-38]。该方法已全面应用于贝类毒素的日常监测工作,与小鼠生物法检测结果一致性约为93%,满足常规检测要求。方法灵敏度高,检出限为40 μg/kg(以AZA1计),远低于限量值。贝类样品经过两次甲醇提取定容后,直接进样测定,基质曲线外标法定量。 串联质谱检测方法在实际应用过程中,主要存在的不足包括:贝类海产品及其制品基质较为复杂,易出现干扰或者假阳性现象;甲醇提取过程中,AZAs部分发生的甲基化反应,给检测结果造成一定偏差;质谱目标物筛查方法,仅监控3种目标物(AZA1~3),种类较少。另因其方法局限性、标准品缺失、毒性当量因子换算引入的误差[39]等问题的存在,致使目前的贝类毒素安全监控很大程度上未能切实保证消费者的食用安全。目前针对前处理过程的方法研究包括QuECHERS[40]、固相萃取柱净化[38]等方法,可有效降低贝类基质中的干扰物质,显著提高方法的灵敏度和稳定性。而贝类中AZAs的危害程度和风险大小整体取决于全部AZA代谢产物的残留程度与毒性强度,而贝类毒素的复合污染情况也愈加严重,因此生物毒素高通量多因子及其代谢产物检测方法尤为重要。 高分辨串联质谱如线性离子阱、静电场轨道阱以及飞行时间高分辨质谱[41],在多毒素筛查、标准品的制备[42]、代谢产物的发掘和结构鉴定等方面均有广泛应用。2008年,Rehmann等[19]使用超高效液相色谱串联质谱法确定了AZA12~32的结构。近年来,质谱检测与核磁检测联合应用于多种新型结构鉴定。基于核磁共振检测技术与高分辨串联质谱同时鉴定新型毒素AZA36和AZA37[43]结构,且两种毒素的T细胞毒性测试显示其毒性仅比AZA1分别低约6和3倍。多种质谱技术的结合(包括线性离子阱质谱、飞行时间质谱和静电场轨道阱组合)分析定性产毒藻中新型AZAs[37],包括AZA54至AZA58等。 AZAs是由海洋微藻产生的一类藻毒素(phyctoxins),主要的产毒藻属为环胺藻Azadiniumspp.(约为11 ~20 μm)和Amphidomaspp.(未定中文名)。AZAs产毒藻细胞非常小,在普通的光学显微镜下极易被忽略,并且不是常规分子监控手段的目标物,直至1996年才首次确认并鉴别出AZAs产毒藻。目前,Azadiniumspp.的分离鉴别技术较为完善,多种新型检测与赤潮监测技术已被多方采用。如应用基因探针技术,结合qPCR(quantitative polymerase chain reaction)与FISH(fluorescence in situ hybridization)可定向检测Azadiniumspp.[44],方法精准可靠且适用性强。但这一新型检测技术还不能区分产毒/无毒藻种,仅用于藻种鉴别与定量分析。在过去的五年间,全球范围内又有多达十余种新型AZAs产毒藻被发现[45]。这一现象即表明AZAs的全球化发展趋势,同时由于产毒藻的多样性尚有待完善,因此目前AZAs的全球分布情况仍不十分清晰。 目前,已鉴别出AZAs主要产毒藻株包括A.spinosum,A.obesum,A.poporum,A.polongum,A.caudatum,A.dexteroporum[46]以及Amphidomalanguida[47-48]7大类(图2)。不同产毒藻株间产毒性状具有显著差异,依据产毒藻的基因序列和核酸类型分为核糖A、B和C共3种。其中,欧洲和新西兰海域的产毒藻A.spinosum属于核糖A型,而来源于韩国、美国和阿根廷海域产毒藻A.poporum属于核糖B或者C型,比较而言,A.poporum分布更为广泛。除了不同藻株间的产毒性状差异,产毒藻的产毒情况还受环境条件的影响。A.spinosum对环境和营养条件中的温度最为敏感,最适温度为18~22 ℃。低温条件下藻细胞产毒能力更强,如10 ℃时产毒为220 fg/cell[49],为18~26 ℃时产毒能力的20余倍。分离自中国南海海域的A.poporum[50]优势株AZDY06,主要产毒为AZA2,受温度条件影响单细胞最高产毒达40 fg/cell,其他营养条件如培养介质、氮源等对生长与产毒性状不存在显著影响。 图2 AZAs产毒藻光学显微镜(上层)和电学显微镜(下层)结构图(比例尺=5 μm)[45-46]Fig.2 Light microscopy (upper panel) and electron microscopy (lower panel) micrographs of species of Azadinium and Amphidoma languida (Scale bars=5μm)[45-46] 赤潮的爆发以及贝类毒素的产生,具有一定的时间性和地域性分布规律。其中,温度是海洋浮游植物现存量和群落结构最重要的影响因素,可以在不同时空间尺度上调控赤潮爆发与生物演替[51]。除了适宜的海水温度,近海岸带的作用和内部洋流涌动频繁是藻类赤潮爆发和生物体毒素蓄积的主要影响因素。欧洲的爱尔兰地区为主要的具刺环胺藻A.spinosum赤潮爆发地区,2012年曾爆发目前国际上可观测到最大规模、最大范围的赤潮[44]。据该地区过去11年的具刺环胺藻监控数据显示,其赤潮爆发期多集中在秋冬季节,且冬季双壳贝类中AZAs的积累量[52]更高。地域上,爱尔兰南部城市的毒素富集水平、频率以及维持时间都较其他区域长(图3)。由此可见,温度是影响AZAs产毒藻生长的首要因素,低温环境更适宜具刺环胺藻的生长,且分布呈现明显的地域性特点。 全球多个国家已相继制定AZAs的限量并开展日常监控。主要采用的手段是定期采集贝类和产毒藻样品,以分析产毒藻密度,设定分级预警方案,并以贝类基质中的AZAs含量控制贝类的市场准入。而AZAs的监控中产毒藻和贝类毒素的监控主要存在以下不足:首先,贝类累积的毒性水平与产毒藻的毒性大小、密度和摄食周期有直接关系,故仅以产毒藻的细胞密度作为安全等级评判指标是不合理的;其次,以产毒藻密度为风险等级评价指标,而AZAs产毒藻的多样性尚有待完善[45],导致整体风险性被远远低估;再次,目前监控方式从采样到出具检测结果至少需要一周时间,时效性较差。为了更有效地监控AZAs及其产毒藻,结合时间、空间因素,制定合理的监控计划是保障消费者食用安全的有效前提。同时,需加快多种新型毒素监控手段的研究和应用,以应对多种毒素产毒藻复合爆发和毒素伴生的污染现状。 图3 2002—2012年度爱尔兰海域贻贝(Mytilus sp.)中AZAs(μg·g-1,以AZA1计)的地域与含量分布[29]Fig.3 Distribution and concentration of AZA toxins (μg·g-1,AZA1-eq.) in Irish mussels (Mytilus sp.) between 2002—2012[29] AZAs在多种海洋生物如双壳贝类、龙虾以及鱼体内均可蓄积,没有明显的种属趋向性。但有毒藻密度、毒性大小和暴露时间总体决定生物体内毒素的蓄积水平。由于双壳贝类的滤食特性,使产毒藻中的毒素蓄积入内脏[18]等组织器官,也可以通过鳃将水体中溶解的毒素富集[52],因此双壳贝类中蓄积的毒素含量较其他水生生物更高,整体危害性更强。双壳贝类对具刺环胺藻的蓄积代谢动力学研究的结果表明,贝类对于AZAs的响应机制非常迅速,产毒藻暴露3 h后即检出高比例后代谢产物,包括AZA17[53]、AZA19和AZA7~10,暴露6 h后贻贝体内的毒素蓄积含量即超过限量值,最高达200 μg/kg[10]。AZAs在贝类体内代谢速率较慢,一般在30 d的代谢周期,可产生多达30余种AZA反应性代谢产物[10,23](图4),最高达毒素总量的50%,且其他代谢物(如AZA17和AZA19)的残留程度与毒性强度[53]均强于AZA1。研究表明,不同贝类对AZAs的蓄积敏感性存在明显差异[54],主要表现为AZAs在紫贻贝中的蓄积能力最强,扇贝次之,而在牡蛎、蛤蜊中蓄积含量较低[14]。 图4 贻贝中AZA代谢产物的转化路径[23]Fig.4 Transformation pathway of AZA metabolites in M.edulis[23] 不同于DSTs与PSTs具有组织差异性的特点[55],AZAs在双壳贝类各组织器官中的分布相对平均,除了常规在内脏团中的蓄积,在其他组织中也均有较高浓度的分布。如贻贝中AZAs在各组织间的分布为内脏(60.6%),鳃(12.0%)和其他可食组织(27.4%)[56]。AZAs在贻贝(M.edulis)与扇贝中的蓄积差异性主要表现为蓄积毒素的种类和各组织间的毒素分布不同。同一生长条件下,贻贝内脏中蓄积的毒素为AZA1,而扇贝中主要为AZA2,仅有少量AZA1分布;贻贝其他组织中检出20%~30%比例的毒素含量,包括AZA2、AZA3和AZA6,而扇贝其他组织中AZAs含量较低。双壳贝类对产毒藻中毒素的蓄积和代谢能力受多方面因素影响,其中清滤率和滤过率[51]为主要影响因素。当贝类体内蓄积毒素超过限量后,贝类即通过降低滤食率和提高代谢速率的方式,以降低体内的毒素含量。通常代谢产物的毒性显著降低,但部分代谢产物(如AZA6、AZA17和AZA19[29])毒性较高,影响AZAs整体毒性水平[25]。 目前,AZAs在贝类体内的传递途径、代谢动力学以及蓄积过程研究尚处于起步阶段。一般来说,贝类毒素危害形成及风险程度主要受两个过程的影响。其一是外源过程,指的是贝类毒素由产毒藻经食物链传递到生物组织过程,主要影响因素包括产毒藻(种类、密度和毒素含量)和生物品种(摄食选择性、摄食能力等),如同等条件下,贻贝对贝类毒素的蓄积能力远高于其他贝类。其二是内源过程,贝类毒素作为一种外源性有毒物质,刺激生物体的自我保护反应,主要通过转化、络合及排出3个过程,将贝类毒素代谢成低毒或无毒化学结构,完成生物的代谢解毒过程。目前多种AZAs被分离鉴定,但其毒力当量因子仍未知[39]。因此,贝类毒素的危害程度和风险大小总体取决于各种代谢产物的残留能力、毒性大小、靶器官等,这也是国际社会对限量标准进行制修订中需重点参考的因素。 作为世界最大的贝类生产国家,贝类毒素污染已成为影响中国贝类产业健康发展的重要问题,因此加强贝类毒素的监控与监管,将贝类毒素风险控制在生产前端变得刻不容缓。随着监控与检测技术的发展,AZAs产毒藻鉴别与AZAs代谢产物甄别方法已取得一定进展。而贝类中的AZAs最高富集含量与产毒藻之间的时间空间分布关系仍不清楚,这也是目前单一产毒藻监测方式不足以有效管控该毒素的关键。使用遥感监测大规模的赤潮藻[21];应用新型分子探测技术分离鉴别产毒藻;优化检测更多藻毒素并且拥有更低的检测限的最新ELISA试剂盒,逐步完善野外检测用的快速筛选工具和传感器设备,是提升中国贝类毒素研究能力和技术水平,确保贝类产业健康可持续发展的根本保障。 [1] 周名江, 于仁成, 雷坤. 我国近海的富营养化及其生态环境问题: 中国海洋可持续发展的生态环境问题与政策研究[C]// 北京:中国环境与发展国际合作委员会, 2010. [2] Li A, Ma J, Cao J, et al. Toxins in mussels (Mytilusgalloprovincialis) associated with diarrhetic shellfish poisoning episodes in China[J]. Toxicon, 2012, 60(3):420-425. [3] Li A, Sun G, Qiu J, et al. Lipophilic shellfish toxins inDinophysiscaudatapicked cells and in shellfish from the East China Sea[J]. Environ Sci Pollut R, 2015, 22(4):3116-3126. [4] Wu H, Yao J, Guo M, et al. Distribution of marine lipophilic toxins in shellfish products collected from the Chinese market[J]. Mar Drugs,2015,13(7):4281-4295. [5] 刘仁沿, 梁玉波, 刘磊,等. 液相色谱结合串联质谱方法研究中国沿海贝类中脂溶性藻毒素的种类结构和分布规律[J]. 生态环境学报, 2014, 23(8):1320-1326. [6] EFSA. Opinion of the scientific panel on contaminants in the food chain on a request from the European Commission on marine biotoxins in shellfish-azaspiracids[J]. EFSA J, 2008, 723:1-52. [7] Furey A, O’Doherty S, O’Callaghan K, et al. Azaspiracid poisoning (AZP) toxins in shellfish: toxicological and health considerations[J]. Toxicon, 2010, 56(2):173-190. [8] 谭志军, 吴海燕, 郭萌萌,等. 脂溶性贝类毒素安全评价与检测技术研究进展[J]. 中国水产科学, 2013, 20 (2):467-479. [9] Salas R, Tillmann U, John U, et al. The role ofAzadiniumspinosum(Dinophyceae) in the production of azaspiracid shellfish poisoning in mussels[J]. Harmful Algae, 2011, 10(6):774-783. [10] Jauffrais T, Marcaillou C, Herrenknecht C, et al. Azaspiracid accumulation, detoxification and biotransformation in blue mussels (Mytilusedulis) experimentally fedAzadiniumspinosum[J]. Toxicon, 2012, 60(4):582-595. [11] Jiang T, Xu Y, Li Y, et al.Dinophysiscaudatagenerated lipophilic shellfish toxins in bivalves from the Nanji Islands, East China Sea[J]. Chin J Oceanol Limn, 2014, 32(1):130-139. [12] Li X, Li Z, Chen J, et al. Detection, occurrence and monthly variations of typical lipophilic marine toxins associated with diarrhetic shellfish poisoning in the coastal seawater of Qingdao City, China[J]. Chemosphere, 2014, 111:560-567. [13] Lin C, Liu Z, Tan C, et al. Contamination of commercially available seafood by key diarrhetic shellfish poisons along the coast of China[J]. Environ Sci Pollut R, 2015, 22(2):1545-1553. [14] Krock B, Tillmann U, Witt M, et al. Azaspiracid variability ofAzadiniumpoporum(Dinophyceae) from the China Sea[J]. Harmful Algae, 2014, 36:22-28. [15] Gu H, Luo Z, Krock B, et al. Morphology, phylogeny and azaspiracid profile ofAzadiniumpoporum(Dinophyceae) from the China Sea[J]. Harmful Algae, 2013, 21/22:64-75. [16] 姚建华, 谭志军, 周德庆,等. 液相色谱-串联质谱法检测贝类产品中的原多甲藻酸贝类毒素[J]. 色谱, 2010, 28(4):363-367. [17] 李爱峰, 韩刚, 于仁成. 原多甲藻酸贝类毒素的研究进展[J]. 中国水产科学, 2008, 15 (1):183-187. [18] Jauffrais T, Kilcoyne J, Herrenknecht C, et al. Dissolved azaspiracids are absorbed and metabolized by blue mussels (Mytilusedulis)[J]. Toxicon, 2013, 65:81-89. [19] Rehmann N, Hess P, Quilliam M A. Discovery of new analogs of the marine biotoxin azaspiracid in blue mussels (Mytilusedulis) by ultra-performance liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2008, 22(4):549-558. [20] Kittler K, Preiss-Weigert A, These A. Identification strategy using combined mass spectrometric techniques for elucidation of Phase I and Phase IIinvitrometabolites of lipophilic marine biotoxins[J]. Anal Chem, 2010, 82(22):9329-9335. [21] 吴海燕, 郭萌萌, 赵春霞,等. 液相色谱-串联质谱法筛查原多甲藻酸毒素及其代谢产物[J]. 色谱, 2016, 34(4):401-406. [22] Mccarron P, Kilcoyne J, Miles C O, et al. Formation of azaspiracids-3, -4, -6, and -9 via decarboxylation of carboxyazaspiracid metabolites from shellfish.[J]. J Agric Food Chem, 2009, 57(1):160-169. [23] Kilcoyne J, McCarron P, Hess P, et al. Effects of heating on proportions of azaspiracids 1-10 in mussels (Mytilusedulis) and identification of carboxylated precursors for azaspiracids 5, 10, 13, and 15[J]. J Agric Food Chem, 2015, 63(51):10980-10987. [24] Jauffrais T, Kilcoyne J, Séchet V, et al. Production and isolation of Azaspiracid-1 and -2 fromAzadiniumspinosumculture in pilot scale photobioreactors[J]. Mar Drugs, 2012,10(12):1360-1382. [25] Toyofuku H. Joint FAO/WHO/IOC activities to provide scientific advice on marine biotoxins[J].Mar Pollut Bull, 2006,52(12):1735-1745. [26] EFSA. Scientific opinion of the panel on contaminants in the food chain on a request from the european commission on marine biotoxins in shellfish-summary on regulated marine biotoxins[J]. EFSA J,2009,1306:1-23. [27] FSAI. Risk assessment of azaspiracids in shellfish. A report of the scientific comittee of the food safety authority of Ireland(FSAI)[M]. Dublin, Ireland: Food Safety Authority of Ireland, 2006. [28] FAO. Report of the Joint FAO/IOC/WHO ad hoc expert consultation on biotoxins in molluscan bivalves[R]. Rome, Italy: Food and Agriculture Organization, 2005. [29] Hess P, Twiner M J, Kilcoyne J, et al. Azaspiracid Toxins: toxicological profile[M]//Gopalakrishnakone P, Haddad V, Tubaro A, et al. Marine and freshwater toxins. Berlin:Springer Netherlands, 2016:169-191. [30] Pelin M, Sosa S, Brovedani V, et al. In vitro effects of three azaspiracid analogues on hepatocytes[J]. Toxicon, 2016, 116:85-86. [31] Chevallier O P, Graham S F, Alonso E, et al. New insights into the causes of human illness due to consumption of azaspiracid contaminated shellfish[J]. Sci Rep(UK),2015,5:9818-9826. [32] Doerr B, O’Halloran J, O’Brien N, et al. Investigation of the genotoxic potential of the marine biotoxins azaspiracid 1-3[J]. Toxicon, 2016, 121:61-69. [33] Aune T, Espenes A, Aasen J A, et al. Study of possible combined toxic effects of azaspiracid-1 and okadaic acid in mice via the oral route[J]. Toxicon, 2012, 60(5):895-906. [34] Ferron P J, Dumazeau K, Beaulieu J F, et al. Combined effects of lipophilic phycotoxins (okadaic Acid, azapsiracid-1 and yessotoxin) on human intestinal cells models[J]. Toxins (Basel), 2016, 8(2):50-63. [35] Samdal I A, Lovberg K E, Briggs L R, et al. Development of an ELISA for the detection of azaspiracids[J]. J Agric Food Chem, 2015, 63(35):7855-7861. [36] European Reference Laboratory for Marine Biotoxins. Work Programme for the European Reference Laboratory for Marine Biotoxins[R]. Spain: European Union Reference Laboratory for Marine Biotoxins, 2015. [37] Rossi R, Dell Aversano C, Krock B, et al. MediterraneanAzadiniumdexteroporum(Dinophyceae) produces six novel azaspiracids and azaspiracid-35: a structural study by a multi-platform mass spectrometry approach[J]. Anal Bioanal Chem, 2017, 409(4):1121-1134. [38] Wu H, Guo M, Tan Z, et al. Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks[J]. J Chromatogr A, 2014, 1358:172-180. [39] Botana L M, Hess P, Munday R, et al. Derivation of toxicity equivalency factors for marine biotoxins associated with bivalve molluscs[J]. Trends Food Sci Tech, 2017, 59:15-24. [40] 方兰云, 姚浔平, 王立,等. 固相萃取-高效液相色谱-串联质谱法测定双壳贝类中扇贝毒素和原多甲藻酸[J]. 中国卫生检验杂志, 2014, 24 (16):2316-2320. [41] 韩深, 刘鑫, 李建辉,等. 超高压液相色谱-高分辨质谱快速筛查和确证食用贝类中多种原多甲藻酸贝类毒素[J]. 食品科学, 2014, 35(4):116-121. [42] Canas I R, O’Callaghan K, Moroney C, et al. The development of a rapid method for the isolation of four azaspiracids for use as reference materials for quantitative LC-MS-MS methods[J]. Anal Bioanal Chem, 2010, 398(3):1477-1491. [43] Krock B, Tillmann U, Potvin É, et al. Structure elucidation and in vitro toxicity of new azaspiracids isolated from the marine dinoflagellateAzadiniumpoporum[J]. Mar Drugs, 2015, 13(11):6687-6702. [44] Toebe K, Joshi A, Messtorff P, et al. Molecular discrimination of taxa within the dinoflagellate genusAzadinium, the source of azaspiracid toxins[J]. J Plankton Res, 2013, 35(1):225-230. [45] Luo Z, Krock B, Mertens K N, et al. Morphology, molecular phylogeny and azaspiracid profile ofAzadiniumpoporum(Dinophyceae) from the Gulf of Mexico[J]. Harmful Algae, 2016, 55:56-65. [46] Urban T, Salas R, Jauffrais T, et al. AZA: the producing organisms-biology and trophic transfer[M]//Botana L M. Seafood and freshwater toxins: pharmacology, physiology, and detection. Boca Raton:CRC Press, 2014:773-798. [47] Tillmann U, Gottschling M, Nézan E, et al. First record ofAzadiniumdexteroporumandAmphidomalanguida(Amphidomataceae, Dinophyceae) from the Irminger Sea off Iceland[J]. Mar Biodivers Rec,2015,8(e142):1-10. [48] Tillmann U, Jaén D, Fernández L, et al.Amphidomalanguida(Amphidomatacea, Dinophyceae) with a novel azaspiracid toxin profile identified as the cause of molluscan[J]. Harmful Algae, 2017, 62:113-126. [49] Jauffrais T, Séchet V, Herrenknecht C, et al. Effect of environmental and nutritional factors on growth and azaspiracid production of the dinoflagellate Azadinium spinosum[J]. Harmful Algae, 2013, 27:138-148. [50] Li A, Jiang B, Chen H, et al. Growth and toxin production ofAzadiniumpoporumstrains in batch cultures under different nutrient conditions[J]. Ecotox Environ Safe, 2016, 127:117-126. [51] 窦勇, 高金伟, 时晓婷,等. 2000—2013年中国南部近海赤潮发生规律及影响因素研究[J]. 水生态学杂志, 2015, 36(3):31-37. [52] Jauffrais T, Kilcoyne J, Herrenknecht C, et al. Dissolved azaspiracids are absorbed and metabolized by blue mussels (Mytilusedulis)[J]. Toxicon, 2013, 65:81-89. [53] Jauffrais T, Contreras A, Herrenknecht C, et al. Effect ofAzadiniumspinosumon the feeding behaviour and azaspiracid accumulation ofMytilusedulis[J]. Aquat Toxicol, 2012, 124-125:179-187. [54] Lopez-Rivera A, O’Callaghan K, Moriarty M, et al. First evidence of azaspiracids (AZAs): a family of lipophilic polyether marine toxins in scallops (Argopectenpurpuratus) and mussels (Mytiluschilensis) collected in two regions of Chile[J]. Toxicon, 2010, 55(4):692-701. [55] Blanco J, Franco J M. PSP detoxification kinetics in the mussel Mytilus galloprovincialis. One- and two-compartment models and the effect of some environmental variables[J]. Mar Ecol Prog Ser, 1997, 158 (1):165-175. [56] O’Driscoll D, Skrabakova Z, James K J. Confirmation of extensive natural distribution of azaspiracids in the tissue compartments of mussels (Mytilusedulis)[J]. Toxicon, 2014, 92 (92):123-128.2 氮杂螺环酸毒素检测技术
2.1 生物检测方法
2.2 液相色谱检测方法
3 氮杂螺环酸毒素的分布现状
3.1 全球化分布趋势
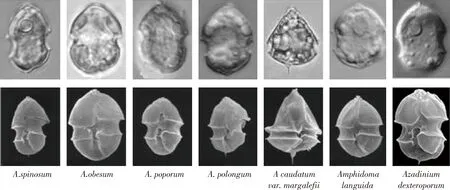
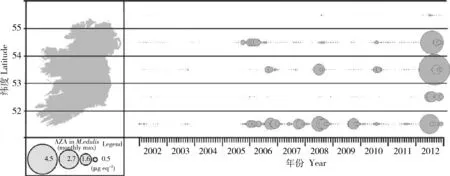
3.2 时空分布规律与监控手段
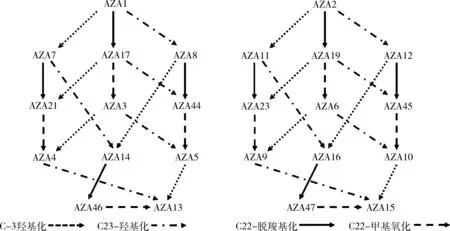
3.3 生物体中蓄积代谢规律
4 结语

