手术治疗稳定期肺结核并发食管下段癌的效果分析
林存红
近年来,肺结核并发恶性肿瘤(以肺癌为多、食管癌相对较少)的报道日渐增多。食管癌的治疗普遍采用外科治疗、放射治疗、化学治疗和综合治疗,而手术是治疗食管癌的首选方法。由于长期结核感染可造成患者心肺功能受损,出现肺部和胸膜腔不同程度的损伤,使大量患者无法耐受食管癌手术治疗;且由于手术治疗对机体免疫力等方面的破坏也易导致结核病的进展或播散,故肺结核并发食管癌的治疗选择成为目前临床上比较棘手的问题。本研究回顾性分析稳定期肺结核并发食管下段癌患者行手术治疗与单纯下段食管癌患者行常规行手术治疗的临床资料,以期为肺结核并发食管下段癌患者的手术治疗提供临床参考。
资料和方法
1. 临床资料:收集2009年3月至2014年3月泰安市肿瘤(结核病)防治院收住入院的34例稳定期肺结核并发食管下段癌患者(A组)行手术治疗的临床资料,以及同期收住入院的310例单纯食管下段癌患者(B组)常规行手术治疗的临床资料。两组患者年龄范围为50~75岁,术前均无血红细胞沉降率(ESR)异常和发热。A组患者左肺结核8例、右肺结核21例、双侧肺结核5例。所有患者心脏功能正常,术前纠正、调整患者的贫血等营养相关指标以达到手术治疗标准。A组和B组并发慢性阻塞性肺疾病(简称“慢阻肺”)的主要表现为慢性咳嗽咳痰,偶有活动后气促,肺功能分级检查为1级或2级的患者术前3 d开始应用抗生素,并给予气道雾化吸入。A、B两组患者除慢阻肺并发率差异有统计学意义外,其他临床资料两组间比较差异均无统计学意义(表1)。
2.纳入及排除标准:(1)稳定期肺结核患者的纳入及排除标准:结合患者疾病史、肺结核治疗史及本次就诊时的实验室检查及影像学检查资料,依据《肺结核诊断和治疗指南》[1],严格筛选肺结核门诊复查为无活动性肺结核[2],纳入结核空洞消失、病灶稳定、痰菌持续阴转(1次/月)达6个月以上,或空洞仍然存在、痰菌连续阴转1年以上的稳定期肺结核患者[3];排除活动性肺结核或有明确肺外结核并发食管癌的患者。(2)食管癌患者的纳入及排除标准:严格选择新发食管下段癌患者,以便所有患者均可行左胸低位切口径路食管-胃吻合手术,吻合口均位于胸内。患者均经胃镜活检-病理检查及按照食管癌国际TNM分期标准[4]而确诊,明确诊断为可行手术治疗的食管下段癌,分期为Ⅰ~Ⅲ期;排除食管中、上段癌及食管-胃结合部癌。

表1 两组患者一般临床资料的比较
注A组为肺结核并发食管下段癌患者;B组为单纯食管下段癌患者
3.手术可行性评估:所有患者手术可行性评估严格按照《食管癌规范化诊治指南》[5]进行,尤其应重点评估心、肺、肝、肾等重要脏器功能情况及储备情况;并通过胸部X线摄影及CT扫描评估胸腔有无积液及粘连,仅作为开胸术前参考,不作为手术可行性判定标准。术前应加强心肺功能的锻炼,如戒烟、快走、吹气球、练习咳嗽咳痰、爬楼梯等,增加其对麻醉和手术的承受能力,以利于术后恢复。
4.手术方法:所有患者均采用双腔气管插管、静脉复合麻醉。手术基本方式均为左侧低位径路开胸食管癌切除、胸内食管-胃吻合术,术中胸胃行减容处理(是食管癌术中近乎常规的术中处置,指将上提到胸腔准备与食管作吻合的胃作一缩窄以减小容积,以期减少胸腔胃对心肺的压迫和胸腔占位效应)。手术过程顺利。全麻清醒后6~8 h开始雾化吸入治疗,术后3 d内常规镇痛处理。A组患者在术前3 d至术后2周期间静脉滴注异烟肼注射液(0.4 g/次,1次/d)、利福平注射液(0.45 g/次,1次/d),然后口服异烟肼片(0.4 g/次,1次/d)、利福平片(0.45 g/次,1次/d)至术后2个月。同时,所有患者从术前3 d至术后离院期间均常规静脉滴注胸腺五肽注射液(1 mg/次,1次/d)。
5.观察指标:(1)术中指标。对比分析两组患者术中资料,包括手术时间、出血量、胸腔粘连、手术切除率(根治性切除和姑息性切除)等方面的差异,以评价A组患者在手术切除方面的可行性及安全性。(2)术后指标。对比分析两组术后资料,包括术后低氧血症、延迟发热、心律失常、肺部并发症(主要包括肺炎、肺不张、胸腔积液和呼吸衰竭)、心律失常(主要包括窦性心动过速、房性早搏、室性早搏、心房颤动等)、切口不愈合、吻合口瘘的形成、围手术期死亡率等方面的差异,并重点观察A组患者术后2个月内有无结核病进展及播散情况,以评价术后并发症及安全性。(3)预后指标。对比分析两组患者术后1、2、3年生存率差异,以评价预后情况。

结 果
1. 术中情况分析:A组患者的手术时间、出血量、手术切除率与B组比较,差异均无统计学意义(P值均>0.05);两组患者仅胸膜粘连的发生率差异有统计学意义(P<0.05),详见表2。
2.术后情况分析:A组患者术后低氧血症、延迟发热、肺部并发症的发生率明显高于B组(P值均<0.05);但在心律失常、切口不愈、吻合口瘘、围手术期死亡的发生率差异均无统计学意义(P值均>0.05)。A组患者中7例患者术后7~10 d开始出现短时(历时约1周左右)的ESR增快,可达30~55 mm/1 h,后随体温恢复(1周后)而降至正常,详见表3。术后随访A组患者2个月,均未发生结核病进展及播散情况。
3.术后生存率情况:A组患者较B组1、2年生存率差异均无统计学意义(P值均>0.05)。两组3年生存率差异有统计学意义(P<0.05),详见表4。
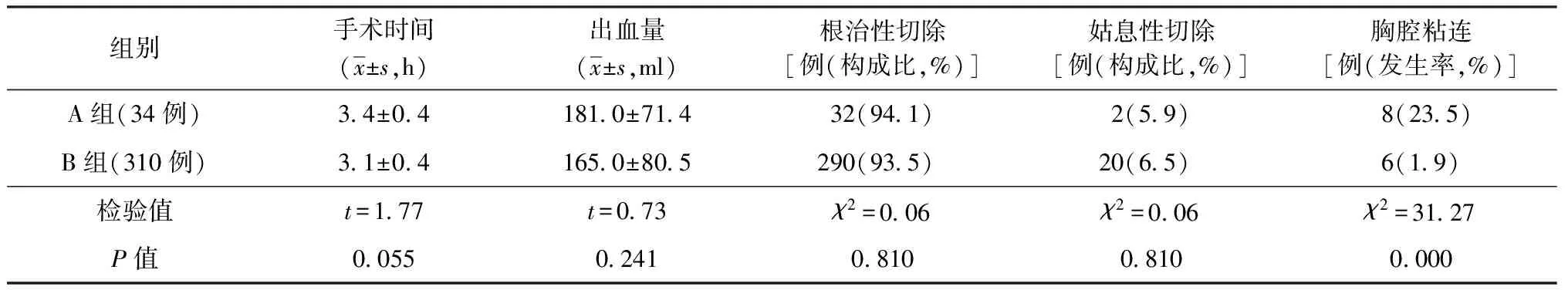
表2 两组患者术中资料的比较
注A组为肺结核并发食管下段癌患者;B组为单纯食管下段癌患者
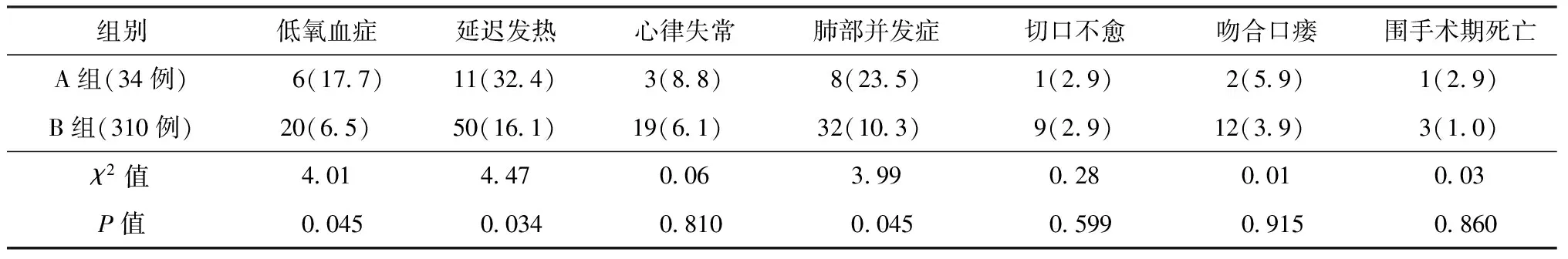
表3 两组患者术后资料的比较
注A组为肺结核并发食管下段癌患者;B组为单纯食管下段癌患者;表中括号外数值为“患者例数”,括号内数值为“发生率(%)”

表4 两组患者术后生存情况比较
注A组为肺结核并发食管下段癌患者;B组为单纯食管下段癌患者;表中括号外数值为“患者例数”,括号内数值为“生存率(%)”
讨 论
近年来,肺结核和食管癌的发病率居高不下,肺结核早已成为发病率最高的慢性呼吸道传染性疾病,我国2010年涂阳肺结核患者的发病率为66/10万[6];食管癌也是临床上常见的恶性肿瘤,2012年发病率达21.17/10万[7],且两病并发的情况也越来越多,严重威胁着人们的健康和生命。同时,肺结核和食管癌又都是消耗性疾病,两者均与机体免疫低下密切相关[8],肺结核患者的细胞免疫功能受损[9]可能成为食管癌发生的一个内因,而食管癌本身也可降低患者的免疫力,故两者可能存在相互促进的关系。但可能由于医院专业设置的原因,临床相关报道较少。
由于食管癌手术治疗对患者的心肺功能有较高要求,而肺结核对肺组织造成慢性损伤进一步影响心肺功能,使其对食管癌手术的可行性、安全性,以及预后造成极大的负面影响;同时也可使肺结核的病情发生进展甚至恶化,故二者并发时手术治疗的选择成为临床难题。另外,临床上对活动性肺结核并发食管癌患者需要择期或限期手术治疗均持极为审慎的态度,甚至认为属于手术禁忌证,导致很多医生对稳定期肺结核并发食管癌的手术治疗心存疑虑,故文献报道少见。笔者认为稳定期肺结核肺内病变及其对患者心肺功能的影响比较稳定,此类患者并发食管癌时在严格评估下首选手术治疗具有可行性[10]。本研究严格筛选稳定期肺结核并发食管下段癌手术治疗患者,强调术前进行抗结核药物治疗,积极认真做好术前评估与准备;选择肺功能检查肺功能分级正常或1、2级、心脏功能正常者;术前纠正调整患者贫血等营养指标,以符合食管癌手术的基本要求;同时血糖、血压控制达标即可安排手术。
一、术中安全性问题
本研究结果显示,A组术前慢阻肺的发生率较B组高,且在开胸术中观察到胸腔粘连明显多于B组,差异均有统计学意义(P值均<0.05)。考虑一是因为长期肺结核对肺组织造成的不同程度的损伤,二是长期肺结核常造成胸膜腔受累,导致A组患者发生慢阻肺及胸膜腔粘连者较B组多见。但由于本研究所选食管癌患者均为食管下段癌,手术入路均为左胸低位入路(Ⅶ肋间),手术对胸膜腔粘连游离范围要求不高,且粘连多为条索状及膜性粘连,胼胝性粘连较少,相对易于分离[11];同时也因为术前针对并发慢阻肺患者进行了预防性及治疗性处置,所以对A组患者手术时间、出血量、手术切除率影响均不大,与B组差异均无统计学意义(P值均>0.05)。既说明了两组患者食管癌相关资料的可比性,亦证明了术前两组在食管癌分期、术式、手术难度等术中安全性方面评估的相似性,提示稳定期肺结核食管癌患者从食管癌切除角度看,术中情况与单纯食管下段癌患者具有相似的可行性及安全性,即使在稳定期肺结核患者并发慢阻肺及胸腔粘连的情况下。
二、术后安全性问题
术后并发症直接影响到患者的术后安全问题,对于肺结核并发食管癌患者,术后结核病活动或播散情况、低氧血症,以及与食管癌术后密切相关的心律失常、肺部并发症、胸腔感染、吻合口瘘等并发症均是术后需要高度关注的重点问题。研究结果显示,A组患者术后一般并发症如低氧血症、肺部并发症的发生率明显升高,术后延迟低热、ESR升高情况突出,但食管癌相关严重并发症,如手术死亡、吻合口瘘、心律失常等并发症的发生率并未增加,且未发生结核病进展及播散情况,手术安全性仍然较好。
1.吻合口瘘、围手术期死亡率、切口并发症问题:本研究显示,A、B两组上述指标差异均无统计学意义(P值均>0.05),提示稳定期肺结核并发食管下段癌行手术治疗对组织愈合并无明显影响,有着较好的安全性,心肺方面并发症(低氧血症、肺部并发症等)的增加亦未引起死亡率的增加。这可能与本研究选择患者均为食管下段癌有关,因为下段食管癌手术对患者心肺功能要求低于中上段食管癌,手术创伤也小,术中处理对胸膜腔及肺脏的影响也相对较小,从而提升了手术的安全性;也可能与A组患者入组筛选严格,患者例数较少有关,有待大样本临床进一步研究。
2.围手术期结核病稳定性问题:肺结核并发食管下段癌患者行手术治疗后,围手术期内结核病的稳定性及其对食管癌术后的顺利恢复至关重要。本研究中A组患者术后均未发生结核病进展及播散情况,说明对稳定期肺结核患者进行有较大创伤的手术具有良好的安全性,可为此类患者的手术治疗提供依据。但是值得注意的是,A组7例患者术后7~10 d开始出现了体温与ESR的明显异常,持续时间1周左右;一方面提示食管癌手术创伤对机体造成较大损伤,同时也说明术后禁食、睡眠差、营养消耗等在一定程度上影响了机体的免疫力[12],出现结核病相关临床指标的异常波动;故笔者认为围手术期内的抗结核药物治疗可以有效控制病情进展,阻止结核病的活动性或播散传播。同时,针对结核病患者的免疫功能低下[13],认为免疫支持治疗会起到积极有效的作用[14];故笔者借鉴梁汉成和劳穗华[15]学者的经验,在围手术期内应用了胸腺五肽以提高患者免疫力。
3.肺部并发症问题:食管癌术后肺部并发症是影响手术疗效的重要因素,是多因素协同作用的结果,其发生率为18%~44%,居术后并发症首位[16-18]。肺结核患者术前存在肺功能异常,术后更易发生肺部并发症。黄明芳等[19]研究发现,术前有肺结核病史的患者术后发生肺部并发症的风险是无结核病病史者的2.70倍,提示尽管肺结核进入稳定期,但其对肺脏及胸膜腔造成不同程度的慢性损伤,以及心肺功能等的改变将不可避免地增加了术后肺部并发症的发生率[20-21],应高度重视。本研究中,A组患者肺部并发症的发生率明显高于B组,符合黄明芳等[19]的研究,但对手术治疗的可行性及安全性无明显影响。这可能也与术前对患者进行心肺功能的锻炼、戒烟等相应的个体化干预;术后加强监测、护理,充分供氧,鼓励有效咳嗽;全麻清醒后6~8 h尽早开始雾化吸入[22]和必要时行鼻导管或支气管纤维镜辅助吸痰,保持呼吸道通畅,做深呼吸活动以利于肺复张等措施密切相关。
4. 心律失常等心脏并发症问题:心脏并发症是食管癌术后常见的并发症之一,国内外报道其发生率为13%~47%[23],主要为心律失常,如房性早搏、室性早搏、心房颤动等,但心肌梗死、心力衰竭等严重情况较少见。因心肌及传导系统对低氧血症极为敏感[24],缺氧是引起心律失常的主要原因之一,稳定期肺结核患者均存在不同程度的肺功能减退,术后也会加剧此种情况,缺氧情况较多见。但本研究结果显示,两组在术后心律失常的发生率差异并无统计学意义,可能与A组患者筛选严格、入组样本较少、手术方式及手术部位对胸腔干扰相对较小,以及术后成熟规范的预防性管理有关。
三、生存期问题
本研究显示,在1、2年的生存率上,A组与B组患者比较差异无统计学意义(P值均>0.05),但3年生存率较B组患者明显降低(P<0.05),提示稳定期肺结核并发食管下段癌患者手术治疗的总体预后差于单纯食管癌患者。其原因可能与肺结核和食管癌均为免疫力受损疾病有关,加之肺结核并发食管癌患者常因顾忌结核病播散而不能像单纯食管癌患者那样得到规范化的后续补充治疗(如术后放疗、化疗等),增加了肿瘤复发与转移机会,降低了患者的长期生存率。但因本研究患者例数较少,需扩大样本量进一步研究观察。
综上所述,稳定期肺结核并发食管下段癌患者的手术治疗,虽较单纯食管下段癌患者行常规手术的围手术期处理存在一定困难,但经严格术前筛选并在围手术期内进行规范有效的抗结核药物治疗,可行食管癌根治术,手术安全性较好,肺结核亦无进展及播散,可作为首选有效的治疗方式。
[1] 中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[2] 葛均波,徐永健.内科学.8版. 北京:人民卫生出版社,2013:66.
[3] 陈灏珠.内科学.3版. 北京:人民卫生出版社,1989:83.
[4] Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol, 2010, 17(6):1471-1474.
[5] 中国抗癌协会食管癌专业委员会.食管癌规范化诊治指南.北京:中国协和医科大学出版社,2011.
[6] 中华人民共和国国务院办公厅.“十三五”全国结核病防治规划(国办发[2017]16号).(2017-02-16)[2017-09-10].http://www.nhfpc.gov.cn/bgt/gwywj2/201702/7b2a362da2da4841a 362f8eb36575b67.shtml.
[7] 左婷婷,郑荣寿,曾红梅,等.中国食管癌发病状况与趋势分析.中华肿瘤杂志,2016,38(9):703-708.
[8] 程月娟,陈书长.恶性肿瘤患者合并结核病51例分析.癌症进展杂志,2006,4(5):408-411.
[9] 商勇,陆燕春,解承鑫,等.不同肺结核类型患者细胞免疫功能相关性研究.临床肺科杂志,2017,22 (7):1176-1179.
[10] 赫捷.食管癌综合治疗的现状与展望.中华胃肠外科杂志,2011,14 (9):657-659.
[11] 周中新,姜波,刘京松,等.胸腔镜手术中胸膜腔粘连处理体会.齐齐哈尔医学院学报,2014,35(24):3618-3620.
[12] 李岩,薛江南.食管癌手术对患者细胞免疫功能及应激激素水平影响观察.菏泽医学专科学校学报,2015,27(3):18-19,95.
[13] 王勃,毛晓辉.肺结核患者免疫功能的研究.贵阳:《中国防痨杂志》创刊80周年纪念暨学术会议资料汇编, 2014.
[14] 梁艳,张晓燕,王小美,等.四种结合分枝杆菌增殖期抗原基因抗小鼠结核感染的比较研究.中国防痨杂志,2017,39(2):129-133.
[15] 梁汉成,劳穗华.胸腺五肽对初治结核患者免疫功能以及痰菌阴转率的影响.当代医学,2013,19(3):140-141.
[16] Jiao WJ, Wang TY, Gong M, et al.Pulmonary complications in patients with chronic obstructive pulmonary disease following transthoracic esophagectomy. World J Gastroenterol,2006,12(16): 2505-2509.
[17] 雷程,王海江,尹东,等.689例食管癌切除术后并发症情况分析.中国肿瘤临床,2009,36(18):1040-1043.
[18] D’journo XB, Michelet P, Avaro JP, et al. Respiratory complications after oesophagectomy for cancer. Rev Mal Respir,2008,25(6): 683-694.
[19] 黄明芳,刘德森,潘琪,等.食管癌术后肺部并发症的危险因素分析859例.世界华人消化杂志,2014,22(12):1703-1708.
[20] DeMeester TR, Barlow AP. Surgery and current management for cancer of the esophagus and cardia: Part II. Curr Probl Surg,1988,25(8): 535-605.
[21] Holden DA, Rice TW, Stelmach K, et al. Exercise testing, 6-min walk, and stair climb in the evaluation of patients at high risk for pulmonary resection. Chest,1992,102(6): 1774-1779.
[22] 黄瑞珍.食管癌术后雾化吸入开始时间对患者咳痰的影响.海峡药学,2014,26(12):112-113.
[23] Amar D, Burt ME, Bains MS, et al. Symptomatic tachydy-srhythmias after esophagectomy: incidence and outcome mea-sures. Ann Thorac Surg, 1996,61(5):1506-1509.
[24] Avendano CE, Flume PA, Silvestri GA, et al. Pulmonary complications after esophagectomy. Ann Thorac Surg, 2002,73(3):922-926.

