传统引流联合负压封闭引流技术在复发性软组织肉瘤手术创面中的应用
吴旻昊 蔡林 闫飞飞 孙文超 许可可 谢远龙 邓洲铭 冯帆 雷军*
软组织肉瘤(softtissue sarcoma,STS)是一类起源于中胚层,罕见的原发性恶性肿瘤,占全部软组织肿瘤的5%,成人恶性肿瘤的1%[1]。广泛的边缘切除是软组织肉瘤最重要的治疗手段之一,但由于较低的发病率及非肿瘤专业的外科医师缺乏对软组织肉瘤诊疗的规范化认识,容易导致此类患者在初次就诊时没有得到足够重视,出现切除不彻底而导致局部复发的现象发生[1,2]。此类患者由于肿瘤复发可能需要接受多次手术和放、化疗治疗,期间患者会出现免疫力低下,活动能力下降,重度营养不良等一系列的问题,且机体抵抗力和防御功能明显下降,导致再次手术时创面发生感染或感染后发生脂肪液化的风险大大增加,术后容易出现切口裂开、感染、不愈合。此类伤口由于长时间迁延不愈,组织局部血运及纤维化等因素影响,在临床治疗处理上显得极为棘手[3-5]。负压封闭引流(vacuumsealing drainage,VSD)技术作为一种新型的外科技术,在创面处理方面尤其是作为手术的辅助治疗,大大降低了创面感染、不愈合的发生率,提高了患者的生活质量[2,4]。我院自2015年以来采用传统引流联合负压封闭引流技术治疗复发性软组织肉瘤手术创面18例,取得了良好的疗效,现报道如下。
1 资料与方法
1.1 一般资料
本组男12例,女6例,年龄14~78岁,平均51.2±16.1岁。美国东部肿瘤协作组(EasternCooperativeOncologyGroup,ECOG)评分2分,其中2例患者合并糖尿病,4例患者术前均有不同程度的低蛋白血症,其余无严重基础疾病。肿瘤位于臀部2例,腹股沟4例,大腿13例,小腿2例,其中有3例肿瘤同时累及大腿及同侧腹股沟。均为复发性软组织肉瘤的患者,其中单次术后复发12例(3例曾行术后放疗,2例行化疗),二次肿瘤切除术后复发6例(3例曾行放、化疗,1例曾行化疗)。肿瘤最大径8 cm~16 cm,平均12.3 cm。术后病理诊断均最少在两所省级大型三甲医院的病理科确诊,术后组织病理为骨外骨肉瘤1例,恶性纤维组织细胞瘤3例,横纹肌肉瘤2例,脂肪肉瘤4例,纤维肉瘤5例,滑膜肉瘤1例,平滑肌肉瘤1例,原始神经外胚叶肿瘤1例。
传统引流装置均采用德国美多MEDINORM真空负压引流套件,预抽真空-95Kpa(712.5mmHg),引流管采用硅胶+PVC+硅胶的夹心设计,引流孔以十字交叉方式激光打孔,保证抽吸力度均匀不变。
VSD技术所需材料包括敷料,聚乙烯乙醇水化海藻盐泡沫敷料(Vacuseal)和粘贴薄膜,内含2根多侧孔硅胶引流管、具有单方面透气功能的医用半透膜、三通接头及负压引流装置。负压源为我院中心负压,一般在150 mmHg~350 mmHg(见图1)。

图1,A、B德国美多MEDINORM真空负压引流壶及多孔引流管;C聚乙烯乙醇水化海藻盐泡沫敷料及多侧孔硅胶引流管(武汉维斯第)。
1.2 治疗方法
1.2.1 术前评估
1.2.2 手术治疗
目前软组织肉瘤推荐的手术方式以广泛边缘切除为主,本组患者均采用肿瘤扩大切除或间室切除,以获得广泛的外科边界,术中均将原手术切口或穿刺针道做梭形切除,将瘢痕、硬化的浅层组织切除,尽可能保留软组织覆盖的条件。切除的范围包括肿瘤及反应区以外3cm~5cm的正常组织界面。本组18例,6例患者行肿瘤肌群切除即间室切除,2例臀部肿瘤,分别切除臀大肌及臀大,中肌,其中一例术前行单侧髂内动脉及臀上动脉栓塞,术中均结扎臀上血管及神经,显露坐骨神经并予以保护。4例大腿肿瘤,2例切除内侧肌群,其中1例行腹股沟淋巴结清扫,1例肿瘤侵犯股静脉,予以结扎切除,术后病检示:静脉内可见瘤栓;2例切除后侧肌群,显露坐骨神经,并予以保护;其余12例均行肿瘤的扩大切除,其中2例行腹股沟淋巴结清扫,术后病检提示淋巴结转移。所有患者术中创面均一期闭合,未采用软组织重建,如游离植皮、皮瓣转位等等。所有标本经组织病理学检查,肿瘤各切缘均为阴性。
1.2.3 创面处理
由于此类广泛切除的手术创面较大,切缘不规则,故术后切口均以皮钉缝合器缝合,创腔内置1~4根多孔硅胶负压引流装置,负压为712.5mmHg,称之为“内引流”。创面外采用 VSD覆盖,包括聚乙烯乙醇水化海藻盐泡沫敷料(Vacuseal)和粘贴薄膜,称之为“外引流”。泡沫敷料富有弹性及水分,抗张力强,其内密布小孔,将泡沫敷料按照创面的大小和形态修剪,使得敷料与创面充分接触,不留死腔,再将粘贴薄膜密封创面,薄膜的覆盖范围应该包括泡沫敷料及其周围至少3 cm~5 cm的创缘健康皮肤。持续吸引,负压源为我院中心负压,一般在150mmHg~350mmHg。
1.2.4 术后处理
术后患肢均予以抬高制动,2例臀部肿块的患者建议侧卧或俯卧,观察肢体末梢血供及运动情况。持续监测传统负压壶及VSD的引流量,并予以记录。术后第二天查血常规及肝肾糖,电解质,血沉、CRP等。静脉给予头孢等广谱抗生素,根据生化指标,补充血浆及白蛋白等。术后应保证VSD具有良好负压及密闭性(连接中心负压后可见VSD敷料即刻塌陷,引流管管型明显,没有明显漏气声,说明负压有效,密封效果满意),若封闭不严,应重新封闭。术后5~7天拆除VSD。拆除VSD后观察创面愈合情况,是否肿胀,存在渗出或皮下血肿,感染等情况,定期换药,待传统
应用SPSS Statistics 22.0(IBM公司,美国)统计软件进行数据分析。所有计量资料采用(±s)来表示。两种引流方式引流量的相对应数据采用t检验,P<0.05为差异有统计学意义。
2 结果
18例复发性软组织肿瘤均完整切除,切口长度13.8±5.0(5~25)cm,手术时间159.7±42(87~230)min,出血量568.9±195.4(300~950)mL。一般5~7天拆除泡沫敷料,本组平均6天,传统引流装置在泡沫敷料拆除后,引流量 20 mL/24 h后拔除,平均 46 h,术后传统引流量436.1±189.9(100~ 800)mL,VSD 引流量 544.4±163.7(260~800)mL,两者引流量之间比较,差异无统计学意义(P>0.05)。术后15~20天间断拆除皮钉,其中14例创面均一期愈合,无窦道,感染,脂肪液化等并发症发生,1例患者出现淋巴漏,考虑电刀的过度使用和淋巴结清扫范围过大所致,予以补充血浆,白蛋白,电解质后逐渐好转,2例创面敷料周围出现张力性水泡,经凡士林纱布湿敷,换药后愈合,1例发生切口皮下血肿,经手术切开清创后,再次覆盖VSD后愈合。术后1例患者出现药疹,高热,立即停止所有用药,予以抗过敏治疗之后好转。术后患者住院时间为17±5.1(10~32)天。
全部患者获得随访,平均28.6±9.3(11~47)个月,随访中13例患者无复发,3例患者局部肿瘤复发,并再次行手术切除,2例恶性肿瘤患者因远处转移死亡。典型病例(见图2-3)。引流壶引流量20mL/24h后拔除,即先拆除VSD引流装置,再拔除传统引流壶,保证创面的愈合及引流通畅,减低表皮及皮下愈合延迟的发生率。
1.3 评估标准及随访
观察切口愈合情况,拆除泡沫敷料后每隔2~3天对伤口进行换药,记录伤口愈合时间,住院周期,引流量,是否存在发热,感染,淋巴回流障碍,下肢水肿,静脉血栓,过敏,张力性水泡等并发症。评估患者肢体功能,参照国际骨与软组织肿瘤协会(MSTS)功能评估标准。所有患者根据肢体功能包括6项,疼痛、术后功能整体评价、接受程度、行走时支具使用情况、行走功能和步态,每项5分,总分30分,24~30分为优,18~23为良,12~17分为中,<12分为差。随访观察手术时间,术中出血,术后引流量,创面愈合情况、术后并发症,肢体功能恢复情况以及患者肿瘤学预后等情况。截至2017年6月本组患者平均得分22.2±4.3分,优良率83.3%。
1.4 统计学处理
患者,男,62岁,因右臀部恶性纤维组织细胞瘤术后2月复发入院,术前曾行EI方案化疗。

图2,A-D术前MRI示:右侧臀部软组织结构模糊,内见多发条片状混杂等T1长T2信号影,呈术后改变;另右侧臀中肌深面见一混杂等T1长T2肿块影,边界欠清,大小约50 mm×26 mm;右侧髂前上棘内见长T2信号影,增强示:右侧臀部软组织、右侧髂骨翼及右侧髂骨脊旁肿块呈明显强化,肿块强化较均匀,余未见明显异常强化;E术前可见右臀部约20cm弧形瘢痕切口;F术中完整切除臀大肌,臀中肌,保留臀小肌,结扎臀上血管及神经,显露并保护坐骨神经,切除部分髂骨翼;G切除原手术切口后的肿瘤大体标本;H-I术后切口予以皮钉缝合器缝合,内置两根多孔硅胶负压引流管,外接负压引流装置,以VSD封闭创面;J术后7天拆除泡沫敷料,48h拔除后置引流管,可见手术切口愈合良好,无窦道及感染。
患者,男,56岁,因右大腿脂肪肉瘤术后1年复发入院,术前曾行化疗(AP方案)+放疗(Dt=60Gy/30F)。
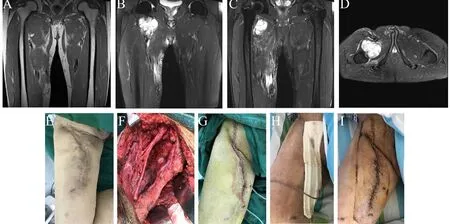
图3,A-D术前MRI示:右大腿根部内侧可见一等T1长T2软组织肿块影,T2抑脂呈明显高信号,形态欠规整,边界欠清,大小约70 mm×51 mm×59 mm。邻近组织结构紊乱,信号不均,右侧闭孔外肌周围见片状T2抑脂高信号影,增强示:右侧大腿内侧软组织肿块呈明显不均匀强化,以边缘强化为主;E术前手术切口可见瘢痕纤维组织增生硬化;F术中行肿瘤扩大切除+腹股沟淋巴结清扫,显露髋臼前侧,股神经及股血管,可见股血管被增生的瘢痕,炎性组织包绕;G-H术后切口予以皮钉缝合器缝合,内置两根多孔硅胶负压引流管,外接负压引流装置,以VSD封闭创面;I-H术后7天拆除泡沫敷料,35 h后拔除内置引流管,可见手术切口愈合良好,无窦道及感染。
3 讨论
3.1 多次手术及放化疗对手术创面的影响
目前,手术切除,放、化疗及生物靶向治疗等已成为恶性软组织肿瘤患者主要的治疗方式。国内外的一些大规模前瞻性随机研究显示:相比单纯行手术切除的恶性软组织肿瘤患者而言,手术结合辅助治疗(放、化疗)对于患者术后肿瘤的局部控制率及生存率都有极大改善[1,6,7]。但绝大多数情况下,仍有一部分患者面临肿瘤复发,不得不再次行手术切除的困境。研究显示,手术创面的愈合需要经过数周或数月切口床基底层细胞通过分裂和移行,从而形成新生上皮细胞覆盖伤口,促进伤口闭合。但肿瘤患者由于多次手术、放化疗、细胞功能受损、感染、过度炎症反应等各种因素破坏了这种有序过程,且这些因素大大削弱了创面的修复能力,从而形成难愈性创面[8]。我们总结文献后认为,多次手术及放化疗引起手术切口难以愈合或容易感染的原因包括:全身因素,包括化疗,肿瘤引起的免疫力低下,低蛋白血症,长期口服激素或免疫抑制剂及营养不良等因素,这些全身因素会导致创面的愈合及修复过程受阻,降低创面生长因子的表达,减少新生血管形成和胶原沉积,从而引起创面的延迟愈合[9,10];多次手术和有放疗史患者的原手术切口皮肤瘢痕纤维化,血运受破坏,皮下筋膜层水肿,引起长时间的炎症反应,再次手术后易出现切口坏死,破溃[5,7,11,12];复发性肉瘤一般体积较大,本组肿瘤直径8cm~16cm,平均12.3 cm,侵犯面积广,术中为了获得广泛的外科边界,手术时间长,增加了围手术期间创面并发症的发生率。且术中所遗留下的残腔较大,若引流不畅,血肿及渗出液极易填充残腔,形成血肿机化带,阻碍筋膜层的贴拢与闭合,同时容易为细菌提供良好的培养基,导致切口感染风险增大[13];多次手术中,可能结扎或损伤神经及血管,影响支配该区域皮肤的血供,导致关节僵硬,局部血液循环差,伤口难以愈合;还有一部分患者术前行介入栓塞,以减少术中出血,同时也减少了供血区的血供,导致皮肤坏死,甚至部分肌肉坏死。
对于躯干及四肢的高级别肉瘤,手术切除联合放、化疗仍是其标准的治疗方式,术前或术后的放疗对患者肿瘤复发的局部的控制率及生产率都有明显改善[14-16]。然而,多次手术,放、化疗以及吸烟,糖尿病等都会增加术后切口并发症的发生率[17]。O'SullivanB等[18]在加拿大癌症研究所 (NCI Canada)通过一项大规模前瞻性随机研究,认为相比术后放疗患者的切口并发症发生率(17%),术前放疗患者的术后切口并发症发生率高达35%,其中包括切口延迟愈合,感染,坏死,慢性窦道形成等等。Bujko等[19]报道了202例复发性软组织肉瘤接受连续放疗后,手术切口并发症的发生率为37%。因此,针对这一类多次手术,术前放、化疗的患者,如何在围手术期做好手术创面的管理至关重要。
3.2 “内引流”联合“外引流”技术的优势
目前已有文献显示[4,8,9,13],VSD技术可以改善创面愈合,增加局部血供及微循环,促进肉芽组织的生长及基质上皮迁移,为创面的愈合提供绝佳的环境。但是VSD大部分用于感染,急慢性创面等的治疗,本组系多次手术,复发性软组织肉瘤的病例,部分患者术前不同程度的行放、化疗,这些因素都会增加患者手术创面不愈合,感染的发生率。
对于复发性软组织肉瘤而言,通常采用扩大切除或间室切除的手术方式,术后遗留的残腔较大,传统的“内引流”无法起到充分引流,消灭死腔的作用。负压封闭引流(vacuum sealingdrainage,VSD)技术是近数十年来开展的一种能够有效覆盖创面,广泛应用于骨科和外科多种创面的标准治疗模式之一,它可以消灭死腔,降低创面感染,同时也能促进肉芽组织生长[5,14,15]。本组18例复发性肉瘤术后创面所采用的“内引流”联合 VSD技术具有以下优点:充分引流,消灭死腔。可以全方位、立体的将残腔内的渗出液,积血及坏死的组织引流,降低残腔内坏死物质的吸收导致的炎症反应,同时持续的“双重负压”有利于将皮下筋膜层充分贴合,减小创腔,促进创面的愈合;明显缩短创面切口愈合的时间。将VSD覆盖于创面上可以促进血管及肉芽组织生长、加快创面的愈合速度,研究表明[2,9,11],VSD的机械压作用以及湿润创面的微环境条件下,可以加快创面的血液循环,从而快速消退损伤组织肿胀,降低局部水肿,促进新生血管形成和胶原沉积以及成纤维细胞增殖;能够减少切口感染的发生。VSD的负压设计,使创面与外界完全隔离,保持创面湿润和温暖的微环境,避免了外界微生物的入侵,减少了创面的交叉感染和院内二次感染;降低传统换药的痛苦,提高患者的生活质量。Sakellariou等[12]进行的一项回顾性临床研究显示,对于复杂切口(多次手术,纤维化,水肿)的骨与软组织肿瘤患者,手术切除联合负压封闭疗法取得了满意疗效。该研究中与常规换药组相比,NPWT组在住院周期,切口感染、坏死,皮下血肿等方面有显著统计学意义(P<0.05)。
3.3 VSD应用于肿瘤创面的相关争论
3.4 本研究的设计原理
本研究的传统引流均采用德国美多MEDINORM真空负压引流套件,预抽真空-95Kpa(712.5mmHg),引流壶内的负压远大于VSD负压(150 mmHg~350 mmHg)。但在实际临床工作中,我们发现即便有多孔的硅胶管设计,传统引流壶最大的弊端:容易被血肿及坏死的肉芽组织堵塞,导致引流不畅;引流壶内虽然负压较大,但是一旦由引流管进入创面内,管孔内的负压只能对局部创面起到吸引作用。且在术后早期由于渗出液及创面出血的原因,引流量较多,一旦引流管口堵塞就很容易形成皮下血肿,血肿填充残腔或为细菌良好培养基,导致切口感染风险增大,尤其对于这种创面较大,深部组织的手术,最终可能导致创面不愈合,感染等等。而联合 VSD技术可以大大降低此种风险发生率,持续的VSD负压引流可及时清除切口内积血和渗出物,联合应用传统引流装置可全方位立体引流切口内积血和渗出液,不留死腔,避免局部液体聚积,且VSD提供的负压环境可以整个覆盖创面,为创面血运提供均匀、有效、持续的动力,可使创面血液循环处于加速状态,软组织血供流量出现间断峰是正常血流基线的4倍,从而快速消退损伤组织肿胀,降低局部水肿,提高局部循环和氧气水平,加速新鲜肉芽组织生长,有助于创面愈合[2,8,9]。虽然引流壶内的负压远大于VSD负压,VSD的吸引作用似乎没有“内引流”强,但是管孔内的负压只能对局部创面起到吸引作用,即负压不均匀,且作用范围局限,因此,临床上VSD的吸引作用应该强于传统引流壶,在早期伤口是作为一个引流的通道,可以将创面内的积血和渗出物充分引流,但由于泡沫辅料的寿命一般为5~7天,我们的经验是在5~7天后拆除干瘪变硬的负压敷料,然后持续观察伤口,换药,待传统引流壶引流量<20mL/24h后拔除,即先拆除VSD引流装置,再拔除传统引流壶,保证创面的愈合及引流通畅,减低表皮及皮下愈合延迟的发生率。
结合本组18例患者,我们总结出传统引流联合VSD技术存在可能存在以下缺点:引流量大。“双重引流”术后容易导致贫血,低蛋白血症及电解质紊乱等并发症发生,本组18例患者,术后均有不同程度的贫血,低蛋白血症及电解质紊乱的表现,予以补充悬浮红细胞,血浆,白蛋白等对症治疗后好转;引流不连续。术后患者在转运途中及夜间容易出现引流中断的现象,本组1例患者出现切口皮下血肿,综合分析考虑术后负压吸引中断,不连续所致,后期需要加大对VSD技术负压连续性的监测力度;形成张力性水泡。本组2例创面敷料周围出现张力性水泡,水泡均为清亮浆液性水泡,沿敷料边缘分布,抽吸送检后并未合并细菌感染,对于此类水泡,我们的经验是予以5mL~10mL的注射器抽吸出水泡内的液体,再予以稀释活力碘纱布或凡士林纱布覆盖,换药;泡沫敷料干瘪变硬。本组VSD持续吸引5~7天,由于泡沫敷料内部的水分吸干,会导致泡沫敷料干燥,质地变硬,压迫周围健康皮肤,引起局部皮肤破溃。尽管存在相关并发症及不良反应,但我们认为对于此类多次手术,放、化疗的肿瘤创面,“内外双重引流”不失为一种安全、有效的治疗方式。
本研究不足之处在于采用的是小样本量的回顾性研究分析,且没有设置对照组,故此研究结论有待提高。既往国内外关于VSD应用到复发性软组织肉瘤创面的研究不多,本研究的治疗经验可为今后进行大样本量前瞻性随机对照试验做准备。
多次手术及放、化疗导致的外科术后创面并发症仍是临床医师面临的一个巨大挑战,对于恶性软组织肿瘤,如何有效处理及预防术后创面并发症的发生,需要一个多学科的团队共同协作,对患者的放、化疗方案,手术的入路及肿瘤的切除方式做全方位的研究及实施。结合本组研究,我们认为,传统引流联合负压封闭引流技术是预防复发性肉瘤手术创面并发症简单而有效的手段,不仅起到了充分引流,消灭死腔的作用,同时还可以促进创面的愈合,缩短治疗周期。
[1] Sampath S,Hitchcock YJ,Shrieve DC,et al.Radiotherapy and extent of surgical resection in retroperitoneal soft-tissue sarcoma:multi-institutional analysis of 261 patients[J].Journal of Surgical Oncology,2010,101(5):345-350.
[2] Bickels J,Kollender Y,Wittig JC,et al.Vacuum-assisted wound closure after resection of musculoskeletal tumors[J].Clinical Orthopaedics&Related Research,2005,441(441):346.
[3]Wicke C,Bachinger A,Coerper S,et al.Aging influences wound healing in patients with chronic lower extremity wounds treated in a specialized Wound Care Center[J].Wound Repair&Regeneration,2009,17(1):25-33.
[4] Morykwas MJ,Argenta LC,Shelton-Brown EI,et al.Vacuum-assisted closure:anewmethodforwound control and treatment:animal studies and basic foundation[J].Annals of Plastic Surgery,1997,38(6):553.
[5] Fleischmann W,Strecker W,Bombelli M,et al.Vacuum sealing as treatment of soft tissue damage in openfractures[J].Unfallchirurg,1993,96(9):488-492.
[6] Reiter M,Harréus U.Vacuum assisted closure in the management of wound healing disorders in the head and neck:A retrospective analysis of 23 cases[J].Am J Otolaryngol,2013,34(5):411-415.
[7] Delman KA,Johnstone PA.Vacuum-assisted closure for surgical wounds in sarcoma[J].Journal of Surgical Oncology,2007,96(7):545-546.
[8] Patmo A SP,Krijnen P,Tuinebreijer WE,et al.The Effect of Vacuum-Assisted Closure on the Bacterial Load and Type of Bacteria:A Systematic Review[J].Advances in Wound Care,2014,3(5):383-389.
[9] Liu X,Liang J,Zhao J,et al.Vacuum Sealing Drainage Treatment Combined with Antibiotic-Impregnated Bone Cement for Treatment of Soft Tissue Defects and Infection[J].Medical Science Monitor International Medical Journal of Experimental&Clinical Research,2016,22:1959-1965.
[10]Yang SL,Han R,Liu Y,et al.Negative pressure wound therapy is associated with up-regulation of bFGF and ERK1/2 in human diabetic foot wounds[J].Wound repair and regeneration:official publicationof theWound HealingSociety[and]the EuropeanTissue Repair Society,2014,22(4):548.
[11]Bulla A,Farace F,Uzel A P,et al.Negative pressure wound therapy and external fixation device:a simple way to seal the dressing[J].Journal of Orthopaedic Trauma,2014,28(7):176-177.
[12]Sakellariou VI,Mavrogenis AF,Papagelopoulos PJ.Negative-pressurewoundtherapyformusculoskeletaltumorsurgery[J].Advances in Skin&Wound Care,2011,24(1):25-30.
[13]崔浩杰,祁强,何娜,等.骶骨肿瘤切除术后软组织缺损的修复[J].中国修复重建外科杂志,2009(10):1173-1176.
[14]孙永华,田孝臣,曾丁,等.再谈封闭负压技术治疗急慢性创面有关的几个问题[J].中华损伤与修复杂志(电子版),2010,05(1):6-8.
[15]Putnis S,Khan WS,Wong J ML.Suppl 1:Negative Pressure Wound Therapy-A Review of its Uses in Orthopaedic Trauma[J].Open Orthopaedics Journal,2014,8(1):142.
[16]吕涛,周潘宇,许硕贵,等.封闭式负压引流术并自体网状皮修复肿瘤截肢术后难治性创面的效果观察[J].中华损伤与修复杂志(电子版),2011,06(5):66-68.
[17]Baldini EH,Lapidus MR,Wang Q,et al.Predictors for major wound complications following preoperative radiotherapy and surgery for soft-tissue sarcoma of the extremities and trunk:importance of tumor proximity to skin surface[J].Annals of Surgical Oncology,2013,20(5):1494-1499.
[18]O'Sullivan B,Davis AM,Turcotte R,et al.Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs:a randomised trial[J].Lancet,2002,359(9325):2235-2241.
[19]Bujko K,Suit HD,Springfield DS,et al.Wound healing after preoperative radiation for sarcoma of soft tissues[J].Surgery Gynecology&Obstetrics,1993,176(2):124-134.
[20]Siegel H,Long JK,Fiveash J.Vacuum-assisted closure for radiation-associated wound complications[J].Journal of Surgical Oncology,2010,96(7):575-582.
[21]Naghavi AO,Gonzalez RJ,Scott JG,et al.Staged reconstruction brachytherapy has lower overall cost in recurrent soft-tissue sarcoma[J].International Journal of Radiation Oncology Biology Physics,2017,9(1):20-29.

