特应性皮炎不同中医证型外周血T细胞亚群及其相关细胞因子表达的研究
赵一丁,杨 洁,闫小宁,郎 娜
(1. 陕西省中医医院,西安 710003; 2. 陕西省中医药研究院,西安 710003; 3. 中国中医科学院西苑医院,北京 100091)
特应性皮炎(atopic dermatitis, AD)是一种慢性、复发性、瘙痒性、炎症性皮肤病,初发于婴儿期,呈慢性经过,常伴有哮喘或过敏性鼻炎,部分患者病情可以迁延至成年,严重影响患者及其家庭成员的生活质量。目前AD的病因及发病机制尚未完全明确,一般认为是在一定遗传背景和(或)环境因素作用下,造成机体皮肤屏障功能障碍或直接引起机体的免疫反应失调,导致变应性或非变应性炎症反应。T细胞亚群及其相关细胞因子在AD炎性反应的发生发展过程中起重要作用。本研究拟通过探讨AD患者外周血T细胞亚群相关细胞因子水平与中医证型之间的关系,以期为AD的中医辨证提供微观科学依据。
1 资料与方法
1.1 临床资料
1.1.1 诊断标准 西医诊断符合Hanifin与Rajka诊断标准[1],中医证型诊断符合国家中医药管理局四弯风辨证分型标准[2],将患者分为风湿蕴肤证和血虚风燥证2型。其中风湿蕴肤证主症:皮肤潮红;瘙痒剧烈;糜烂渗出;丘疹水疱;次症:神倦便溏;遇风湿加重;舌淡苔薄腻;脉弦滑;血虚风燥证主症:皮肤干燥;肥厚或苔藓样变;瘙痒抓痕血痂;病程久,反复发作;次症:食后腹胀,便秘或溏;皮肤色暗或色素沉着;舌质淡胖;苔白脉滑;当患者符合以上证候中主症3项或3项以上,同时具备次症任何2项或2项以上即可诊断为该证型。
1.1.2 纳入和排除标准 2岁≤年龄≤60岁,性别不限,符合西医诊断标准及中医辨证分型标准,无严重心、脑、肝、肾等系统性疾病,排除妊娠及哺乳期妇女,近2周内未接受系统性糖皮质激素、免疫抑制剂治疗。
1.1.3 病例来源 表1显示,选取2015年5月至2017年4月陕西省中医医院皮肤科的54例就诊病理患者,其中男性30例,女性24例,年龄4~35岁,平均年龄(19.40±8.41)岁;病程4~17年,平均病程(10.01±3.69)年;辨证属风湿蕴肤证者20例,血虚风燥证者34例;招募健康志愿者20例对照组,其中男性11例,女性9例,年龄13~32岁,平均年龄(20.40±4.54)岁,2组受试者性别、年龄比较差异无统计学意义(P>0.05)。

表1 一般资料特征
1.2 方法
1.2.1 主要试剂和仪器 CD4/CD8/CD3检测试剂盒、Treg检测试剂盒,美国Beckman-Coulter公司;人白介素-4(IL-4)酶联免疫分析试剂盒、人白介素-12 (IL-12/P70)酶联免疫分析试剂盒、人白介素-10(IL-10)酶联免疫分析试剂盒,武汉华美生物工程有限公司;流式细胞仪,美国Beckman-Coulter公司,EPICS XL;自动板式酶标仪,北京航宇浪琴医疗设备有限公司ZS-3;台式离心机,济南来宝医疗器械有限公司,TD-5 M;电热恒温培养箱,黄石市恒丰医疗器械有限公司SKP-02.600);超低温冰箱,日本SANYO公司MDF-192等。
1.2.2 检测方法 分别抽取纳入患者及健康志愿者空腹外周静脉血9 ml(肝素抗凝),分别注入3个试管中,每管3 ml。
第1管用于细胞因子IL-4、IL-12及IL-10的检测,采用ELISA法检测。待检标本离心(1200 r/min,5 min)吸取上层血清注入EP管中;加样:分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL,将样品加于酶标板孔底部,37 ℃反应120 min,弃去液体甩干,不用洗涤,每孔加生物素标记抗体工作液100 μL,37 ℃温育60 min,弃去孔内液体甩干,洗板3次,每次浸泡1~2 min,200 μL/孔甩干。每孔加辣根过氧化物酶标记亲和素工作液100 μL,37 ℃温育60 min,弃去孔内液体甩干,洗板5次,每次浸泡1~2 min,200 μL /孔甩干,依序每孔加底物溶液90 μL,37 ℃避光显色,依序每孔加终止溶液50 μL,终止反应,用酶联仪在450 nm波长依序测量各孔的光密度。
第2管以肝素抗凝,用于CD3+、CD4+、CD8+的检测,采用流式细胞仪。取1支流式管作为样品测试管,将100 μL抗凝全血(EDTA)加入试管中,在管中加入10μLCD45-FITC/CD3-PC5/CD4-RD1/CD8-ECD抗体,涡旋混匀后室温避光孵育15 min取出试管,每管加入500 μL红细胞裂解液OptiLyse C,涡旋混匀室温避光10 min,1200 r/min离心5 min,弃去上清液每管加入2 mlPBS,涡旋混匀1200 r/min离心5 min弃去上清液,每管加入500 μLPBS混匀,4 ℃避光1 h内上机检验。
第3管用于CD4+CD25highCD127lowTreg的检测,采用流式细胞仪。取2支流式管,编号1(同型对照管)和2(样品测试管)分别加入50 μL EDTA,在管1中加入10μLCD4-FITC、10μLIgG1-PC5、10μLIgG1-PE抗体,涡旋混匀后,室温避光孵育20 min,在管2中加入10μLCD4-FITC、10μLCD25-PC5、5μLCD127-PE抗体,涡旋混匀后,室温避光孵育15 min取出试管,每管加入500 μL红细胞裂解液OptiLyse C,涡旋混匀室温避光10 min,1200rpm离心5 min,弃去上清液,每管加入2mlPBS涡旋混匀,1200rpm离心5 min,弃去上清液,每管加入500μLPBS混匀,4 ℃避光1 h内上机检验。
在淋巴细胞中以CD3设门,CD4设门,可在以CD3为横坐标、CD4为纵坐标的二维散点图上把淋巴细胞分为CD3+CD4+T细胞和CD3+CD4-T细胞;以CD3设门,CD8设门,可在以CD3为横坐标、CD8为纵坐标的二维散点图上把淋巴细胞分为CD3+CD8+T细胞和CD3+CD8-T细胞,以CD3+CD4+T细胞和CD3+CD8+T细胞各占CD3+T细胞的比例作为CD4+T细胞和CD8+T细胞的表达水平;以CD4设门,可在以CD4为横坐标、侧向散射角(SSC)为纵坐标的二维散点图上把淋巴细胞分为CD4+T淋巴细胞和CD4-T淋巴细胞。在CD4+T的淋巴细胞中,以CD25、CD127设门,将CD4+CD25+细胞群平均荧光强度10倍的亚型细胞群定义为CD4+CD25highT细胞,获取设门内细胞团并保存数据,分析CD4+CD25highCD127low淋巴细胞比例,将CD4+CD25highCD127low淋巴细胞作为Treg的水平。

2 结果
2.1 特应性皮炎不同证型外周血T淋巴细胞亚群表达比较
表2图1~8显示,风湿蕴肤证及血虚风燥证AD患者外周血CD4+T细胞水平均高于对照组(P<0.05),但两证型比较差异无统计学意义(P>0.05);血虚风燥证AD患者外周血CD8+T细胞水平高于风湿蕴肤证AD患者及对照组(P<0.05),风湿蕴肤证AD患者外周血CD8+T细胞水平与对照组比较差异无统计学意义(P>0.05);风湿蕴肤证及血虚风燥证AD患者外周血CD4+CD25highCD127lowTreg细胞水平均明显低于对照组(P<0.01),且风湿蕴肤证AD患者外周血CD4+CD25highCD127lowTreg细胞水平低于血虚风燥证(P<0.05);各组AD患者外周血CD3+T细胞水平及CD4+/CD8+比较差异无统计学意义(P>0.05)。
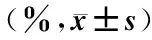
表2 各组外周血T淋巴细胞亚群占总淋巴细胞比值比较
注:与对照组比较:※P<0.05,※※P<0.01;与风湿蕴肤证组比较:#P<0.05,##P<0.01
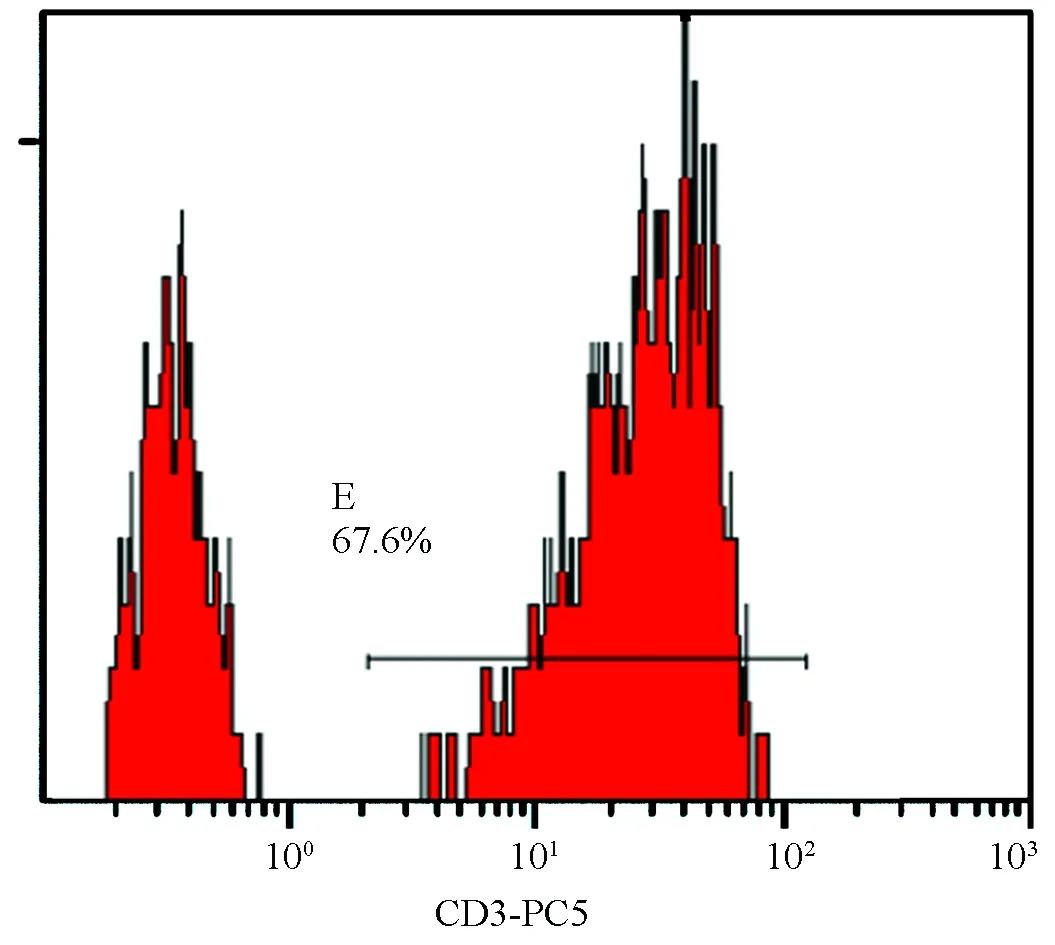
图1 风湿蕴肤证组CD3+流式直方图
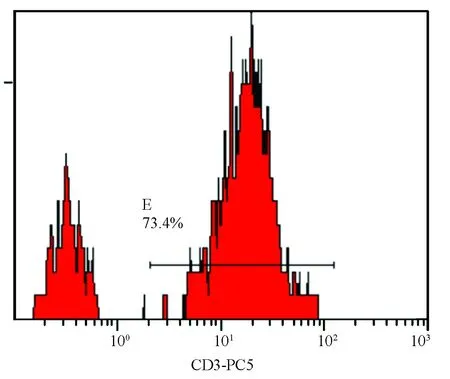
图2 血虚风燥证组CD3+流式直方图

图3 风湿蕴肤证组CD4+流式散点图注:C2为CD4+T淋巴细胞
图4 血虚风燥证组CD4+流式散点图注:C2为CD4+T淋巴细胞

图5 风湿蕴肤证组CD8+流式散点图注:D2为CD8+T淋巴细胞

图6 血虚风燥证组CD8+流式散点图注:D2为CD8+T淋巴细胞

图7 风湿蕴肤证组Treg流式散点图 注:D门内为CD4+CD25highCD127lowTreg
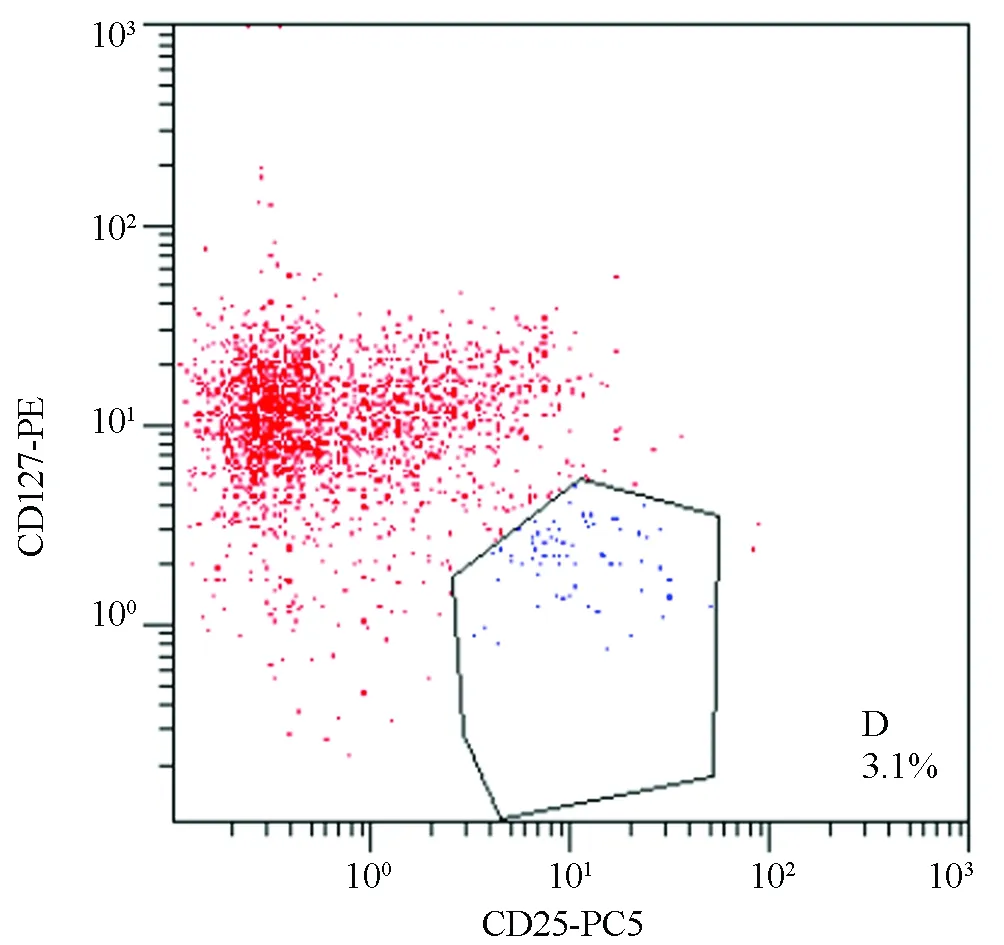
图8 血虚风燥证组Treg流式散点图 注:D门内为CD4+CD25highCD127lowTreg
2.2 特应性皮炎不同证型外周血IL-4、IL-12、IL-17、IL-10水平比较
表2显示,风湿蕴肤证及血虚风燥证AD患者外周血IL-4、IL-17水平均高于对照组(P<0.05),且风湿蕴肤证AD患者外周血IL-4、IL-17水平均高于血虚风燥证(P<0.05);风湿蕴肤证及血虚风燥证AD患者外周血IL-12水平明显低于对照组(P<0.01),并且风湿蕴肤证AD患者外周血IL-12水平明显低于血虚风燥证(P<0.01),血虚风燥证AD患者外周血IL-12水平与对照组比较差异无统计学意义(P>0.05),血虚风燥证AD患者外周血IL-10水平高于风湿蕴肤证患者及对照组(P<0.05),风湿蕴肤证AD患者外周血IL-10水平与对照组比较差异无统计学意义(P>0.05)。
表2 各组血清IL-4、IL-12、IL-10水平比较
注:与对照组比较:※P<0.05,※※P<0.01;与风湿蕴肤证组比较:#P<0.05,##P<0.01
3 讨论
中医学并无特应性皮炎的病名记载,根据其发病部位、临床特征及形态,常包括在“浸淫疮”“四弯风”“奶癣”“胎疮”“血风疮”等疾病中[3]。中医学认为,本病由先天禀赋不足、胎毒遗热、热郁肌肤而致;或由后天饮食不节、喂养失当导致脾失健运,复感风湿热毒,邪毒蕴结肌肤而致;反复发作、迁延日久或后天情志内伤,可致脾虚气血生化乏源,阴血、元气耗伤则血虚风燥、肌肤失养。1994年国家中医药管理局制定的《中华人民共和国医药行业标准·中医病证诊断疗效标准》将本病分为风湿蕴肤证和血虚风燥证两型[2]。本研究按照此辨证分型标准,通过对2种证型AD患者外周血T淋巴细胞亚群及相关细胞因子的检测,探讨AD中医辨证的微观证据。
现代医学认为,T淋巴细胞亚群、Th1/Th2及Th17/Treg细胞网络失衡在AD的发病过程中有重要作用。有研究显示,AD患者外周血CD4+和CD4+/CD8+水平增高,CD8+水平下降,导致体液免疫功能亢进,细胞免疫功能低下[4]。本研究结果显示,AD患者外周血CD4+T细胞水平均高于对照组,血虚风燥证AD患者外周血CD8+T细胞水平高于风湿蕴肤型AD患者及对照组,说明AD患者体内T细胞的辅助与抑制功能存在失衡。AD急性期主要为Th2细胞活化引起免疫应答,产生IL-4、IL-5及IL-13等,表现为红斑、丘疹、水疱甚至黄水浸淫、糜烂、结痂,可伴有烦躁不安、大便干结或黏腻、小便短黄、舌红苔黄腻、脉滑数等,证属风湿(热)蕴肤,慢性期免疫反应则向Th1细胞占优势的免疫应答转变,IL-12及GM-CSF呈过表达[5],表现为皮肤肥厚、苔藓化、干燥、瘙痒剧烈,伴有倦怠乏力、食少腹胀、舌质淡红少津、苔少、脉沉弦等,证属血虚风燥。有研究显示,(风)湿热蕴肤征象表现越明显,IL-4、IL-17表达越高,而病久耗伤阴血、血虚风燥,逐渐成为慢性期表现,此时相对较高的IFN-γ表达增加[6],与本研究结果相符。
Treg细胞是新型CD4+T细胞亚群,主要通过细胞间接触抑制和分泌抑制性细胞因子如TGF-β、IL-10而发挥免疫调节作用[7],它与Th17细胞平衡失调可引起AD皮损向急性期发展,Treg细胞可分为CD4+Treg细胞、CD8+Treg细胞、NKT Treg细胞和双阴性Treg细胞,其中CD4+Treg细胞与特应性皮炎的发病密切相关,CD25是CD4+Treg细胞的分子标志物,但效应性T细胞也表达CD25,只有高表达CD25的CD4+Treg细胞才具有免疫调节作用,而CD127在CD4+Treg细胞表面特异性低表达,检测时不用破坏细胞膜[8],因此本研究采用CD4+CD25highCD127low作为筛选Treg细胞的标准。研究结果显示,AD患者外周血Treg细胞低于健康对照组,说明AD患者体内存在Treg细胞数减少导致免疫抑制效应的不足[9],且风湿蕴肤证患者外周血Treg水平低于血虚风燥证患者,IL-17水平高于血虚风燥证患者,可能说明慢性期平衡转向Treg、Th1方向,IL-10呈高表达。在辨证论治过程可以从IL-4、IL-12、IL-17、IL-10水平的高低及CD4+、CD8+、Treg细胞的数量初步判断患者的病情阶段及中医辨证分型,从而为遣方用药提供依据。
[1] HANIFIN JM,RAJKA G.Diagnosic features of atopic dermatitis[J].Acta Derm Venereol (Stockh),1980,Suppl 92:44-47.
[2] 国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994:147.
[3] 刘炽,温晓文,黄楚君,等.古代中医对特应性皮炎疾病特征的认识钩玄[J].新中医, 2011,43(40):127-128.
[4] 曾迎红,汤建萍,叶志纯,等.特应性皮炎患儿外周血T细胞亚群与总IgE水平的相关性研究[J].皮肤病与性病, 2010,32(3):1-2.
[5] CHEN L, MARTINEZ O, OVERBERGH L, et al. Early up-regulation of Th2 cytokines and late surge of Th1cytokines in an atopic dermatitis model [J].Clin Exp Immunol, 2004, 138(3):375-387.
[6] 徐张杰, 覃永健, 吴志洪. 特应性皮炎患儿外周血淋巴细胞亚群及相关因子与中医证候关联研究[J]. 时珍国医国药,2015,26(11):2801-2804.
[7] RODRIGUES FM, COELHO NETO GT, MENEZES JG, et al. Expression of Foxp3, TGF-β and IL-10 in American cutaneous leishmaniasis lesions[J]. Arch Dermatol Res, 2014, 306(2):163-171.[8] LIU W, PUTNAM AL, XU-YU Z, et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+T reg cells[J]. J Exp Med, 2006, 203(7):1701-1711.
[9] 蒋有让, 刁庆春, 史丙俊, 等. 特应性皮炎患者血清中Th17和Treg相关细胞因子的检测[J].临床皮肤科杂志, 2016,45(6):411-413.

