高效液相色谱法测定铬超富集植物李氏禾根系分泌物中的有机酸
伍婵翠, 刘 杰, 张学洪
(1. 桂林电子科技大学生命与环境科学学院, 广西 桂林 541004; 2. 广西大学轻工与食品工程学院, 广西 南宁 530004; 3. 桂林理工大学, 广西环境污染控制理论与技术重点实验室, 广西 桂林 541004)
大多数植物根系都能够分泌出低相对分子质量的有机酸,如柠檬酸、苹果酸和草酸[1]。这些有机酸既能在土壤固相中,又能在根际土壤溶液中与金属离子发生反应,增加金属在根际环境中的流动性,从而提高重金属的植物有效性[2]。在超富集植物中,根系分泌的有机酸还可增加土壤中金属离子的溶解度,并与根系分泌物中的某些物质形成稳定的金属螯合物复合体,从而减轻重金属对植物的毒害作用[3]。有机酸也被认为参与了有毒金属元素的耐受和富集[4]。因此,根系中有机酸的分析对于深入认识超富集植物的生理生态学适应机制显得尤其重要。
采用不同方法检测植物根系中有机酸的研究已有报道。赵宽等[5]建立了植物根茎叶及根系分泌物中有机酸的离子色谱分析测定方法,并从4种不同植物的根系分泌物中检测出草酸、柠檬酸、酒石酸、苹果酸和丁二酸。鄢盛尧等[6]采用酶动力学分光光度法测定油茶根系分泌物中的柠檬酸和苹果酸。张力等[7]利用飞行时间质谱测定了樟树幼苗根系分泌物中的低相对分子质量有机酸。这些仪器分析方法在使用中都存在一定的问题:离子色谱法易受介质干扰,对样品的要求较高;酶动力学分光光度法测量误差较大,影响因素较多;飞行时间质谱法因离子在离开离子源时初始能量不同,使得具有相同质荷比的离子达到检测器时有一定的时间分布,易造成分辨能力下降。此外,根系分泌物有200多种,其种类和数量随植物类型、根际环境而异[8]。植物间亲缘关系越远,根系分泌物组分和数量差异越大,根系分泌物的种类和数量还随外界环境胁迫的不同而改变[9]。李氏禾(LeersiahexandraSwartz)是国内首次报道的铬超富集植物[10],它对土壤中的铬有很强的吸收和富集能力[11]。目前,对铬超富集植物根系分泌物中有机酸成分的分析尚未见报道。其根系分泌物中的有机酸,可以在一定程度上改变土壤中铬的溶解度[12],能与土壤固、液相中的金属离子发生强烈反应,对李氏禾吸收和耐受土壤中的铬污染物起到了至关重要的作用。
本文以李氏禾的根系分泌物为研究对象,采用高效液相色谱(HPLC),通过对检测条件的优化,旨在建立一个准确、快捷的方法同时检测李氏禾根系分泌物中的低相对分子质量有机酸组分。此外,本研究采用溶液收集法获取李氏禾的根系分泌物,与土培收集法[13]和原位收集法[14]相比,操作简单,易于进一步分析。与现有文献[13,15]相比,收集到的根系分泌物无需通过离子交换树脂和萃取等前处理,浓缩后即可适用于定量分析。本研究的检测结果将会对进一步研究李氏禾对铬的耐受机制、解毒机制和富集机制提供重要的信息。
1 实验部分
1.1 仪器与试剂
Waters高效液相色谱系统(515泵,717 plus自动进样器, 2996紫外吸收检测器,Empower色谱工作站,美国Waters公司); UPW-20N超纯水器(北京历元电子仪器); LRH-550-GSI人工气候箱(韶关市泰宏医疗器械有限公司); RE-52B旋转蒸发仪(上海亚荣生化仪器厂); PHS-3C酸度计(上海精密科学仪器有限公司);水相针式过滤器(直径13 mm,孔径为0.45 μm,天津市津腾实验设备有限公司)。
草酸(oxalic acid)、甲酸(formic acid)、乙酸(acetic acid)、乳酸(lactic acid)、酒石酸(tartaric acid)、柠檬酸(citric acid)、苹果酸(malic acid)、马来酸(maleic acid),均为标准品(上海阿拉丁生化科技股份有限公司);甲醇、乙腈为色谱纯(德国Merck公司);其他化学试剂均为分析纯(中国医药集团总公司);实验用水为超纯水。
1.2 色谱条件
XSelect HSS T3色谱柱(250 mm×4.6 mm, 5 μm,美国Waters公司);流动相为40 mmol/L KH2PO4-H3PO4缓冲溶液(pH=2.40);流速1.0 mL/min;检测波长205 nm;柱温25 ℃。
1.3 实验条件
1.3.1 植物材料
李氏禾适合生长在溪旁、稻田和沼泽地里[10]。本次实验用的李氏禾采至桂林市灵川县灵田乡花江边上。其生长茂盛且分布广泛,是本实验理想的实验材料。
1.3.2 植物培养
选取生长一致的李氏禾幼苗,用去离子水洗净,放入含有1.5 L 25% (体积分数) Hoagland’s营养液的塑料盆中,于人工气候箱中培养10 d。每天加入去离子水保持培养液的体积,每3天更换一次营养液。培养条件为:光周期12 h,温度25 ℃,相对湿度75%,光照强度7 000 Lx。
1.3.3 根分泌物的收集
第十天光照2 h后将李氏禾取出,先用蒸馏水冲洗根部3次,在新制备的超纯水中加入几滴0.05%(体积分数)的百里酚水溶液[16],浸泡李氏禾根部5 min,再用超纯水清洗根部3次。将李氏禾放入300 mL 0.5 mmol/L的CaCl2溶液中[17],每杯加入3滴0.05%(体积分数)的百里酚溶液,放回培养箱中光照收集4 h。4 h后,收集液用0.45 μm的滤膜抽滤后旋转蒸发(40 ℃, 90 r/min)浓缩后,再用氮气吹干,最后定容至2 mL,放于冰箱中冷藏备用。
1.3.4 有机酸标准溶液的配制
称取草酸、柠檬酸、马来酸、苹果酸、酒石酸各0.500 0 g,分别用超纯水溶解并定容至10 mL;用移液枪移取甲酸、乙酸、乳酸各5.0 mL,分别用超纯水定容至25、50、50 mL。放置于冰箱中保存,检测时用现配的流动相稀释成所需浓度。

图 1 不同流动相条件下8种有机酸混合标准溶液的色谱图Fig. 1 Chromatograms of mixed standard solutions of eight organic acids with different mobile phases a. mobile phase: acetonitrile-water (10∶90, v/v) (pH=3.00); b. mobile phase: 40 mmol/L KH2PO4 buffered aqueous solution (pH=2.40).
2 结果与讨论
2.1 色谱流动相的优化
2.1.1 流动相的组成
现有的采用高效液相色谱法检测有机酸的报道中有的采用有机试剂做流动相[18],有的采用无机溶液及缓冲溶液做流动相[19-21]。本研究分别选择了乙腈-水溶液和KH2PO4-H3PO4磷酸缓冲溶液作为流动相,以比较两者对混合有机酸的分离效果。实验结果表明,采用乙腈-水(10∶90,体积比)溶液(用磷酸调节pH至3.00)作为流动相并不能对8种有机酸进行有效分离(见图1a)。故本实验考虑采用KH2PO4-H3PO4缓冲溶液作为流动相。
2.1.2 流动相的浓度
分别配制了10、20、30、40、50 mmol/L KH2PO4溶液(用H3PO4调节pH至2.40),以考察不同浓度对分离效果的影响。实验结果表明,当KH2PO4溶液的浓度小于40 mmol/L时,酒石酸和甲酸、乳酸和乙酸不能有效分离;当KH2PO4溶液的浓度为40 mmol/L和50 mmol/L时,分离效果无明显区别,8种有机酸能较好地实现分离。从节约成本的角度考虑,选择40 mmol/L KH2PO4-H3PO4缓冲溶液作为流动相。
2.1.3 流动相的pH值
用H3PO4分别将流动相的pH值调节至2.20、2.40和2.60,以考察pH值对分离效果的影响。实验结果表明,pH值为2.20时出峰较慢,峰形较宽;pH值为2.40时各有机酸分离效果最佳(见图1b); pH值为2.60时酒石酸和甲酸分离效果不理想。因此,选择40 mmol/L KH2PO4-H3PO4缓冲溶液(pH=2.40)作为流动相。
2.2 检测波长
检测波长是影响峰响应值的一个重要因素。基于有机酸在200~240 nm范围内有较强的紫外吸收,本研究考察了205、220和230 nm 3个波长。实验结果(见图2)表明,8种有机酸在205 nm波长处均有最大吸收峰,故本实验选用205 nm为检测波长。
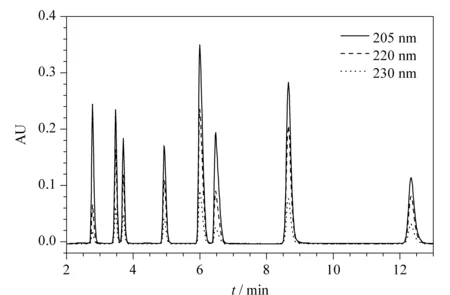
图 2 不同波长下有机酸混合标准溶液的色谱图Fig. 2 Chromatogram of a mixed standard solution at different wavelengths
2.3 流速
其他条件不变,分别以1.2、1.0、0.8和0.6 mL/min的流动相流速对有机酸混合标准溶液进行测定。实验结果表明,流速高于1.0 mL/min时柱压明显升高,当流速为1.2 mL/min时柱压约14.5 MPa;流速低于1.0 mL/min,分离时间不断延长。综合考虑分析时间和色谱柱柱压两个因素,最终选择最佳流速为1.0 mL/min, 8种有机酸能在13 min内完成很好的分离。
经优化后,在13 min内即可分离出8种有机酸,且峰形良好。因此,本实验的最佳色谱条件确定如下:以40 mmol/L KH2PO4-H3PO4缓冲溶液(pH=2.40)为流动相,流速1.0 mL/min,柱温25 ℃,在波长205 nm处紫外检测。
2.4 方法学考察
2.4.1 标准曲线与检出限
根据前述实验步骤和条件,将系列混合标准溶液依次等体积进样,以峰面积(y)对质量浓度(x, mg/L)进行线性回归,8种有机酸的线性回归方程、线性相关系数(R2)、线性范围见表1。对标准溶液进行稀释,取S/N=3时组分的质量浓度为检出限(见表1)。
2.4.2 回收率和精密度
为检验该方法的准确性,分别进行了回收率试验和精密度试验。在优化的条件下对李氏禾根系分泌物样本进行检测,样本中各有机酸背景值见表2。

表 1 各有机酸的线性关系和检出限Table 1 Linear relationships and limits of detection (LODs) of the organic acids
*y: peak area;x: mass concentration, mg/L. ** LODs were determined based on signal to noise ratio of 3 (S/N=3).
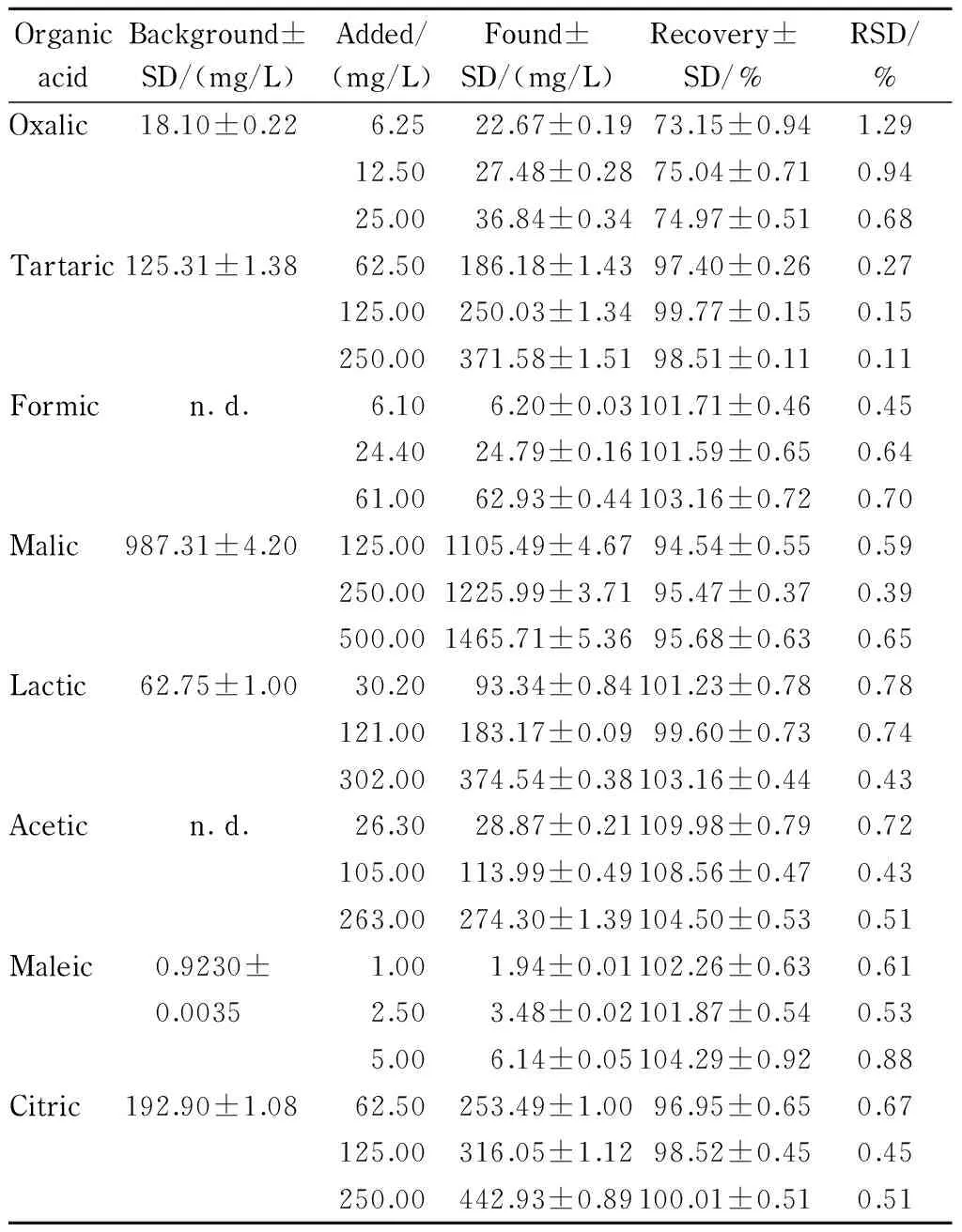
表 2 根分泌物中有机酸的回收率和精密度(n=5)Table 2 Recoveries and precisions of the organic acids spiked in the root exudate sample (n=5)
n.d.: not detected.
向样本中分别添加高、中、低浓度的各有机酸,在优化的色谱条件下测定并计算各有机酸的加标回收率和相对标准偏差(RSD),平行测定5次。实验结果(见表2)表明,除草酸外,其余各有机酸的回收率为94.54%~109.98%。精密度均在可接受的范围内。充分证明了该方法的准确性。该方法的线性范围及分析结果的精密度和回收率都能满足植物根系分泌物中有机酸定性和定量分析的要求。
2.5 样品的测定
采用优化后所确定的方法对李氏禾根系分泌物中的有机酸成分进行检测,根据保留时间对样品的色谱峰定性。用于根分泌物收集的0.5 mmol/L CaCl2溶液也通过同样的方法预处理后进行检测。将植物根系分泌物样品的色谱图同CaCl2溶液的色谱图作对比(见图3),确定3.035 min的色谱峰为溶剂峰。由于溶剂峰的保留时间与草酸非常接近,虽然对草酸的定性分析没有影响,但却在一定程度上影响了草酸定量分析的准确性。这也是草酸的加标回收率在74%左右的原因。在后续的研究中可尝试降低CaCl2的浓度,或用超纯水代替CaCl2溶液作为收集液,或在收集过程中增加曝气[22],以消除溶剂峰对检测结果的干扰。
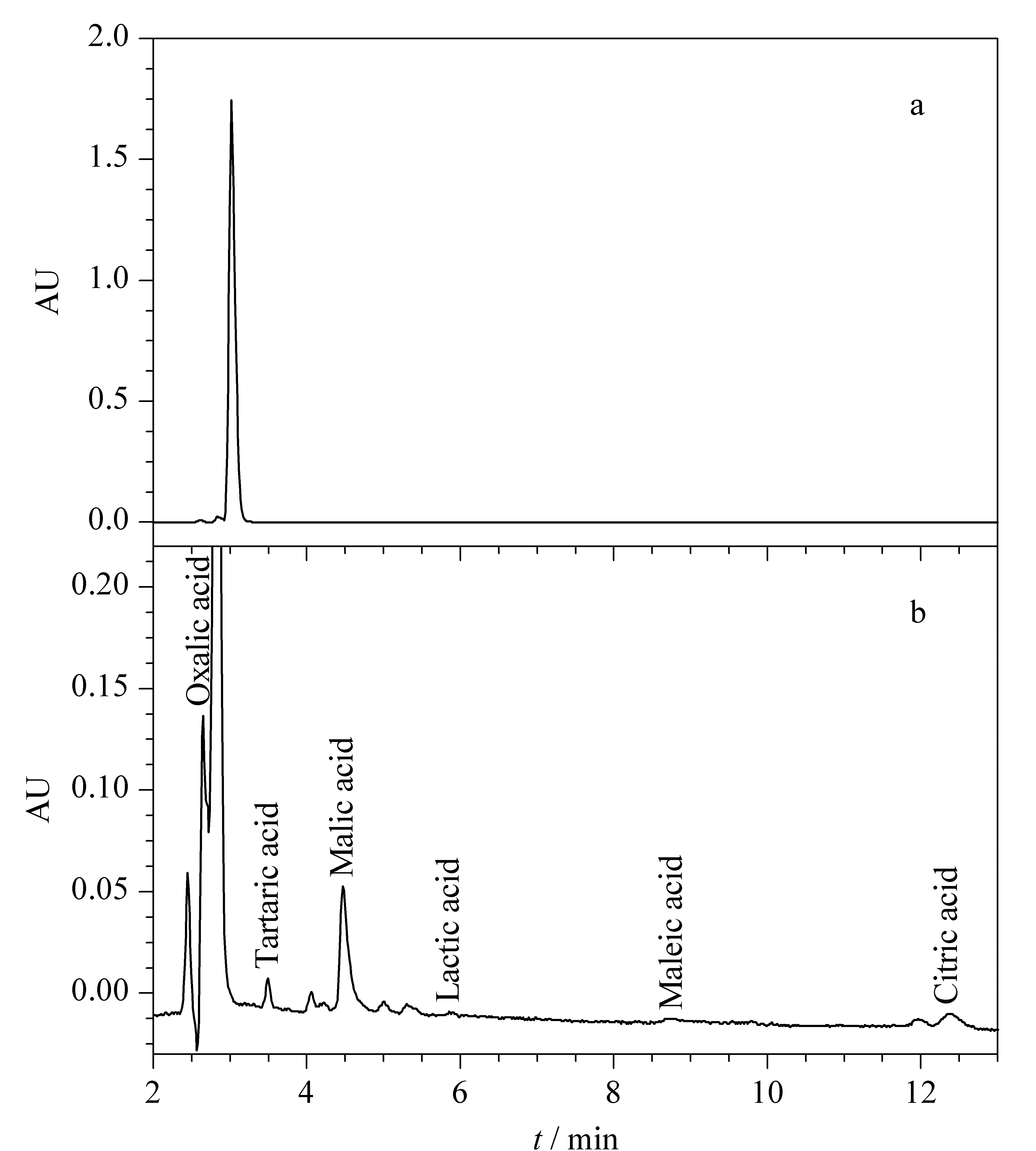
图 3 (a)根系分泌物样品和(b)用于根分泌物收集的0.5 mmol/L CaCl2溶液的色谱图Fig. 3 Chromatograms of (a) the sample of rootexudates and (b) 0.5 mmol/L CaCl2 solution used for root exudates collection
结果表明,李氏禾根系分泌物中可检测出草酸、酒石酸、苹果酸、乳酸、马来酸和柠檬酸6种有机酸。考虑到溶剂峰对草酸定量分析准确性的影响,只对其进行定性,不计算其含量。其余5种有机酸含量分别为酒石酸(130.90±1.44) μg/g(根干重)、苹果酸(1 031.34±4.38) μg/g(根干重)、乳酸(65.54±1.01) μg/g(根干重)、马来酸(0.960 00±0.003 67) μg/g(根干重)和柠檬酸(201.50±1.13) μg/g(根干重)。其中苹果酸含量最高,马来酸含量最低。另外,甲酸和乙酸未检出。由此可见,苹果酸是李氏禾根系分泌物有机酸中的优势组分。另外,柠檬酸和酒石酸也大量存在于李氏禾的根系分泌物中。
3 结论
本方法的建立为铬超富集植物根系分泌物中有机酸的研究提供了重要的检测手段。本方法可应用于后期研究中,以考察不同营养条件及胁迫条件下李氏禾根分泌物中有机酸成分的变化。检测结果对进一步探寻根系分泌物中有机酸对铬的作用机理,以及李氏禾对铬的耐受机制、解毒机制和富集机制都将具有重要意义。
[1] Dakora F D, Phillips D A. Plant Soil, 2002, 245(1): 35
[2] Lu L L, Tian S K, Yang X E, et al. J Zhejiang Univ Sci B (Biomed Biotechnol), 2013, 14(2): 106[3] Hou Y Y. [PhD Dissertation]. Shanghai: Shanghai University, 2016
侯芸芸. [博士学位论文]. 上海: 上海大学, 2016
[4] Zhang Z G, Wang M X, Yang H, et al. Guangdong Agriculture Sciences, 2013, 40(2): 219
张知贵, 王明贤, 杨华, 等. 广东农业科学, 2013, 40(2): 219
[5] Zhao K, Wu Y Y. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(5): 1002
赵宽, 吴沿友. 西北植物学报, 2014, 34(5): 1002[6] Yan S Y, Wang Y P, Wang Z Y, et al. Guangdong Agricultural Sciences, 2013, 40(11): 16
鄢盛尧, 王月平, 王志颖, 等. 广东农业科学, 2013, 40(11): 16
[7] Zhang L, Liu Y J, Chen Y. Journal of Green Science and Technology, 2017(11): 74
张力, 刘益君, 陈毅. 绿色科技, 2017(11): 74
[8] Tu S X, Sun J H, Guo Z F, et al. Soil and Environmental Sciences, 2000, 9(1): 64
涂书新, 孙锦荷, 郭智芬, 等. 土壤与环境, 2000, 9(1): 64
[9] Wang J X, Zhan F D, Li Y, et al. Chinese Journal of Eco-Agriculture, 2016, 24(3): 365
王吉秀, 湛方栋, 李元, 等. 中国生态农业学报, 2016, 24(3): 365
[10] Zhang X H, Luo Y P, Huang H T, et al. Acta Ecologica Sinica, 2006, 26(3): 950
张学洪, 罗亚平, 黄海涛, 等. 生态学报, 2006, 26(3): 950
[11] Lu Y Y, Zhang X H, Liu J, et al. Journal of Agro-Environment Science, 2013, 32(11): 2140
卢媛媛, 张学洪, 刘杰, 等. 农业环境科学学报, 2013, 32(11): 2140
[12] Wu C C, He Y Q, He C J, et al. Journal of Quanzhou Normal University, 2016, 34(6): 1
伍婵翠, 何彦琴, 何彩娇, 等. 泉州师范学院学报, 2016, 34(6): 1
[13] Wang P, Zhou R. Chinese Journal of Chromatography, 2006, 24(3): 239
王平, 周荣. 色谱, 2006, 24(3): 239
[14] Tian Z M, Qin F L, Wang B. Journal of Northwest A & F University (Natural Science), 2003, 31(4): 154
田中民, 秦芳玲, 王波. 西北农林科技大学学报(自然科学版), 2003, 31(4): 154
[15] Zhang J H, Zhang D S, Mao Z Q, et al. Journal of Agriculture University of Hebei, 2009, 32(4): 29
张江红, 张殿生, 毛志泉, 等. 河北农业大学学报, 2009, 32(4): 29
[16] Zhang Y F, Feng G, Li X L. Acta Ecologica Sinica, 2003, 23(1): 30
张玉凤, 冯固, 李晓林. 生态学报, 2003, 23(1): 30
[17] Pinto A P, Simoes I, Mota A M. J Plant Nutr, 2008, 31: 1746[18] Wang J, Wang D S. Journal of Liaoning Technical University (Natural Science), 2009, 28(9): 240
王君, 王东升. 辽宁工程技术大学学报(自然科学版), 2009, 28(9): 240
[19] Huang T Z, Wang S J, Liu X M, et al. Chinese Journal of Chromatography, 2014, 32(12): 1356
黄天志, 王世杰, 刘秀明, 等. 色谱, 2014, 32(12): 1356
[20] Jiang Y, Fan G F, Du R, et al. Chinese Journal of Chromatography, 2015, 33(8): 805
姜艳, 范桂芳, 杜然, 等. 色谱, 2015, 33(8): 805
[21] Ma R, Ouyang J, Li X, et al. Chinese Journal of Chromatography, 2012, 30(1): 62
马瑞, 欧阳嘉, 李鑫, 等. 色谱, 2012, 30(1): 62
[22] Lan Z M, Lin X J, Zhang W G, et al. Scientia Agricultura Sinica, 2012, 45(8): 1521
兰忠明, 林新坚, 张伟光, 等. 中国农业科学, 2012, 45(8): 1521

