2株芽孢杆菌生物学特性研究及菌种鉴定
陈雅茜 ,樊 溢 ,Saad Abdelrahman,王景雪
(1.山西大学生命科学学院,山西 太原 030006;2.新英格兰大学环境与农业学院,澳大利亚 阿米代尔 2350)
芽孢杆菌属(Bacillus)是一类非致病的对机体无害的好氧细菌,生长繁殖快,对消化道环境有较强的适应力,在一定条件下产生芽孢,由于芽孢的特殊结构使芽孢杆菌耐酸碱、耐高温和耐挤压,具有稳定性好、抗性强、复活性高等优势[1],在肠道酸性环境中可以稳定生存,是国家允许使用的饲料微生物菌种,并可分泌较强活性的蛋白酶、纤维素酶和淀粉酶等多种活性物质[2]。邝哲师等[3]研究发现,断奶仔猪饲养14 d后,添加芽孢杆菌制剂的试验组比对照组胃蛋白酶活性提高58.68%,胰淀粉酶活性提高24.05%,回肠内蛋白酶和淀粉酶活性分别提高61%和20.3%,差异均显著(P<0.05)。陈连民等[4]研究发现,日粮添加巨大芽孢杆菌1259可以有效地改善产蛋中后期蛋鸡生产性能及蛋品质。大量研究表明,将单一饲用微生态制剂及复合产品添加到家畜饲料中,具有减少和替代饲用抗生素的作用[5-10]。
碱性蛋白酶(alkaline protease)被广泛应用于洗涤剂、食品、丝绸、制革等行业,是目前市场上流行的洗涤添加剂,能大幅度提高洗涤去污能力。除了用于洗涤添加剂外,在21世纪初有人研究过蛋白酶脱毛,利用碱性蛋白酶处理羊毛也成为国内外研究热点。郝建华[11]对一种新型海洋碱性蛋白酶的部分性质及其在水解羊毛方面做了初步研究,结果表明,其具有良好的处理羊毛特性及发展潜力。由于微生物蛋白酶均为胞外酶,与动植物源蛋白酶相比具有易培养、产量高、成本低、生产快速、处理相对简单等优点,易于实现大规模生产,而且碱性蛋白酶比中性蛋白酶具有更强的水解能力和耐碱能力,因此,碱性蛋白酶的研究成为蛋白酶研究的热点[12-14]。由于碱性蛋白酶需求量大,能产生可观的经济效益,因此,筛选能产生碱性蛋白酶的新型菌株、通过适当物理或化学手段提高产酶量和研究碱性蛋白酶的酶学性质一直是研究的热点。
本试验首先通过常规细菌分离纯化方法将10株芽孢杆菌分离开,筛选出2株耐酸、耐胆盐、能产生纤维素酶和蛋白酶的菌株,并测定其产蛋白酶的能力大小,通过微生物常规生理生化检测结合分子生物学手段,鉴定出1株为短小芽孢杆菌,1株为Bacillus gobiens。
1 材料和方法
1.1 材料
供试菌株为从发酵食物中分离得到的10株芽孢杆菌。
基础培养基为LB培养基、发酵培养基、产纤维素酶培养基和产蛋白酶培养基[14]。
1.2 方法
1.2.1 芽孢杆菌的分离纯化及形态观察 将来自发酵食物中的10株芽孢杆菌混合菌液接种到LB液体培养基中,37℃,180 r/min置于恒温摇床培养24~36 h,取1 mL富集后的菌液用无菌生理盐水作梯度稀释,取100 μL 10-6菌液均匀涂布在LB固体培养基上,倒置于37℃恒温培养箱内培养24 h,挑取不同菌落形态单菌落平板划线分离培养,重复3~4次,可得纯化的菌株并编号。观察各菌株菌落形态,革兰氏染色并镜检,挑取各菌株分别接种于LB液体培养基内扩大培养24 h,用于后续试验。
1.2.2 芽孢杆菌的耐酸性试验 在LB液体培养基中加入HCl至pH值为2.0,按0.5%接菌量分别接入纯化后的各菌株,培养条件为37℃,180 r/min;未加HCl处理的培养基在同样的条件下培养,作为对照。分别取酸处理1,2 h的菌液以及对照组菌液用无菌生理盐水稀释至10-5,10-6,10-7浓度,每个梯度吸100 μL均匀涂布平板,重复3个平板,最后进行平板菌落计数并算出平均数,计算存活率。

其中,C1为不同浓度菌液在酸处理不同时间的活菌平均数;C0为未做酸处理的菌液在对应浓度及时间的活菌平均数;K为芽孢杆菌的存活率。
1.2.3 芽孢杆菌的耐胆盐试验 在LB液体培养基中加入猪胆盐至浓度为0.3%,培养条件同1.2.2;未加猪胆盐的培养基在同样的条件下培养,作为对照。分别取胆盐处理1,2 h的菌液以及对照组菌液用无菌生理盐水稀释至10-5,10-6,10-7浓度,每个梯度吸100 μL均匀涂布平板,重复3个平板,最后进行平板菌落计数并算出平均数,计算存活率。

其中,D1为不同浓度菌液在胆盐处理不同时间的活菌平均数;D0为未做胆盐处理的菌液在对应浓度及时间的活菌平均数。
1.2.4 芽孢杆菌的产纤维素酶能力试验 用灭菌接种环挑取斜面保存的筛选菌株点种于产纤维素酶平板中,于37℃恒温培养箱中培养72 h。在培养好的产纤维素酶平板中加入2 mL0.2%刚果红水溶液显色30 min,倒出显色液,加入3 mL1 mol/LNaCl洗脱液15 min,观察菌落周围是否出现水解圈。
1.2.5 芽孢杆菌的产蛋白酶能力试验 用灭菌接种环挑取斜面保存的筛选菌株点种于产蛋白酶平板中,于37℃恒温培养箱中培养72 h。在产蛋白酶平板上直接观察是否有透明水解圈出现。
1.2.6 酪氨酸标准曲线的绘制 参照中华人民共和国国家标准GB/T 23527—2009标准曲线绘制方法绘制。
1.2.7 样品蛋白酶活的测定 在300 mL发酵培养基中按1%接种量分别接种513-A和513-O,180 r/min,37℃培养24 h后离心,收集上清液并分别加入30%(NH4)2SO4固体搅拌,4 h后8 000 r/min冷冻离心,在上清液中缓慢加入70%(NH4)2SO4固体,边加边搅拌,整个过程都在冰浴上进行,4℃过夜后冷冻离心,沉淀用10 mL PBS缓冲液溶解,透析,4 h换一次蒸馏水,用AgNO3检测直到没有白色沉淀为止,制成的粗酶液用于后续酶活测定。蛋白酶活力测定参照国家标准GB/T 23527—2009中的样品测定方法测定并计算酶活力大小。
1.2.8 菌株生理生化特征鉴定 生理生化试验参照《常见细菌系统鉴定手册》[15]和《伯杰细菌鉴定手册》[16],对513-A和513-O分别进行MR试验、VP试验、接触酶试验、糖发酵试验、丙二酸盐利用、柠檬酸盐利用、渗透压试验、硝酸盐还原试验、亚硝酸盐还原试验、明胶液化、酯酶试验。
1.2.9 分子生物学鉴定 细菌总DNA的提取按Ezup柱式细菌基因组DNA抽提试剂盒操作。以提取的DNA为模板,PCR扩增引物为16S rDNA细菌通用引物,正向引物为27F:5′-AGAGTTTGATCCT GGCTCAG-3′,反向引物为 1429R:5′-GGTTACCTT GTTACGACTT-3′。扩增条件为 94℃ 4 min;94℃45 s,55℃45 s,72℃1 min,30 个循环;72℃10 min,4℃终止反应。PCR纯化产物由上海生工生物工程有限公司测序。根据16SrDNA测序结果,在NCBI GenBank中进行BLAST检索,再利用MEGA 7.0软件进行多序列匹配排列,采用Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 芽孢杆菌的分离和菌落形态观察
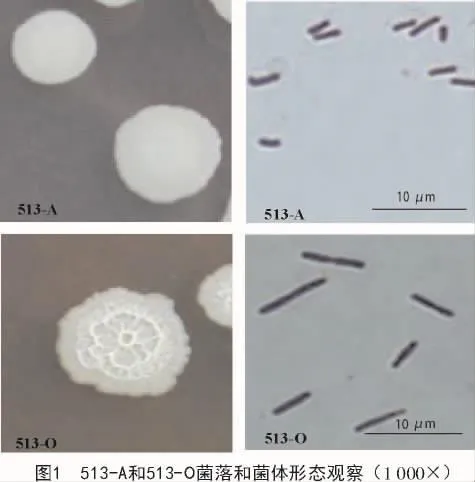
将10株待测菌经过革兰氏染色并镜检,最终确定 K1,K2,K3,513-A,K8,513-O,K10,K11,K12,K13号菌株为革兰氏阳性菌,呈直杆菌,芽孢近中生或端生,均为芽孢杆菌,观察到的杆菌菌落形态描述列于表1;其中,513-A和513-O菌落形态和显微结构如图1所示。

表1 10株芽孢杆菌菌落形态
2.2 耐酸性试验结果
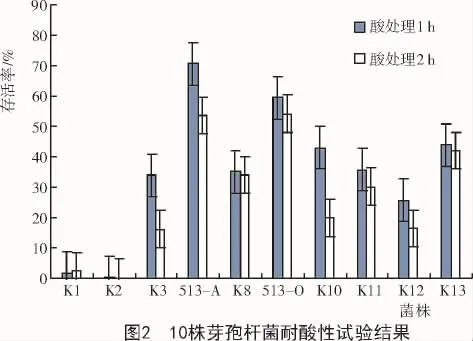
由图2可知,10株芽孢杆菌中,最耐酸的是513-A菌株,pH值为2.0的酸处理1 h的存活率在70%左右,处理2 h的存活率也在50%以上;较耐酸的是513-O菌株,pH值为2.0的酸处理1,2 h的存活率都在50%以上;不耐酸的是K1,K2菌株,存活率分别为3.03%和0.77%。因此,筛选出513-A和513-O为2株耐酸芽孢杆菌。
2.3 耐胆盐试验结果
由图3可知,这10株芽孢杆菌中,最耐胆盐的是513-O菌株,0.3%胆盐处理1 h的存活率在87%左右,处理2 h的存活率在70%左右;较耐胆盐的是513-A菌株,0.3%胆盐处理1 h的存活率接近70%,处理2 h的存活率在60%左右;不耐胆盐的是K1,K10菌株,存活率分别在1%和10%左右;因此,筛选出513-A和513-O菌株为耐胆盐芽孢杆菌,再结合耐酸试验结果,最终确定513-A和513-O菌株作为后续试验的菌种。

2.4 产酶能力试验结果
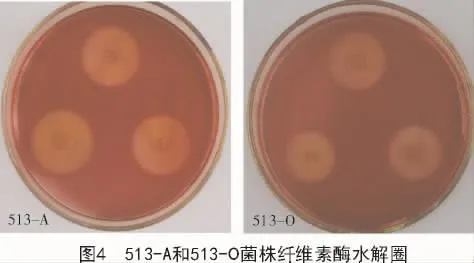
2.4.1 产纤维素酶定向分析 按照1.2.4的步骤进行试验所得结果如图4所示。从图4可以看出,513-A和513-O菌株周围均出现了透明圈,说明513-A和513-O菌株均有产生纤维素酶的能力,但能力大小不同。测量水解圈直径可知,513-A菌株产纤维素酶能力要大于513-O菌株(图5)。

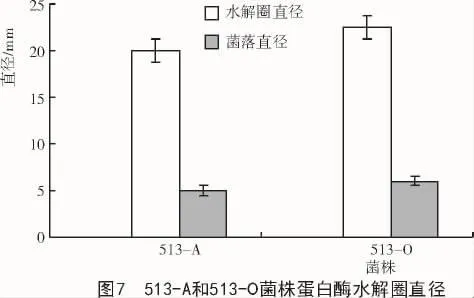
2.4.2 产蛋白酶定向分析 按照1.2.4的步骤进行试验所得结果如图6所示。从图6可以看出,513-A和513-O菌株周围均出现了水解圈,说明513-A和513-O菌株均有产生蛋白酶的能力,但能力大小不同。测量水解圈直径可知,513-O菌株产蛋白酶能力要大于513-A菌株(图7)。

2.5 蛋白酶活力大小测定结果
2.5.1 酪氨酸标准曲线的绘制 以酪氨酸为标准品,根据酪氨酸不同含量所对应的不同吸光度值绘制标准曲线(y为吸光度值,x为酪氨酸含量),如图8所示。所得标准曲线回归方程为:y=0.009 7x-0.005 1,R2=0.999 3。

2.5.2 菌株蛋白酶活大小测定结果 按照1.2.7的方法进行试验所得结果如图9所示。

由图9可知,513-A和513-O菌株均无酸性蛋白酶活性;513-O菌株的中性蛋白酶和碱性蛋白酶活力均高于513-A菌株,分别为56.52,65.72 U/mL,且513-O菌株的碱性蛋白酶活力最大。
2.6 513-A和513-O菌株生理生化特征鉴定
513-A和513-O菌株生理生化特征列于表2,并参考《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》进行鉴别。

表2 513-A和513-O菌株生理生化特征
2.7 分子生物学鉴定
分别以513-A和513-O这2个菌株细菌DNA为模板,16SrDNA通用引物进行PCR扩增,获得了2条长度分别为1 426,1 441 bp的PCR产物;系统进化树构建结果如图10,11所示。
由图10可知,菌株513-A和短小芽孢杆菌遗传距离最小,亲缘关系最近,测序结果显示,513-A菌株与短小芽孢杆菌(KC771051.1)特异性序列同源性达到99%,且513-A菌株与短小芽孢杆菌生理生化特征十分相似,判定513-A菌株为短小芽孢杆菌。
由图11可知,菌株513-O与Bacillus gobiensis遗传距离最小,亲缘关系最近,测序结果显示,513-O 与 Bacillus gobiensis(NZ CP012600.1)特异性序列同源性达到99%,因此,推断513-O菌株为Bacillus gobiensis。


3 讨论
传统的细菌分类鉴定方法如菌落形态观察和革兰氏染色等,存在判断粗略、误差大等缺点,无法满足现代细菌学研究的发展要求。随着分子生物学的发展,16S rDNA成为细菌系统分类研究中最常用和最有效的分子指标[17],因为其种类少,含量大,分子大小适中,约1.5 kb左右,在结构与功能上具有高度的保守性,既能体现不同菌属之间的差异,又能利用测序技术较容易得到其序列。一般认为,16SrDNA序列同源性大于99%,可认为属于同一种;同源性为95%~98%可认为是同属不同种;同源性在95%以下可认为不同属[18-19]。本试验中对513-A和513-O的DNA进行PCR扩增得到的产物片段大小分别为1 426,1 441 bp,具有典型的16S rDNA特征。在GenBank中进行序列比对发现,513-A菌株与短小芽孢杆菌特异性序列同源性达到99%,并且其菌落形态和生理生化特性与短小芽孢杆菌基本一致,因而,可认为513-A菌株为短小芽孢杆菌;513-O菌株与Bacillus gobiensis特异性序列同源性达到99%,说明属于同一种,再结合系统进化树可知,与Bacillus gobiensis亲缘关系最近,故初步推断513-O菌株为Bacillus gobiensis。除了16S,其他保守基因或者种的特有基因,以及多种分子生物学手段都能为菌种的鉴定提供一定证据。
由于动物体内环境十分复杂,如胃液的酸性环境、肠道的胆盐环境以及酶分解的作用等都是影响益生菌存活率的重要因素,因此,1株优良的益生菌必须具备一定的耐酸性和耐胆盐性[20-21]。芽孢杆菌能分泌促进动物机体消化营养物质的酶类,如淀粉酶、蛋白质酶、纤维素酶等,从而提高动物对有机饲料的吸收利用率。本试验中筛选出的513-A和513-O菌株在pH值为2.0的酸性和0.3%胆盐环境中能保持较高的存活率,具有较强的耐酸和耐胆盐能力,这是其可作为饲料添加剂的前提;通过产酶定性试验得出,513-A菌株产纤维素酶能力优于513-O菌株,意味着513-A菌株有较强的消化纤维素的能力;513-O菌株产蛋白酶能力优于513-A菌株,意味着513-O菌株有较强消化蛋白的能力,因此,2个菌株均具有作为益生菌候选菌种的潜力。此外有研究表明,微生物饲料添加剂具有维护动物肠道健康、缓解不良应激、改善畜舍环境及净化水质[22]、调节机体脂肪代谢和改善畜产品品质等功能[23]。
目前,国内外碱性蛋白酶主要应用于洗涤及皮革等行业,90%以上洗涤剂均添加了碱性蛋白酶,且呈上升趋势,因此,市场出现供不应求的状况[24]。碱性蛋白酶主要存在于细菌、放线菌和真菌中,研究较多的种属有枯草芽孢杆菌、短小芽孢杆菌、嗜碱性芽孢杆菌、地衣芽孢杆菌、纳豆芽孢杆菌、米曲酶、栖土曲霉、灰色链霉菌、费氏链霉菌、镰刀菌等[25]。但我国常用于工业生产的产碱性蛋白酶菌株种类还不够丰富,品种较为单一。本试验中筛选出的产碱性蛋白酶菌株513-O为Bacillus gobiensis,国内外均鲜有报道,可作为产碱性蛋白酶芽孢杆菌种类的一个补充,更加完善了产酶菌株体系;并且本试验对其生理生化特性以及产酶特性进行了初步研究,填补了该菌株在这方面研究的空白。此外,本试验筛选出的2株菌株产碱性蛋白酶活力均不是很高,后续可通过适当的方法来提高它们的产酶能力,如改变发酵条件、诱变育种或用基因工程手段在分子水平进行定向改造等。
[1]付天玺,魏开健,许国焕.芽孢杆菌在水产养殖中的研究和应用概况[J].水利渔业,2007,27(3):102-104.
[2]曹晓敏.益生芽孢杆菌的筛选、鉴定及发酵条件优化的研究[D].福州:福建师范大学,2009.
[3]邝哲师,田兴山,张玲华,等.芽孢杆菌制剂对断奶仔猪体内消化酶的影响[J].中国畜牧兽医,2005,32(6):17-18.
[4]陈连民,喻礼怀,王淑楠.日粮添加巨大芽孢杆菌1259对蛋鸡生产性能及蛋品质的影响 [J].华北农学报,2016,31(Z):480-484.
[5]郭照宙,崔红霞,武洪志,等.枯草芽孢杆菌在动物饲料中的应用[J].饲料博览,2017(6):26-28.
[6]刘化伟,曲全业,张晓杰,等.活性酵母对断奶仔猪生产性能的影响研究[J].饲料博览,2017(1):26-28.
[7]洪文,唐泽华,胡远亮.凝结芽孢杆菌对断奶仔猪生长性能的影响[J].养殖与饲料,2016(3):19-21.
[8]程志斌,王春,李云辉,等.日粮添加饲用凝结芽孢杆菌对蛋鸡生产性能的影响[J].饲料博览,2015(11):1-4.
[9] MOALLEM U,LEHRER H,LIVSHITZ L,et al.The effect of live yeast supplementation to dairy cows during the hot season on production,feed efficiency,and digestibility[J].J of Dairy Sci,2009,92(1):343-351.
[10]彭虹旖.短小芽孢杆菌(Bacillus pumilus 4D-14)的分离与分子鉴定,抑菌性及微生态制剂应用研究[D].青岛:中国海洋大学,2013.
[11]郝建华.海洋碱性蛋白酶性质研究及其在羊毛加工中的初步应用[J].毛纺科技,2011,39(11):1-5.
[12]DENG A,WU A J,ZHANG Y,et al.Purification and characterization of a surfactant-stable high-alkaline protease from Bacillus sp.B001[J].Biores Technol,2010,101(18):7100-7106.
[13] GUPTA R,BEG Q,LORENZ P.Bacterial alkaline proteases:molecular approaches and industrial applications[J].Appl Microbiol Biotechnol,2002,59:15-32.
[14]BHASKAR N,SUDEEPA E S,RASHMI H N,et al.Partial purification and characterization of protease of Bacillus proteolyticus-CFR3001 isolated from fish processing waste and its antibacterial activities[J].Biores Technol,2007,98(14):2758-2764.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:62-64.
[16]R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:732-735.
[17]曾润颖.一株具抗肿瘤活性的北极细菌的筛选及分子鉴定[J].厦门大学学报,2002,41(6):800-803.
[18]DEVEREUXR,HE SH,DOYLE CL,et al.Diversityand origin of desulfovibriospecies-phylogenetic definition ofa family[J].Journal ofBacteriology,1990,172(7):3609-3619.
[19]FRY N K,WARWICK S,SAUNDERS N A,et al.The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family legionellaceae[J].Journal of General Microbiology,1991,137(5):1215-1222.
[20]SIMPSON K L,PETTERSSON B,PRIEST F G.Characterizater of Lactobacilli from Scotch malt whisky distilleries and description of Lactobacillus ferintoshensis sp.Nov.,a new species isolated from malt whiskyfermentation[J].Microbiology,2001,147:1007-1016.
[21]GUZEL S Z B,SEYDIM A C.Determination of organic acids and volatile flavor substancesin kefir duringfermentation[J].Journal of Food Composition and Analysis,2000,13(1):35-43.
[22]张峰峰,谢凤行,赵玉洁.枯草芽孢杆菌水质净化作用的研究[J].华北农学报,2009,24(4):218-221.
[23]徐鹏,董晓芳,佟建明.微生物饲料添加剂的主要功能及其研究进展[J].动物营养学报,2012,24(8):1397-1403.
[24]邓菊云.微生物碱性蛋白酶研究进展 [J].现代食品科技,2008,24(3):293-296.
[25]伍先绍,贺稚非,刘琳,等.碱性蛋白酶产生菌株的筛选及其酶学性质研究进展[J].中国食品添加剂,2008,3(4):58-59.

