改性膨润土和沉水植物联合作用处理沉积物磷
刘子森,张 义,王 川,蔺庆伟,闵奋力,周巧红,刘碧云,贺 锋,吴振斌 (.中国科学院水生生物研究所,淡水生态和生物技术国家重点实验室,湖北 武汉 430072;2.中国科学院大学,北京 00049)
磷是淡水水体富营养化过程的关键性影响因子之一[1-2].水体中磷的来源包括外源输入和内源释放[3].在外源磷的输入得到有效控制的情况下,内源沉积物作为湖泊营养物质的重要蓄积库,它不仅是外来污染物的归宿,同时自身营养盐的释放成为上覆水体磷的重要来源[4-5].湖泊沉积物磷的控制技术主要分为异位控制技术和原位控制技术两大类.异位控制技术中常采用的是具有清污彻底,处理技术较成熟的底泥疏浚技术,但其易对湖泊生态系统多样性造成威胁,易对环境造成二次污染[6-8].原位控制技术包括原位物理覆盖技术[9-11]、原位化学处理技术[12-14]和原位生物修复技术[15-17].相比于异位控制技术,沉积物磷原位控制技术直接在原地对污染底泥进行处理,可避免底泥再悬浮引起大量磷向水体释放,减少二次污染,且处理成本较低.
沉水植物能够通过直接吸收、促进含磷物质的沉降、抑制表层沉积物的再悬浮、改变底泥理化性质,增加沉积物中微生物的量等来降低沉积物磷的释放[18-20].苦草(Vallisneria spiralis,V.spiralis)是一种多年生无茎沉水植物,广泛分布于我国淡水湖泊与河流中.目前,已有一些关于V.spiralis对富营养化水体的修复作用的研究[21-23].但沉水植物易受温度、水质等环境因素的影响,需结合其它技术以实现对沉积物磷的有效控制.
膨润土是一种以蒙脱石为主要矿物成分的层状粘土矿物,在自然界中分布较广[24-25].膨润土因其吸附性能高,性能稳定且价廉,无二次污染等优点而应用广泛.但未经处理的膨润土因杂质含量较高而影响其吸附性能,因此需要对其进行改性处理[26-27].本研究采用改性膨润土(MB)作为原位物理化学吸附材料,并将其与沉水植物V.spiralis联合应用于杭州西湖沉积物磷处理,首次探讨MB与V. spiralis联合作用对沉积物各形态磷的吸附效果,以期实现富营养化湖泊沉积物磷高效脱磷,对充分发挥粘土矿物和沉水植物协同作用、有效控制富营养化湖泊内源磷污染问题有重要的理论和实际意义.
1 材料与方法
1.1 研究位点及样品采集
杭州西湖(120°08′E,30°15′N)位于浙江省杭州市西面,是典型的浅水城市湖泊,湖泊水面面积6.5km2,平均水深为2.27m.西湖的子湖之一小南湖局部湖区沉积物污染严重.用彼得森采泥器(HNM1-2型)现场采集了小南湖湖心(30°23′16′N,120°13′18′E)表层0~10cm的底泥(采样点水深2.05~2.20m,泥深约0.5m)作为本研究的沉积物样品.采集的沉积物样品现场用氧化还原(ORP)去极化法全自动测定仪测定氧化还原电位和pH,当天运回实验室,并分别对其进行实验设计:栽种V. spiralis、铺设不同厚度的MB以及在铺设了MB的沉积物上栽种V. spiralis.采样点如图1所示.

图1 沉积物采样点Fig.1 The geographic location of the sampling site
沉积物采集的同时对其上覆水进行相关理化性质分析(经0.45μm微孔滤膜过滤,过滤后的上覆水置于冰箱4℃保存备用),分析结果见表1.

表1 沉积物上覆水的理化性质Table 1 Physical and chemical characters of overlying water above sediments
1.2 试验材料
膨润土颗粒(3~5mm)采购于山东泗水恭发有限公司.采用酸改性、盐改性、高温焙烧改性及复合改性等多种改性方法对膨润土原土(RB)颗粒进行改性处理,通过研究不同MB对沉积物总磷的吸附性能,确定最佳改性方法[28].本研究将RB浸入10%的Na2CO3溶液(固液比为1:3),水浴加热搅拌2h(70℃),用蒸馏水洗至中性,于150℃烘干后置于马弗炉(450℃)煅烧2h,制得MB.
1.3 试验方法
试验所用的沉积物和上覆水取自小南湖表层沉积物(0~10cm)和湖水.试验共设计5个处理组: V. spiralis组、MB组(共3组,分别为厚度1cm MB组、3cm MB组和5cm MB组)、厚度5cm MB+V. spiralis组,每组3平行.直径45cm、高55cm的聚乙烯桶内填充10cm底泥和60cm湖水,有植物的处理组栽种大小形态相近长约20cm的沉水植物V. spiralis,插入沉积物深度约为4cm.种植时保证生物量一致,每个聚乙烯桶中种植9株V. spiralis.植物种植后需稳定5d,5d后即可开始试验,每间隔一个月采一次样,测定沉积物中各形态磷含量.150d后采集沉积物,带回实验室于-80℃保存,留作微生物试验样品.
1.4 16S rRNA高通量测序
使用保存于-80℃的沉积物样品提取细菌DNA.以Omega E.Z.N.A.TMSoil DNA 试剂盒,依照说明书的步骤进行DNA的提取.将提取后的DNA以正向引物515F(5′-GTGCCAGCMGCCGCGG-3′)和反向引物907R(5′CCGTCAATTCMTTTRAGTTT-3′)对16S rDNA基因的V4~V5区进行扩增.PCR过程采用ABI GeneAmp® 9700循环加热仪进行.具体的为:20μL混合体系含有10ng DNA模板,250μM dNTPs,上下游引物各0.2μM,0.4μL FastPfu DNA Polymerase,4μL of 5×TransStart® FastPfu Buffer.PCR过程包含27个循环,每个循环95℃变性30s,55℃退火30s,72℃延伸45.对扩增产物进行纯化和定量之后,构建DNA文库.此后,通过Illumina HiSeq 2500platform生成250bp paired-end (PE)的原始序列.
依据序列标签将原始序列对应于每个样品,经过数据拆分,去引物序列、PE Reads拼接、Tags质量及长度过滤饱和截取以及去嵌合体后,每个样品获得的有效序列的平均数为35.493.对所有样品的全部有效序列进行97%的一致性(Identity)聚类,形成OUT.使用R软件进行OUT各个分类等级的注释比例和各个分类等级物种相对丰度的统计.
1.5 微生物群落P代谢功能预测
采用PICRUSt(http://picrust.github.com)软件进行微生物群落功能的预测.预测得到的基因家族的丰度以与预期的16S rRNA基因拷贝数1000进行校正,并生成功能分类图谱KEGG Orthology(KO).选择涉及P代谢途径的KOs以得到每个样品有关P代谢功能基因的总丰富度.作为构建P代谢功能OUTs的选择方法,参考网站(http:picrust.Github.jo/picrust/scripts/metagenome_contributions.html1#metagenome-contributions)
1.6 分析方法
1.6.1 沉积物磷形态的分级提取及磷浓度测定 沉积物各形态磷的分级提取采用SMT磷分级分离方法[29].该法具有操作简单,提取独立,准确性高等优点,且各形态磷的测定值可相互检验.该法将沉积物磷形态分为铁铝磷(Fe/Al-P,主要是吸附在沉积物表面的弱吸附态磷,Al、Fe、Mn氧化物和水化物结合的磷),钙磷(Ca-P,主要是与Ca结合的磷),无机磷(IP),有机磷(OP)和总磷(TP)5种.沉积物各形态磷含量的测定采用钼酸铵分光光度法[30].沉积物磷的去除量计算公式为:q=b-c(1),沉积物磷去除率的计算公式为:a=(b-c)/b× 100%(2).式中:q为沉积物磷的去除量,mg/kg;a为沉积物磷的去除率,%;b和c分别为吸附前和吸附后的沉积物磷含量,mg/kg.
1.6.2 微生物统计分析 针对不同处理组微生物菌门和菌属的相对丰度,以方差分析判断配对组之间微生物相对丰度差异的显著性(P<0.05).配对组两两比较的设置如下:MB vs V.spiralis;MB vs V.spiralis.
1.6.3 仪器表征 改性前后膨润土的元素组成分析采用荷兰PANalytical.B.V公司X射线光谱仪(XRF,Axios advanced X型);内部微观结构采用日本理学公司的转靶X射线衍射仪(XRD,RU-200B/D/MAX-RB RU-200B型);表面微观形貌采用日本电子公司的扫描电子显微镜(SEM,JSM-5610LV型).
2 结果与讨论
2.1 试验材料性质

表2 沉积物基本理化性质Table 2 Properties and chemical compositions of sediment

表3 改性前后膨润土的化学组成(wt. %)Table 3 The chemical compositions of the bentonite particles before and after modification (wt. %)

图2 膨润土原土和改性膨润土的XRD图Fig.2 XRD patterns of of RB and MB
沉积物各形态磷含量及其它物理化学性质如表2所示.由表2可知,沉积物磷主要以IP形态存在,占TP的80.5%,沉积物磷的活性较高,释磷风险较大[31].
经改性处理后,MB较RB的SiO2,Al2O3,CaO,MgO,TiO2,P2O5含量降低,Na2O含量明显增加(表3),基本矿物组成未发生变化,主要矿物成分为蒙脱石、钠长石、方石英等(图2),形态更加粗糙(图3).

图3 改性前后膨润土SEM图Fig.3 SEM images of RB and MB
2.2 苦草对沉积物各形态磷的去除情况
试验过程中V. spiralis对沉积物各形态磷的去除效果如图4所示,由图可以看出:实验运行30d时,TP、IP、OP、Fe/Al-P和Ca-P各形态磷的去除量分别为40.86、25.16、11.99、16.93和6.78mg/kg.随着运行时间的持续增加,沉积物各形态磷的去除量基本上持续增加,但在60~90d时有轻微回落,TP、IP、OP、Fe/Al-P和Ca-P在150d时的去除量分别为181.6、148.74、26.32、101.74和44.99mg/kg.在365d时,TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为241.89、183.21、46.23、128.73和50.03mg/kg,它们的去除率分别为16.97%、15.99%、16.63%、23.07%和8.61%.沉水植物V. spiralis通过根系等的直接吸收或间接影响,降低了间隙水中磷的浓度,减小了与上覆水的浓度差,减缓了沉积物磷释放的速度,降低了沉积物中的磷含量[32].

图4 V. spiralis对沉积物各形态磷的去除效果Fig.4 Removal performance of V. spiralis on sediment P in all fractions
2.3 MB与V. spiralis联合作用处理沉积物各形态磷
2.3.1 厚度1cm MB +V. spiralis联合处理沉积物磷 如图5所示,0~60d内,沉积物OP的去除量逐渐增大,之后趋于平稳;沉积物TP、IP、Fe/Al-P和Ca-P去除量随着时间的推移而增大.在反应时间为150d时,TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为431.6、307.4、113.8、200.5和117.8mg/kg;当反应时间为365d时,TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为557.3、398.1、135.6、267.2和129.7mg/kg,它们的去除率分别为39.2%、34.7%、50.8%、47.9%和22.3%.由此可知,厚度1cm MB和V. spiralis联合组对沉积物磷的去除过程随着作用时间的增加,去除量越来越大,且去除的沉积物磷以OP和Fe/Al-P为主.MB的加入明显减少了沉积物中的磷含量,本组沉积物TP的去除率是V. spiralis组的2.30倍.2.3.2 厚度3cm MB +V. spiralis联合处理沉积物磷 如图6所示,沉积物各形态磷的去除量在0~60d内先增大,此后增长缓慢.沉积物中的磷在V. spiralis与3cm厚的MB作用下,在反应时间为150d时,TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为551.2、337.2、210.9、179和151.2mg/kg;在365d它们的去除量分别为671.3、431.5、221.1、221.7和202.9mg/kg,它们的去除率分别为47.2%、37.7%,82.8%、39.7%和35.0%.由此可知,厚度3cm MB+V. spiralis联合组对沉积物磷的去除有一定效果,与厚度1cm MB+V. spiralis联合组对沉积物磷的去除效果相比,TP、OP、IP、Fe/Al-P、Ca-P各形态磷的去除量在365d时分别增加了114、33.4、85.5、-45.5、73.2mg/kg,即厚度3cm MB+V. spiralis联合组对沉积物TP、OP、IP和Ca-P的去除效果较好,但其对沉积物Fe/Al-P的去除量比厚度1cm MB+V. spiralis联合组的去除效果差.

图5 厚度1cm MB和V. spiralis联合对沉积物各形态磷的去除效果Fig.5 V. spiralis and 1cm MB on sediment P removal

图6 厚度3cm MB和V. spiralis联合对沉积物各形态磷的去除效果Fig.6 V. spiralis and 3cm MB on sediment P removal
2.3.3 厚度5cm MB+V. spiralis联合处理沉积物磷 如图7所示,沉积物中的磷在V. spiralis与5cm厚的MB的作用下,0~60d内沉积物TP的去除量增长趋势明显,60d以后,去除量的增长速度缓慢.随着作用时间的持续,沉积物IP、OP、Fe/Al-P和Ca-P的去除量逐渐增大.作用时间为150d时,沉积物TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为615.6、371.4、242.4、236.3和145.7mg/kg;在365d时,它们的去除量分别为851.3、654.2、181、372.3和259.2mg/kg,去除率分别为59.8%、57.1%、67.8%、66.7%和44.7%.厚度5cm MB+V. spiralis联合组对沉积物各形态磷的去除过程中,效果最明显的磷形态由强至弱分别为Fe/Al-P>OP>TP>IP>Ca-P,因此本组实验对Fe/Al-P和OP的去除效果尤为明显. Fe/Al-P是与沉积物中易发生氧化还原作用的铁氧化物或铁氢氧化物结合的磷.大部分的研究认为这种形式的磷是较易于释放的,在沉积物中起到指示污染物的作用[33-34].沉水植物V.spiralis在生长的过程中通过发达的根系能够大量地吸收利用沉积物中的Fe/Al-P,以满足自身生长的需要[35-36].这可能是导致Fe/Al-P在植物根系区域较低的原因之一.
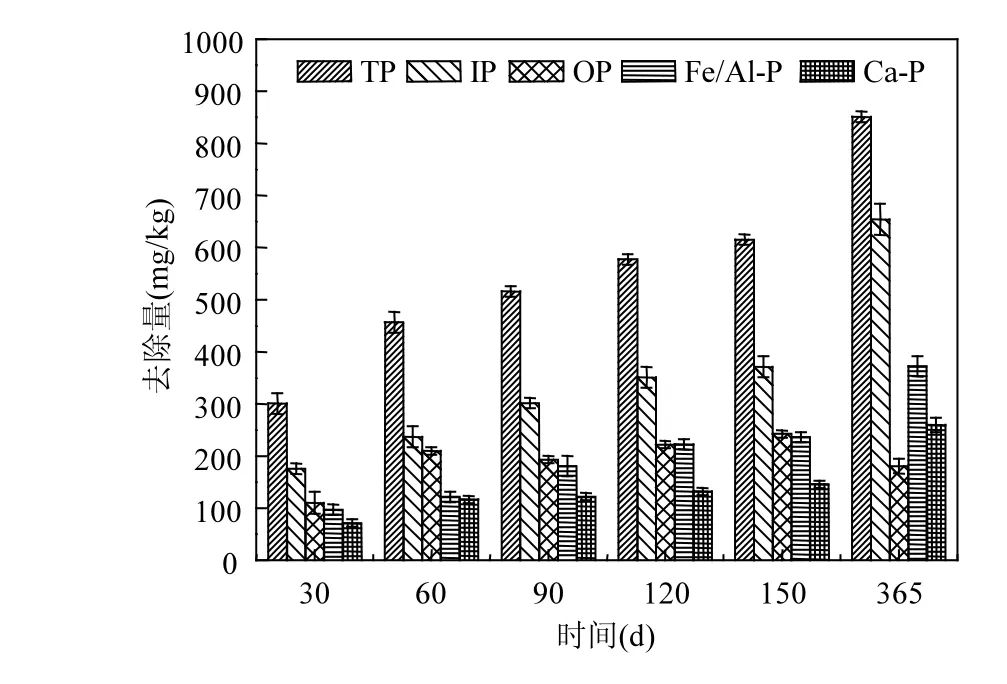
图7 厚度5cm MB和V. spiralis联合对沉积物各形态磷的去除效果Fig.7 V. spiralis and 5cm MB on sediment P removal
厚度为5cm MB对沉积物各形态磷的处理效果如图8所示.在作用时间为365d时,沉积物TP、IP、OP、Fe/Al-P和Ca-P的去除量分别为421.6、260.8、143.9、178.8和78.2mg/kg,去除率分别为29.6%、22.8%、53.9%、66.4%和29.2%.

图8 厚度5cm MB对沉积物各形态磷的去除效果Fig.8 Sediment P removal effect by 5cm MB
由图5~图8可知,不同厚度的MB对沉积物磷的去除效果不同.作用时间为150d时,厚度5cm MB+V. spiralis对沉积物TP的联合去除量较厚度1cm MB+V. spiralis对沉积物TP的联合去除量高184mg/kg;365d时高达294mg/kg.由表4可知,厚度5cm MB与沉水植物V. spiralis对沉积物磷的联合作用效果优于MB和沉水植物V.spiralis单独作用之和. V. spiralis和MB对沉积物磷的去除过程中,可能存在有益于去除沉积物磷的相互促进作用.分析原因可能为:MB含有某些微量元素,可促进植物生长,从而进一步加强了对沉积物磷的吸收;多孔状表面粗糙的MB,可附着大量微生物,MB颗粒表面微生物和沉水植物V.spiralis根系微生物同时作用,对沉积物磷进行矿化作用;沉水植物的吸收和矿化作用,使难以吸附的OP等转化为易被吸附的IP. V. spiralis根系通过提高根系周围溶解氧,改变沉积物环境,来影响沉积物中各形态磷之间的迁移转化,同时V.spiralis生长过程中吸收利用大量沉积物中的磷,从而导致了沉积物各形态磷含量的空间差异[37].

表4 3种不同处理方式对沉积物TP的最大去除量(mg/kg)Table 4 The maximum removal amounts of TP in sediment with three technologies (mg/kg)
2.4 MB与苦草联合作用对沉积物微生物群落结构及P代谢功能的影响
如图9所示,配对组微生物相对丰度的方差分析表明,在菌门水平下,相比单一V. spiralis组或单一MB组,联合组中厚壁菌门Firmicutes和Spirochaetes丰度更高,而绿湾菌门Chloroflexi 丰度较低.在菌属水平下,相比单一V.spiralis组或单一MB组,联合组中PSB-M-3,HB-118,desulfobacca和Gracilibacter丰度更高.相比单一MB组,分别属于硝化螺旋菌门和变形菌门的菌属4-29和Dok59在联合组中丰富度更高;然而相比单一V.spiralis组,这两个属在联合组中丰度较低.分别属于厚壁菌门和硝化螺旋菌门的Lactococcus和Caldilinea则与4-29和Dok59这两个菌属呈现相反的规律.
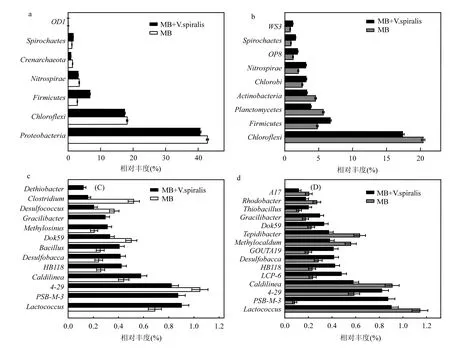
图9 处理组两两比较下相对丰度具有显著性差异(P<0.05)的微生物门和属Fig.9 Comparison analysis of microorganisms with significant difference (P<0.05) between different treatments (V.spiralis vs MB + V. spiralis; MB vs MB + V. spiralis) on phylum (a and b) and genus (c and d) level
利用PICRUSt进行微生物群落功能预测,得到了涉及P代谢的基因家族的相对丰度.群落中涉及P代谢的总共361个Kos在单一MB组、单一V. spiralis组和联合组中的基因丰度分别为9.65%,9.55%和9.59%.如图10所示,在属水平上,变形菌门的Anaeromyxobacter和Dechloromonas、厚壁菌门的Lactococcus以及硝化螺旋菌门的4-29和Nitrospira是本研究沉积物微生物群落涉及P代谢功能的主要菌属.这5个属合计对沉积物微生物菌落P代谢功能的贡献率约为50%.属于厚壁菌门Erysipelotrichaceae科的菌属PSB-M-3,其在联合组中对P代谢的贡献率为6.26%,而在两个单一组中贡献率均低于0.7%.相比单一MB组和联合组,菌属Anaeromyxobacter,Dechloromonas,4-29和Nitrospira在单一V. spiralis组中对P代谢功能的贡献率更高.相比单一V. spiralis组和联合组,厚壁菌门的3个属Lactococcus,Tepidibacter和Exiguobacterium在单一MB组中对P代谢功能的贡献率更高.以上分析结果表明,MB和V. spiralis联合作用下,厚壁菌门属PSB-M-3增强了沉积物微生物群落P代谢功能.
Dechloromonas sp.和Nitrospira sp.通常在脱氮除磷的污水处理系统中共存.Dechloromonas[38]曾被报道为聚磷菌出现在氧化沟污水处理厂[39]和续批式污泥反应中[40].属于Dechloromonas和Exiguobacterium的某些菌种可以对不同的无机磷源和有机磷源进行溶解或矿化[41-42].以上菌属对于沉积物磷的积累、溶解和矿化促进了MB和V. spiralis联合组对沉积物P的去除.通过增加厚壁菌门Erysipelotrichaceae科菌属PSB-M-3的丰度,联合组相比单一组沉积物微生物群落P代谢的功能得以增强.Erysipelotrichaceae科的微生物通常被报道为与炎症反应相关[43]以及抗生素耐受的肠道微生物[44],但却很少在水体生态系统的环境中被报道.本研究首次发现了Erysipelotrichaceae 科微生物可以作为水体沉积物中潜在的除磷菌.

图10 MB和V. spiralis联合作用下沉积物中菌属对P代谢功能的贡献率Fig.10 Contributions of each genus that related to P metabolism function estimated by PICRUSt
MB富含多种矿物元素,可以促进沉水植物V. spiralis生长.此外,植物为了应对P的缺乏,可能通过根系分泌作用直接促进溶磷或是通过促进根际微生物群落的P代谢活性间接地增加沉积物中的生物可利用性P含量.张亚朋等[45]研究表明, 苦草对沉积物微生物群落结构有一定影响,沉水植物的生长可以增加沉积物中革兰氏阳性菌的百分含量,同时降低革兰氏阴性菌的百分含量,改变其微生物群落组成及生态学功能,对其进行相关性分析发现革兰氏阳性菌与总磷、无机磷呈显著负相关,而革兰氏阴性菌与有机磷、无机磷呈显著正相关,磷可能是影响沉积物中微生物活性及群落结构的限制性营养因素.由表5可得,随着时间的推移, V. spiralis的生物量逐渐增大,且V. spiralis + MB联合处理组的生物量高于V. spiralis处理组.

表5 V. spiralis在0d,150d和365d的生物量(g/m2)Table 5 The V. spiralis biomasses on 0d,150d and 365d (g/m2)
3 结论
3.1 MB与沉水植物V.spiralis对沉积物磷的联合作用效果好,联合作用优于MB和沉水植物V.spiralis单独作用之和.
3.2 MB可以促进沉水植物V. spiralis的生长, V.spiralis可能通过根系分泌作用促进溶磷或是通过促进根际微生物群落的P代谢活性间接地增加沉积物中的生物可利用性P的含量.厚壁菌门Erysipelotrichaceae科的菌属PSB-M-3是联合组相比单一V. spiralis组或单一MB组沉积物微生物群落P代谢功能增强的主要贡献者.
3.3 MB和沉水植物联合控制沉积物磷技术可进一步应用到富营养化湖泊沉积物控制工程.
[1] Schindler D W, Hecky R E, Findlay D L, et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: Results of a 37-year whole-ecosystem experiment [J]. Proceeding of the National Academy of Sciences of the Unite States of America,2008,105(32):11254–11258.
[2] Lü C W, Wang B, He J, et al. Responses of Organic Phosphorus Fractionation to Environmental Conditions and Lake Evolution [J].Environmental Science & Technology, 2016,50(10):5007–5016.
[3] Liu J Y, Davis A P. Phosphorus speciation and treatment using enhanced phosphorus removal bioretention [J]. Environmental Science & Technology, 2014,48(1):607–614.
[4] 刘德鸿,余居华,钟继承,等.太湖流域典型河网水体氮磷负荷及迁移特征 [J]. 2016,36(1):125-132.
[5] Dithmer L, Nielsen U G, Lürling M, et al. Responses in sediment phosphorus and lanthanum concentrations and composition across 10lakes following applications of lanthanum modified bentonite[J]. Water Research, 2016,97:101–110.
[6] 吴沛沛,刘劲松,胡晓东,等.滆湖北部底泥疏浚的生态效应研究[J]. 水生态学杂质, 2015,2:32–38.
[7] Liu C, Shao S G, Shen Q S, et al. Effects of riverine suspended particulate matter on the post-dredging increase in internal phosphorus loading across the sediment-water interface [J].Environmental Pollution, 2016,211:165–172.
[8] Pourabadehei M, Mulligan C N. Resuspension of sediment, a new approach for remediation of contaminated sediment [J].Environmental Pollution, 2016,213:63–75.
[9] 章 喆,林建伟,詹艳慧,等.锆改性高岭土覆盖对底泥与上覆水之间磷迁移转化的影响 [J]. 环境科学, 2016,37(4):1427–1436.
[10] Zhang C, Zhu M Y, Zeng G M, et al. Active capping technology: a new environmental remediation of contaminated sediment [J]. Environmental Science and Pollution Research, 2016,23(5):4370–4386.
[11] 席 银,王圣瑞,赵海超,等.覆盖不同材料对湖泊沉积物磷释放影响机制 [J]. 环境化学, 2017,36(3):532–541.
[12] Wang C H, Jiang H L. Chemicals used for in situ immobilization to reduce the internal phosphorus loading from lake sediments for eutrophication control [J]. Critical Reviews in Environmental Science & Technology, 2016,46(10):947–997.
[13] 孔 明,尹洪斌,晁建颖,等.凹凸棒黏土覆盖对沉积物磷赋存形态的影响 [J]. 中国环境科学, 2015,35(7):2192–2199.
[14] Liu X N, Tao Y, Zhou K T, et al. Effect of water quality improvement on the remediation of the river sediment due to the addition of calcium nitrate [J]. Science of the Total Environment,2017,575:887–894.
[15] Liu S H, Zhu Y R, Meng W, et al. Characteristics and degradation of carbon and phosphorus from aquatic macrophytes in lakes:Insights from solid-state 13C NMR and solution 31P NMR spectroscopy [J]. Science of the Total Environment, 2016,543:746–756.
[16] Huang D L, Hu C J, Zeng G M, et al. Combination of Fenton process and biotreatment for wastewater treatment and soil remediation [J]. Science of the Total Environment, 2017,574:1599–1610.
[17] 莫家勇,钟 萍,刘正文.生态修复对浅水湖泊沉积物磷形态特征及湖水磷浓度的影响 [J]. 应用与环境生物学报, 2016,22(2):320–325.
[18] Zhao Y, Yang Z F, Xia X H, et al. A shallow lake remediation regime with Phragmites australis: Incorporating nutrient removal and water evapotranspiration [J]. Water Research, 2012,46(17):5635–5644.
[19] 刘 喆,钱 新,高海龙,等.沉水植物群落配置对太湖贡湖生态修复区的调水效果 [J]. 江苏农业科学, 2016,44(5):480–483.
[20] 杨凤娟,蒋任飞,饶伟民,等.沉水植物在富营养化浅水湖泊修复中的生态机理 [J]. 安徽农业科学, 2016,44(26):58–61.
[21] 华祖林,康蓓蓓,巫 丹.苦草与菖蒲对太湖梅梁湾沉积物磷释放抑制的研究 [J]. 环境科学与技术, 2013,36(9):31–35.
[22] 吴 旻,赵群芬.3种沉水植物在不同污染水体中的生长及其对水质的影响 [J]. 生物学杂志, 2015,32(4):43–47.
[23] 雷婷文,魏小飞,戴耀良,等.6种常见沉水植物对水体的净化作用研究 [J]. 安徽农业科学, 2015,43(36):160–161,196.
[24] Dithmer L, Lipton A S, Reitzel K, et al. Characterization of phosphate sequestration by a lanthanum modified bentonite clay:A solid-state NMR, EXAFS, and PXRD study [J]. Environmental Science & Technology, 2015,49(7):4559–4566.
[25] Gopalakannan V, Periyasamy S, Viswanathan N. Synthesis of assorted metal ions anchored alginate bentonite biocomposites for Cr (VI)sorption [J]. Carbohydrate Polymers, 2016,151:1100–1109.
[26] Gao Y W, Guo Y Z. Zhang H. Iron modified bentonite: Enhanced adsorption performance for organic pollutant and its regeneration by heterogeneous visible light photo-Fenton process at circumneutral pH [J]. Journal of Hazardous Materials, 2016,302:105–113.
[27] 王抚抚,陈泉水,罗太安,等.膨润土的改性研究进展 [J]. 应用化工, 2017,46(4):775–779.
[28] Liu Z S, Zhang Y, Liu B Y, et al. Adsorption performance of modified bentonite granular (MBG) on sediment phosphorus in all fractions in the West Lake, Hangzhou, China [J]. Ecological Engineering, 2017,106:124–131.
[29] Ruban V, Lopez-Sanchez J F, Pardo P, et al. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-A synthesise of recent works [J]. Fresenius.s Journal of Analytical Chemistry, 2001,307(2):224–228.
[30] 国家环境保护总局,《水和废水检测分析方法》编委会.水和废水检测分析方法(第四版) [M]. 北京:中国环境科学出版社,2002:243–246.
[31] Zhang Y, Wang C, He F, et al. In-situ Adsorption-biological combined technology treating sediment phosphorus in all fractions [J]. Scientific reports, 2016,6(29725):1–17.
[32] 葛绪广.沉水植物对沉积物磷迁移转化的影响 [D]. 南京:南京师范大学, 2009.
[33] Sun S J, Huang S L, Sun X M, et al. Phosphorus fractions and its release in the sediments of Haihe River, China [J]. Journal of Environmental Sciences, 2009,21(3):291–295.
[34] Wang S R, Jin X C, Zhao H C, et al. Phosphorus fractions and its release in the sediments from the shallow lakes in the middle and lower reaches of Yangtze River area in China [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006,273(1):109–116.
[35] Zhou Y Y, Li J Q, Fu Y Q. Effects of submerged macrophytes on kinetics of alkaline phosphatase in Lake Donghu—I. Unfiltered water and sediments [J]. Water research, 2000,34(15):3737-3742.[36] Barko J W, Gunnison D, Carpenter S R. Sediment interactions with submersed macrophyte growth and community dynamics [J].Aquatic Botany, 1991,41(1-3):41–65.
[37] 李振国,王国祥,张 佳,等.苦草(Vallisneria natans)根系对沉积物中各形态磷的影响 [J]. 环境科学, 2014,35(4):1304–1310.
[38] Zhang M, Yang Q, Zhang J H, et al. Enhancement of denitrifying phosphorus removal and microbial community of long-term operation in an anaerobic anoxic oxic-biological contact oxidation system [J]. Journal of Bioscience Bioengineering, 2016,122(4):456–466.
[39] TerashiMa M, Yama A, Sato M, et al. Culture-Dependent and-Independent Identification of Polyphosphate-Accumulating Dechloromonas spp. Predominating in a Full-Scale Oxidation Ditch Wastewater Treatment Plant [J]. Microbes and Environment Health, 2016,31(4):449–455.
[40] Yuan Y, Liu J J, Ma B, et al. Improving municipal wastewater nitrogen and phosphorous removal by feeding sludge fermentation products to sequencing batch reactor (SBR) [J].Bioresource Technology, 2016,222:326–334.
[41] Lacerda J R M, Silva T F, Vollú R E, et al. Generally recognized as safe (GRAS) Lactococcus lactis strains associated with Lippia sidoides Cham. are able to solubilize/mineralize phosphate [J].SpringerPlus, 2016,5(1):1–7.
[42] Wang H M, Dong Q, Zhou J P, et al. Zinc phosphate dissolution by bacteria isolated from an oligotrophic karst cave in central China [J]. Frontiers of Earth Science, 2013,7(3):375–383.
[43] Kaakoush N O. Insights into the Role of Erysipelotrichaceae in the Human Host [J]. Frontiers in Cellular and Infection Microbiology, 2015,5(84):1–4.
[44] Cui E, Wu Y, Zuo Y, et al. Effect of different biochars on antibiotic resistance genes and bacterial community during chicken manure composting [J]. Bioresource. Technology, 2016,203:11–17.
[45] 张亚朋,章婷曦,王国祥.苦草(Vallisneria natans)对沉积物微生物群落结构的影响 [J]. 湖泊科学, 2015,27(3):445–450.
致谢:感谢“十二五”水专项西湖工作站的老师和同学们对本研究的指导和帮助.
——以武汉紫阳湖为例

