阴离子对Acidithiobacillus ferrooxidans氧化活性及次生铁矿物形成影响
宋永伟,陈 婷,王鹤茹,杨 俊,曹艳晓,周立祥 (.中南财经政法大学环境科学与工程系,湖北 武汉430073;.南京农业大学环境工程系,江苏 南京 0095)
AMD中存在的嗜酸性氧化亚铁硫杆菌(A.ferrooxidans)能够高效催化Fe2+向Fe3+转化,并伴随着Fe3+水解产生施氏矿物、黄铁矾等次生铁矿物[9-12].已经证实,上述矿物对重(类)金属离子有较大的吸附或共沉淀作用,是较为理想的吸附材料[13-19].由上启示,生物成因次生铁矿物不仅可以有效去除Fe离子,还可吸持去除有毒有害元素,从而减轻环境的污染.促使AMD中Fe离子向次生铁矿物转变具有一定的科学研究价值.
A.ferrooxidans介导的生物矿化法受微生物活性影响,反应条件较为温和,因此生物成因次生铁矿物形成的因素也很多,如反应时间、反应温度、Fe2+浓度、阳离子种类/浓度、晶种种类等[20-25].次生铁矿物生物合成的实质是Fe2+→Fe3+→Fe8O8(OH)6SO4或MFe3(SO4)2(OH)6的Fe2+氧化和Fe3+水解过程,氧化产物Fe3+作为过渡离子,其供应速率决定了次生铁矿物的合成行为.可见,A.ferrooxidans的Fe2+氧化能力间接制约着次生铁矿物的形成过程,其与A.ferrooxidans活性密切相关.影响A.ferrooxidans活性的因素包括pH值、温度、O2/CO2浓度、金属离子等[26-31].此外,过量阴离子对A.ferrooxidans氧化活性也具有一定的抑制作用.已有报道称,浓度为10mmol/L的Cl-能显著延缓A.ferrooxidans的生长;在超过94mmol/L时能导致A.ferrooxidans死亡;当或浓度大于300mmol/L时,则完全抑制A.ferrooxidans生长[32-33].上述研究结果比较是基于不同菌株或能源底物而言,但关于阴离子对A.ferrooxidansFe2+氧化活性及其介导次生铁矿物形成的综合影响鲜见报道.那么,受上述3种阴离子影响后,生物成因次生铁矿物的相对成矿能力(总Fe沉淀率)和次生铁矿物矿相之间的差异问题均还需进一步研究和考证.
本研究以去除酸性矿山废水中Fe离子及重(类)金属元素为目的,通过A.ferrooxidans介导的次生铁矿物生物矿化法,研究酸性环境下Cl-、、浓度对溶液中Fe2+氧化率、总Fe沉淀率、次生铁矿物矿相的影响.研究结果可为促使酸性硫酸盐体系中Fe向次生铁矿物的转变和调控提供必要的理论依据.
1 材料与方法
1.1 供试材料
改良9K液体培养基:(NH4)2SO43.5g、KCl 0.119g、K2HPO40.058g、Ca(NO3)24H2O 0.0168g、MgSO47H2O 0.583g,蒸馏水1000mL, pH=2.50,121℃灭菌30min.
A.ferrooxidans休止细胞:将A.ferrooxidans接种在改良9K培养基中,置于28℃、180r/min摇床(QYC-2102C)中振荡培养,待指数生长阶段后期停止培养(约2~3d).随后将培养液经定性滤纸过滤以除去生成的次生铁矿物,将滤液以10000×g的相对离心力(TGL205,4℃,10min)离心收集菌体,并用pH=1.50的酸水(H2SO4配制)清洗3次,以除去各种杂离子.将这些菌体悬浮于pH=2.50的酸水(H2SO4配制),所得即为A.ferrooxidans浓缩菌液[34].
1.2 试验设置
在系列含有若干去离子水的500mL三角瓶中,按7.84g/L (即140mmol/L)的Fe2+浓度加入FeSO47H2O,用1:1的H2SO4调上述所有体系pH值至2.50,然后分别采用KCl、KNO3、K3PO4作为3种阴离子来源进行调节,设置Cl-、、浓度梯度分别为0,25,100,250,500,750mmol/L.随后接种A.ferrooxidans休止细胞悬浮液,并补充少量去离子水,使体系的有效容积为250mL,A.ferrooxidans密度约为5×107cells/mL.将上述三角瓶置于28℃、180r/min摇床中振荡培养168h.培养过程中,定期取液体样约1mL过0.22μm滤膜(取样前使三角瓶预先静置5min,使次生矿物完全沉降,然后取上清液),测定和计算Fe2+浓度、总Fe沉淀率的变化情况.培养期间采用称重法定时补加因蒸发减少的水分.培养终点时,用中速定性滤纸收集合成的次生矿物,用去离子水清洗2次以去除杂质,60℃烘干后称重并进行矿物相鉴定.不同处理均设置3个重复.
1.3 测定方法
采用pHS-3C精密pH计测定溶液pH值;Fe2+和总Fe浓度采用邻啡罗啉比色法测定;矿物相采用X射线衍射仪测定(XRD,Bruker D8),测试工作条件为:管电压40kV,管电流40mA,扫描区间10°~80°(2θ),步长0.01°,扫描速率6°/min,Cu靶.
1.4 数据处理与统计分析
实验数据采用SPSS(SPSS 21for windows)统计软件进行统计分析,分差分析后采用SNK(Student-Newman-Keuls test)方法进行多重比较.
2 结果
2.1 3种阴离子对体系pH值、Fe2+的影响

图1 不同浓度阴离子处理下体系pH值的变化情况Fig.1 Change of pH value with different concentrations of Cl-, , and
本试验使用的A.ferrooxidans是休止细胞,不含有供细胞生长的营养元素,细胞不会发生增殖,但仍具有较强的生物催化氧化能力.图1~2显示的是当溶液Fe2+浓度为7.84g/L时,不同阴离子对酸性硫酸盐体系pH值和Fe2+浓度的影响情况.

图2 不同浓度阴离子处理下体系Fe2+的变化情况Fig.2 Change of Fe2+ with different concentrations of Cl-, and
A. ferrooxidans氧化Fe2+成矿包含两步酸效应:一是耗酸的Fe2+生物氧化过程,二是产酸的Fe3+水解成矿过程.因此,通过反应体系pH值的变化趋势即可判断A. ferrooxidans的氧化能力.由图1知,当初始pH=2.50时,Cl-和对体系pH值基本没有影响,而浓度则表现出一定的缓冲性能,pH值在0h时出现波动.这可能与是多元弱酸离子有关,pH=2.50时主要以H3PO4和型体存在.培养至24h时,Cl-≤25、≤100、≤100mmol/L范围内,各处理pH值均上升至2.70左右,并随着培养时间延长开始逐渐下降,说明Fe2+生物氧化(耗酸)和Fe3+水解成矿(产酸)过程能够正常进行,该阴离子浓度水平对A.ferrooxidans的催化氧化活性没有产生抑制作用.相反,低浓度阴离子反而有助于体系pH值下降,表现在pH值相对下降速度更快和下降程度更低.以为例,当培养时间分别为96h和168h时,0、25、100mmol/L的所对应的pH值分别为2.30、2.24、1.98和1.99、1.85、1.75.从阴离子种类来看,适当浓度更易加速体系pH值在短时间内下降.同为25mmol/L的Cl-、NO3、在培养至96h时,溶液pH值分别为2.22、2.24、1.94.当Cl-=100、=250mmol/L时,A. ferrooxidans氧化活性受到一定的冲击,但并没有完全失活,后期能够恢复氧化功能,表现为pH值分别在96、120h时出现回升和缓慢下降的趋势.通过阴离子对体系pH值的变化可以判断,A.ferrooxidans对3种阴离子的耐受性依次为>>Cl-.由图2可知,当阴离子浓度在A.ferrooxidans耐受范围内时,其对Fe2+的生物氧化过程基本没有影响,体系中7.84g/L的Fe2+均在72~96h内被氧化完全,这与pH值变化趋势存在一定差异(图1).根据A.ferrooxidans介导的生物成矿酸效应理论可以推断,低浓度阴离子体系pH值的下降速度主要受Fe3+水解成矿过程影响.从Fe2+氧化速率来看,A.ferrooxidans对能源物质Fe2+的氧化利用主要集中在24~72h,期间Fe2+累积氧化率>80%.在0~24h内,Fe2+氧化率偏低可能与高速离心导致A. ferrooxidans受损有关,使得其缓冲期延长.当Cl-≥250mmol/L、≥250mmol/L、≥500mmol/L时,A.ferrooxidans则完全抑制失活,溶液中Fe2+浓度在反应前后基本没有变化.可见,阴离子离子种类及浓度对Fe2+的生物氧化具有重要影响,主要体现在高浓度离子水平对A.ferrooxidans氧化能力的抑制作用.郭勤[35]等研究表明,当Cl-浓度大于85mmol/L,细菌生长就完全受到抑制.张成桂[32]等以单质硫作为底物考察硫杆菌活性时,发现Cl-、、对细胞氧化能力完全抑制的临界浓度分别为50、50、300mmol/L.前人结果与本研究相差较大,可能受供试菌株种类不同的影响.相对于Cl-和A.ferrooxidans对具有较强耐受性的原因在于是细胞内核酸、磷脂及ATP的必需组分,能够参与ATP和ADP的形成,在能量积累和转换及生理代谢等发面扮演重要的角色.
2.2 3种阴离子对体系Fe3+水解成矿的影响

图3 不同浓度阴离子处理下体系总Fe的变化情况Fig.3 Change of total Fe with different concentrations of Cl-, , and
图3描述了总Fe沉淀率随培养时间的变化趋势.其实质是Fe2+氧化和Fe3+水解形成次生铁矿物而从液相转移到固相的过程[36].受A.ferrooxidans活性影响,反应初期Fe2+氧化速度较慢而减缓Fe3+水解成矿,各处理总Fe沉淀主要集中在24~120h,该时间段内体系具备较大的Fe3+供应速率,使次生铁矿物形成推动力发生改变,在一定程度上促进矿物的加速形成[37-39].适当提高阴离子浓度有利于可溶性Fe的生物成矿去除,各阴离子的贡献能力依次为>>Cl-.以阴离子浓度25mmol/L为例,添加Cl-、PO43-体系反应终点的总Fe累积沉淀率分别为43.67%、50.67%、58.04%,与对照处理相比分别提高了7.31%、14.31%、21.68%.
然而,由图2可知,低浓度水平的各阴离子对Fe2+生物氧化过程并没有显著影响,即水解成矿所需Fe3+供应速率基本一致.由此可以推断,各体系中总Fe沉淀率存在明显差异并非由阴离子种类或浓度直接决定.结合次生铁矿物合成过程可知,当酸性环境体系中存在一价阳离子时,会参与黄铁矾的合成过程,一价阳离子浓度越高,越有利于反应的正向进行,消耗单位Fe3+所合成纯黄铁矾质量约为纯施氏矿物的1.5倍以上.而本研究中阴离子均以K盐的形式添加,可能改变了次生铁矿物的形成途径,使合成过程更倾向于黄铁矾,从而提高总铁沉淀率(由图5佐证).此外,当阴离子投加浓度相同时,K3PO4中K+浓度为KCl、KNO3的3倍,理论上合成的次生铁矿物量应高得多,而从图4来看,当阴离子浓度为25mmol/L时,Cl-、、收集矿物质量分别为2.98、3.25、3.46g,并非呈倍数递增关系.猜测跟次生铁矿物形成过程的产H+速度有关,持续水解成矿过程以致体系pH值过低可能导致次生铁矿物易于扩散和溶解[40-41].结合图1可以发现,当反应时间在96h时,25mmol/L的体系pH值就下降至2.0以下,而相同浓度的Cl-、则需要144h才能达到该酸度水平.刘奋武[42]等在酸性环境下考察过施氏矿物的稳定性,结果表明,施氏矿物在pH=3.0体系中振荡72h后溶解率只有3.34%,而相同时间内pH=2.0体系中的溶解率则高达61.46%.

图4 不同浓度阴离子处理下生物成因次生铁矿物质量的变化情况Fig.4 Change of biogenic secondary iron mineral quality with different concentrations of Cl-, , and
2.3 3种阴离子对体系次生铁矿物相的影响
图5为阴离子浓度在0~100mmol/L时收集次生铁矿物XRD图谱.前已述及,浓度在A.ferrooxidans耐受范围内时,次生铁矿物的合成过程主要受一价阳离子K+浓度的影响,而高浓度阴离子则会通过抑制A.ferrooxidans的Fe2+生物氧化活性,从而间接阻碍Fe3+的水解成矿过程.
参考JCPDS晶型黄钾铁矾(No: 22-0827)和非晶型施氏矿物(No: 47-1775)的标准XRD图谱可知[43],图5中对照处理(0mmol/L)为FeSO4-A.ferrooxidans-H2O体系,根据衍射峰位置及相对强度(2θ=35.16°),分析生成矿物为无定型的施氏矿物[44].当阴离子浓度提高至25,100mmol/L时,除Cl-=100mmol/L处理外,FeSO4-A.ferrooxidans-K+-H2O体系获得次生铁矿物均为纯净的黄钾铁矾[45],且随着阴离子浓度提高特征衍射峰愈加明显.Bai等[46]研究结果表明,在Fe2+初始浓度为160mmol/L溶液中,当K+≥16.0mmol/L(即Fe2+/K+≤10)时形成的次生铁矿物均为单一黄钾铁矾.而本试验中Fe2+/K+分别为5.6、1.9,与前人研究结果基本一致.因100mmol/L浓度Cl-对A.ferrooxidans氧化活性的抑制作用,导致Fe3+供应速度不足,虽然成矾导向离子K+浓度满足条件,但仍不利于反应向合成黄钾铁矾的方向进行,收集的矿物为施氏矿物和黄钾铁矾的混合物.
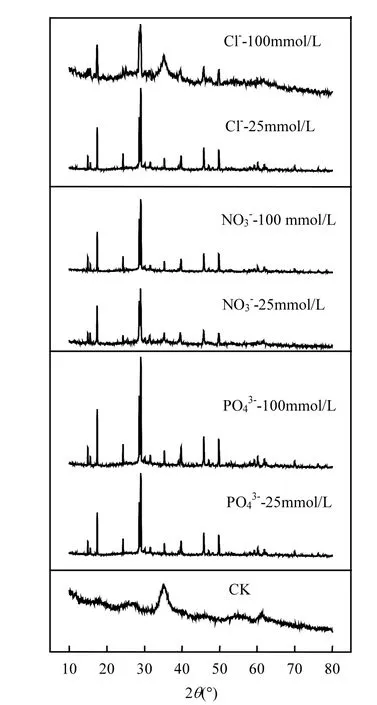
图5 生物成因次生铁矿物的XRD图谱Fig.5 XRD patterns of biogenic secondary iron minerals
3 结论
3.1 高浓度阴离子对A.ferrooxidans氧化Fe2+能力具有一定的抑制作用.A.ferrooxidans对阴离子的耐受性依次为>>Cl-.
3.2 在A.ferrooxidans耐受范围内时,阴离子对Fe2+的生物氧化基本没有影响, 140mmol/L的Fe2+均在72~96h内被氧化完全.
3.3 高浓度阴离子会通过抑制A.ferrooxidans氧化活性,从而间接影响Fe3+的水解成矿过程,导致体系总Fe沉淀率降低和次生铁矿物产量减少.
[1] Singer P C, Stumm W. Acidic mine drainage: the ratedetermining step [J]. Science, 1970,167(3921):1121-1123.
[2] Vhahangwele M. A novel technology for neutralizing acidity and attenuating toxic chemical species from acid mine drainage using cryptocrystalline magnesite tailings [J]. Journal of Water Process Engineering, 2016,10(6):67-77.
[3] Wu Z L, Zou L C, Chen J H, et al. Column bioleaching characteristic of copper and iron from Zijinshan sulfide ores by acid mine drainage [J]. International Journal of Mineral Processing, 2016,149:18-24.
[4] Wei X, Wolfe F A. Minerals and Mine Drainage [J]. Water Environment Research, 2013,85(10):1515-1547.
[5] Liu G W, Bai R C. Development of the acidic mining wastewater treatment technology [J]. Applied Mechanics and Materials,2013,295-298:1372-1375.
[6] Song Y W, Wang M, Liang J R, et al. High-rate precipitation of iron as jarosite by using a combination process of electrolytic reduction and biological oxidation [J]. Hydrometallurgy,2014,143(3):23-27.
[7] Lee W C, Lee S W, Yun S T, et al. A novel method of utilizing permeable reactive kiddle (PRK) for the remediation of acid mine drainage [J]. Journal of Hazardous Materials, 2016,301:332-341.
[8] Meschke K, Herdegen V, Aubel T, et al. Treatment of opencast lignite mining induced acid mine drainage (AMD) using a rotating microfiltration system [J]. Journal of Environmental Chemical Engineering, 2015,4(4):2848-2856.
[9] Diao Z H, Shi T H, Wang S Z, et al. Silane-based coatings on the pyrite for remediation of acid mine drainage [J]. Water Research,2013,47(13):4391-4402.
[10] Valente T, Grande J A, Torre M L, et al. Mineralogy and environmental relevance of AMD-precipitates from the Tharsis mines, Iberian Pyrite Belt (SW, Spain) [J]. Applied Geochemistry,2013,39(8):11-25.
[11] Zhu J Y, Gan M, Zhang D, et al. The nature of Schwertmannite and Jarosite mediated by two strains of Acidithiobacillus ferrooxidans with different ferrous oxidation ability [J]. Materials Science and Engineering C, 2013,33(5):2679-2685.
[12] 宋永伟,赵博文,霍敏波,等.温度对嗜酸性硫杆菌活性和生物成因次生铁矿物形成的影响 [J]. 环境科学, 2013,34(8):3264-3271.
[13] Zhang S L, Jia S Y, Yu B, et al. Sulfidization of As(V)-containing schwertmannite and its impact on arsenic mobilization [J].Chemical Geology, 2016,420(20):270-279.
[14] Gan M, Sun S G, Zheng Z H, et al. Adsorption of Cr(VI) and Cu(II) by AlPO4modified biosynthetic schwertmannite [J].Applied Surface Science, 2015,356(30):986-997.
[15] Mihone K M, Hana F, Sanda R, et al. Assessment of metal risks from different depths of jarosite tailing waste of Trepça Zinc Industry, Kosovo based on BCR procedure [J]. Journal of Geochemical Exploration, 2015,148:161-168.
[16] 廖岳华.施氏矿物的生物合成及去除水中砷的效果与机理研究[D]. 南京:南京农业大学, 2008.
[17] 陈福星,周立祥.生物催化合成的施氏矿物对废水中Cr(VI)的吸附 [J]. 中国环境科学, 2006,26(1):11-15.
[18] 王长秋,马生凤,鲁安怀.黄钾铁矾类矿物沉淀去除Cr(VI)的初步研究 [J]. 矿物岩石地球化学通报, 2006,25(4):335-338.
[19] Asta M P, Cama J, Martínez M, et al. Arsenic removal by goethite and jarosite in acidic conditions and its environmental implications [J]. Journal of Hazardous Materials, 2009,171(1-3):965-972.
[20] 邓志明,周正华.湿法炼锌浸出沉铁探讨 [J]. 湖南有色金属,2002,18(1):23-25,45.
[21] Dutrizac J E, Kaiman S. Synthesis and properties of jarosite-type compounds [J]. Canadian Mineralogist, 1976,14:151-158.
[22] Dutrizac J E. The effectiveness of jarosite species for precipitating sodium jarosite [J]. Journal of the Minerals, Metals and Materials Society, 1999,51(12):30-32.
[23] 宋永伟,王鹤茹,梁剑茹,等.温度和pH对生物成因羟基硫酸铁矿物的综合影响研究 [J]. 环境科学学报, 2016,36(10):3683-3690.
[24] 刘奋武,高诗颖,王 敏,等.镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响 [J]. 中国环境科学, 2014,34(3):713-719.
[25] 刘奋武,高诗颖,崔春红,等.Ca2+对酸性硫酸盐环境中次生铁矿物合成的影响 [J]. 中国环境科学, 2015,35(4):1142-1148.
[26] Nemati M, Harrison S T L, Hansford G S, et al. Biological oxidation of ferrous sulphate byThiobacillus ferrooxidans: a review on the kinetic aspects [J]. Biochemical Engineering Journal,1998,3(1):171-190.
[27] 宋永伟,王鹤茹,曹艳晓,等.低分子有机酸对硫杆菌活性的抑制作用及对土壤重金属脱除的影响 [J]. 环境科学, 2016,37(5):368-375.
[28] Mousavi S M, Yaghmaei S, Salimi F, et al. Influence of process variables on biooxidation of ferrous sulfate by an indigenousAcidithiobacillus ferrooxidans. Part Ⅱ: Bioreactor experiments[J]. Fuel, 2007,86(7/8):993-999.
[29] Kumar S R, Gandhi K S. Modelling of Fe2+oxidation byThiobacillus ferrooxidans[J]. Applied Microbiology and Biotechnology, 1990,33(5):524-528.
[30] 刘 清,徐伟昌,张 宇.重金属离子对氧化亚铁硫杆菌活性的影响 [J]. 铀矿冶, 2004,23(3):155-157.
[31] 刘欣伟,冯雅丽,李浩然,等.镁离子浓度对氧化亚铁硫杆菌生长动力学的影响 [J]. 中国有色金属学报, 2012,26(8):2353-2359.[32] 张成桂,张 倩,王 晶,等.阴离子对嗜酸性氧化亚铁硫杆菌生长和硫氧化活性的影响 [J]. 中国有色金属学报, 2009,19(12):2237-2242.
[33] Harahuc L, Lizama H M, Suzuki I. Selective inhibition of the oxidation of Ferrous iron or sulfur inThiobacillus ferrooxidans[J].Applied and Environmental Microbiology, 2000,66(3):1031-1037.
[34] Liao Y, Zhou L, Liang J, et al. Biosynthesis of schwertmannite byAcidithiobacillus ferrooxidanscell suspensions under different pH condition [J]. Materials Science and Engineering C, 2009,29(1):211-215.
[35] 郭 勤,韩文艳,李 江,等.氯离子对氧化亚铁硫杆菌和氧化亚铁钩端微螺菌活性的影响 [J]. 有色金属, 2015,(1):42-45.
[36] Gramp J P, Sandy Jones F, Bigham J M, et al. Monovalent cation concentrations determine the types of Fe(III) hydroxysulfate precipitates formed in bioleach solutions [J]. Hydrometallurgy,2008,94(1-4):29-33.
[37] 柏双友.酸性富铁硫酸盐环境中生物成因次生羟基硫酸铁矿物形成及其机理 [D]. 南京:南京农业大学, 2012.
[38] Sasaki K, Konno H. Morphology of jarosite-group compounds precipitated from biologically and chemically oxidized Fe ions [J].The Canadian mineralogist, 2000,38(1):45-56.
[39] Regenspurg S, Brand A, Peiffer S. Formation and stability of schwertmannite in acid mining lakes [J]. Geochimica Et Cosmochimica Acta, 2004,68(6):1185-1197.
[40] Dold B. Dissolution kinetics of schwertmannite and ferrihydrite in oxidized mine samples and their detection by differential X-ray diffraction (DXRD) [J]. Applied Geochemistry, 2003,18(10):1531-1540.
[41] Loan M, Richmond W R, Parkinson G M. On the crystal growth of nanoscale schwertmannite [J]. Journal of Crystal Growth,2005,275(1/2):1875-1881.
[42] 刘奋武,卜玉山,田国举.温度与pH对生物合成施氏矿物在酸性环境中溶解行为及对Cu2+吸附效果的影响 [J]. 环境科学学报,2013,33(9):2445-2451.
[43] JCPDS (Joint Committee on Powder Diffraction Standards).Mineral Powder Diffraction Files [Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania, 2002.
[44] Eskandarpour A, Onyango M S, Ochieng A, et al. Removal of fluoride ions from aqueous solution at low p H using schwertmannite [J].Journal of Hazardous Materials, 2008,152(2):571-519.
[45] Wang H M, Bigham J M, Tuovinen O H. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms [J]. Materials Science and Engineering C, 2006,26(4):588-592.
[46] Bai S Y, Xu Z H, Wang M, et al. Both initial concentrations of Fe(II) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments [J]. Materials Sciences and Engineering C, 2012,32(8):2323-2329.

