花绒寄甲5个线粒体合成相关基因序列与时空表达分析
张正青,李孟楼
(西北农林科技大学 林学院 森林害虫生物防治实验室,陕西 杨凌 712100)
花绒寄甲(Dastarcushelophoroides)属鞘翅目(Coleoptera)寄甲科(Bothrideridae)[1-2],是光肩星天牛(Anoplophoraglabripennis)、刺角天牛(Trirachysorientalis)、云斑白条天牛(Batoceralineolata)和松墨天牛(Monochamusalternatus)等天牛的重要天敌[3]。通过人工大量饲养花绒寄甲放养到林场、森林或城市园林,具有生物防治对环境友好和作用时效较长的特点,防治效果明显优于传统的化学防治[4-6]。
线粒体是真核细胞内重要的细胞器,可以通过氧化磷酸化(oxidative phosphorylation,OXPHOS)为生物体提供能量(ATP),在代谢和应激信号的传导、产生活性氧等自由基、感应细胞程序性死亡等过程中均扮演重要角色[7-8]。细胞核基因组(nDNA)与线粒体基因组(mtDNA)相互调控,其中一个重要的路径便涉及到5′单磷酸腺苷活化蛋白激酶(AMPK)信号通路和其下游的过氧化物酶体增殖物激活受体γ辅激活因子(PGC1-α)信号级联反应。在AMPK信号通路中,AMPK直接磷酸化PGC1-α的Ser538和Thr177残基,使其与细胞核呼吸因子(NRF-1/2)等转录因子相互作用进而激活线粒体转录因子(mtTFA),从而引起mtDNA的复制和转录[9]。PGC1-α信号级联由PGC1-α、NRF-1/2和mtTFA组成[10],其中PGC1-α是促进线粒体生物合成的主要调节因子,是一种提高核编码线粒体基因转录因子活性的共激活因子;NRF-1/2是核基编码的调控mtDNA转录与复制的核呼吸调节因子,是线粒体呼吸链中细胞色素C氧化酶Ⅳ(COXⅣ)、β-ATP合成酶及mtTFA等基因的重要调节因子;mtTFA是NRF-1的靶基因,是由核基因组编码后易位到线粒体直接活化mtDNA的特异性转录因子[11]。前人研究表明,小鼠肌管细胞中表达PGC1-α时,诱导慢肌钙蛋白Ⅰ、肌红蛋白及数种参与线粒体氧化代谢的基因表达量增加,从而使线粒体含量增加[12-13]。此外,PGC1-α在过表达时能增强线粒体生物通路,通过刺激超氧化物歧化酶2(SOD2)、过氧化氢酶、谷胱甘肽过氧化物酶1(6PX1)、UCP等基因的表达来减少氧化损伤,并在抵抗衰老相关的骨骼肌退化中发挥重要保护作用[14]。mtDNA编码的基因细胞色素氧化酶(COXⅠ)和ATP酶亚基6(ATP 6)是呼吸链复合物Ⅳ和Ⅴ中重要的组成亚基,均具有NRF-1的功能性结合位点,可作为监测线粒体转录和复制的重要基因[15-16]。
本研究分别从花绒寄甲转录组和线粒体基因组中筛选出PGC1-α、NRF1、mtTFA、COXⅠ和ATP6基因,通过研究这些基因在不同组织、虫态和虫龄中的表达情况,探讨花绒寄甲线粒体合成相关基因在其生命活动不同时期的时空表达差异,为深入揭示花绒寄甲生殖生理活动奠定一定的理论基础。
1 材料与方法
1.1 供试昆虫
花绒寄甲(Dastarcushelophoroides)幼虫(1~6龄)、蛹和成虫(新羽化成虫以及羽化后不同虫龄成虫),均由西北农林科技大学林学院森林害虫生物防治实验室提供,其中幼虫在替代寄主上寄生饲养,成虫在温度为(23±1) ℃、相对湿度为70%~80%、光周期为16∶8(L∶D)的环境下用人工饲料饲养。
1.2 仪 器
TG16-WS台式高速离心机,长沙湘仪离心机仪器有限公司;电子天平(FA1004),上海精科天平公司;高速冷冻离心机(H-2050),长沙湘仪离心机仪器有限公司;立式压力蒸汽灭菌锅,上海博讯实业有限公司;-20 ℃冰箱(DW-FL270),中科美菱低温科技有限责任公司;超低温冰箱(QJ-86-340-LA),成都一科仪器设备有限公司;超净工作台(SW-CJ-1F),苏州安泰空气净化有限公司;智能型人工气候箱(RXZ-500),宁波江南仪器厂;PCR仪(S1000),美国Bio-Rad公司;电泳仪(JY-ECP3000),北京君意东方电泳设备有限公司;核酸蛋白分析仪(Maestro-NANO UV spectrophotometer),美国Maestro;全自动凝胶成像分析仪(JS-2000),上海培清科技有限公司;涡旋仪(QL-866),海门市其林贝尔仪器制造有限公司;迷你离心机(LX-300),海门市其林贝尔仪器制造有限公司;实时定量PCR仪(IQ5),美国Bio-Rad公司。
1.3 花绒寄甲总RNA提取和cDNA合成
试验分3组进行:第1组为花绒寄甲各龄期试虫,包括1~6龄幼虫、蛹及新羽化成虫;第2组为花绒寄甲不同组织试虫,将花绒寄甲按照形态学分雌雄,并在体视镜下解剖成不同组织样品,包括头、胸、中肠、后肠、脂肪体、精巢、卵巢及残体;第3组为花绒寄甲不同虫龄成虫,包括羽化后2,4,10,12,18,20,26,30个月的成虫。由于供试昆虫个体大小的差异,在提取RNA时每个样品所需的虫体头数不同,其中1~3龄幼虫50头/样品,4~6龄幼虫、蛹、不同虫龄成虫10头/样品,每份样品分别收集3次作为生物学重复。选择花绒寄甲成虫100头(雌∶雄=1∶1)用于不同组织样品的解剖,每份组织随机分成3等份作为生物学重复。样品按照液氮研磨法用生工生物工程(上海)股份有限公司的UNIQ-10 Trizol总RNA提取试剂盒分别进行提取。Maestro-NANO UV 紫外分光光度计测定提取总RNA的质量浓度,并用DNA Ⅰ(TaKaRa,日本)试剂盒去除DNA污染。每个样品取1 μg的总RNA,用RevertAid First Strand cDNA(Thermo)反转录试剂盒进行第一链cDNA合成。
1.4 调控基因的检索、筛选及分析
从NCBI(美国国立生物技术信息中心)花绒寄甲转录组TSA数据库中,根据非冗杂(Non-redundant,Nr)数据库中的注释筛选出AMPK信号通路中部分基因unigene序列(GBCX01000001-GBCX01042172),包括PGC1-α、NRF1、mtTFA基因,从花绒寄甲mtDNA(GenBank:KF811054.1)中选择COXⅠ和ATP6基因。通过NCBI数据库中Blast p工具与其他昆虫的相应序列进行同源性比对,并用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具查找开放阅读框并翻译为氨基酸序列。
1.5 引物设计及RACE扩增
用Prime Premier 5.0软件设计引物,其中开放阅读框不完整的序列设计RACE扩增引物(表1),并用BD SMARTerTMRACE 试剂盒(Clontech)进行5′端巢式PCR扩增。第一轮PCR以cDNA为模板、5′RACE引物(RO)和试剂盒中的Outer Primer(5′-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3′)为引物;第二轮PCR以10倍稀释的第一轮扩增产物为模板、5′RACE引物RI和Inner Primer(5′-AAGCAGTGGTATCAACGCAGAGT-3′)为引物。所有的PCR扩增产物均用1.0%琼脂糖凝胶电泳分离和回收,蓝白斑筛选克隆后,摇菌液送生工生物工程(上海)股份有限公司进行测序。对拥有完整开放阅读框的序列则直接设计全长验证引物和定量引物(表1)。
1.6 实时荧光定量PCR(RT-qPCR)表达分析
在IQ5(Bio-Rad)实时荧光定量仪器上检测各基因的表达量。不同组织和不同虫态选择EF-1α作为内参基因、不同虫龄选择α-Tubulin作为内参基因(表1)[17]。每对定量引物通过5×稀释的模板建立标准曲线验证,确保其扩增效率在0.90~1.10。实时定量的反应体系(25 μL):12.5 μL UltraSYBR Mixture(荧光染料),1 μL cDNA模板,上、下游定量引物各1 μL,9.5 μL无菌水。反应条件:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共50个循环;65~95 ℃,每变化1 ℃保持10 s用于记录熔解曲线,以确定扩增条带的特异性。
1.7 数据处理
非完整开放阅读框序列先用SeqMan(DNAATAR)拼接成完整的cDNA序列,再通过ExPASy的compute pI/Mw工具(http://web.expasy.org/compute_pi/)预测蛋白的基本理化性质。对花绒寄甲各基因氨基酸序列进行系统发育分析,从NCBI蛋白数据库下载其他物种的相关氨基酸序列,Clastal W软件比对后用Mega 5.02进行系统进化分析,采用Neighbor-joining (NJ)算法构建进化树,置信度设置为1 000[18]。用相对定量法(2-ΔΔCt)计算分析RT-qPCR的定量数据[19],并用SPSS Statistics 20的Tukey方法进行数据差异显著性分析[20]。定量分析中,不同组织以各基因在花绒寄甲头部的表达量为参照(设为1),不同虫态以各基因在花绒寄甲3龄幼虫中的表达量为参照(设为1),不同虫龄成虫以各基因在羽化后4个月龄中的表达量为参照(设为1)。最后,用OriginPro 8软件进行图形的编辑和组合。
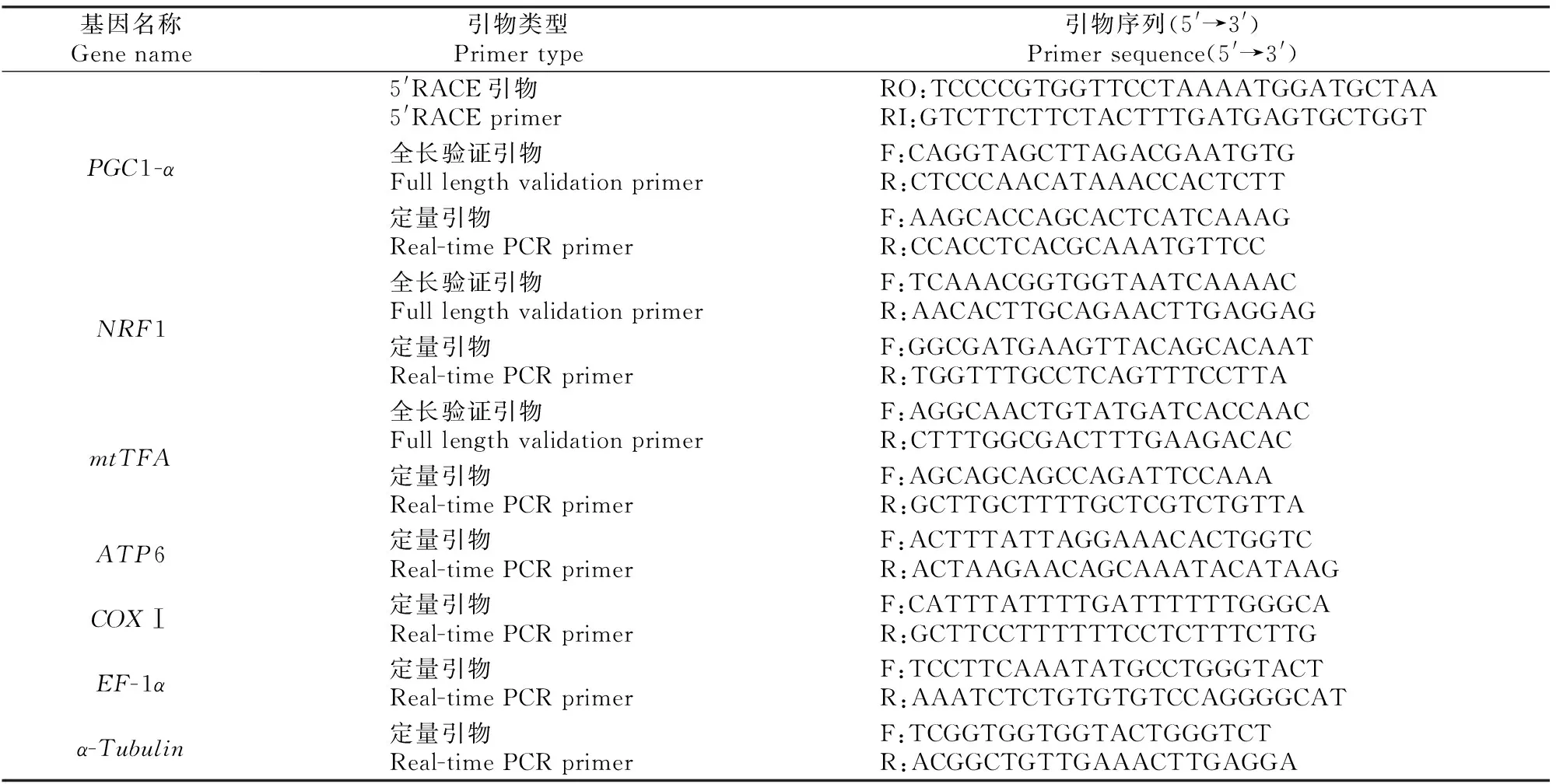
表1 本试验所用的引物Table 1 Primers used in this study
2 结果与分析
2.1 花绒寄甲线粒体合成相关基因序列及蛋白结构
通过NCBI的Blast p工具在线比对发现,从花绒寄甲转录组库和线粒体基因组中筛选出与线粒体合成相关的部分基因。其中,核基因编码序列3条(PGC1-α、NRF1和mtTFA),线粒体基因编码序列2条(ATP6和COXⅠ)。各核苷酸序列及氨基酸序列长度、预测等电点及分子量、所包含的正负电荷残基、稳定系数、总平均疏水性指数和GenBank登录号如表2所示。
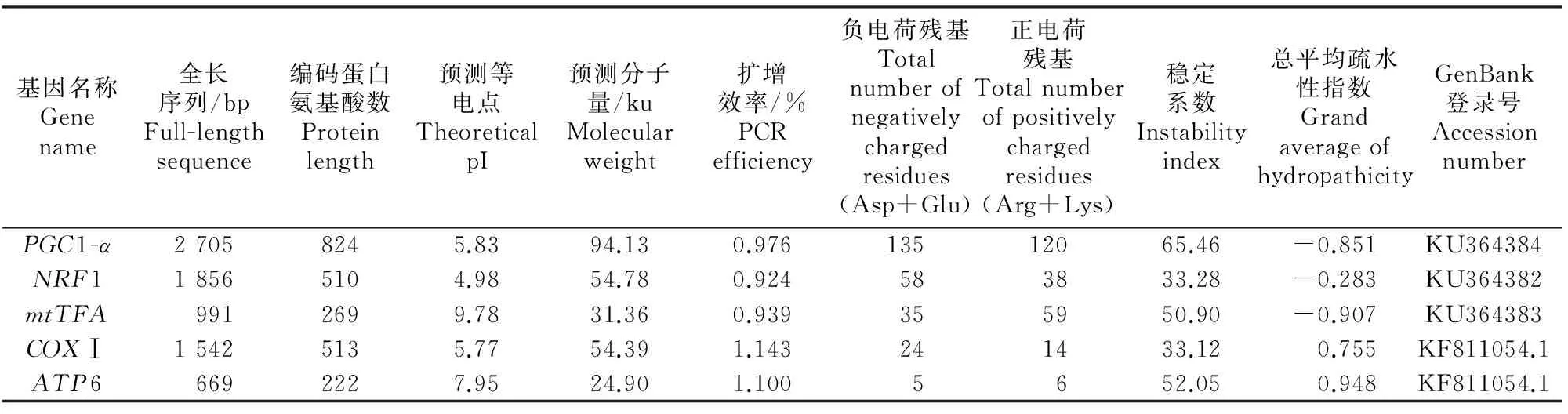
表2 线粒体合成调控基因核酸及氨基酸序列的组成成分及理化性质Table 2 Composition and physicochemical properties of nucleic acid and amino acid sequences of mitochondrial synthesis related genes
由表2可知,PGC1-α基因编码序列长度为2 475 bp(起始密码子ATG,终止密码子TGA),5′端非编码区99 bp,3′端非编码区131 bp;NRF1基因编码序列长度为1 533 bp(起始密码子ATG,终止密码子TAG),5′端非编码区215 bp,3′端非编码区108 bp;mtTFA基因编码序列长度为810 bp(起始密码子ATG,终止密码子TAG),5′端非编码区115 bp,3′端非编码区66 bp。COXⅠ和ATP6的起始密码子和终止密码子分别为AAT和TAA以及ATG和TAA。各基因定量引物的扩增效率为0.924~1.143,表明所选择的引物扩增效率较高,可以满足定量表达的要求。花绒寄甲线粒体合成相关调控基因编码的蛋白序列中,PGC1-α、mtTFA 和ATP6的稳定系数>40,表明蛋白处于不稳定状态;NRF1和COXⅠ的稳定系数<40,表明蛋白处于稳定状态。就亲疏水性而言,核基因编码序列的总平均疏水性指数均为负值,为亲水性蛋白;而线粒体基因编码序列的总平均疏水性指数均为正值,为疏水性蛋白。
2.2 花绒寄甲线粒体合成调控基因的序列同源性比对及系统发育
花绒寄甲线粒体合成调控基因氨基酸序列系统发育树(NJ)见图1。

黑色实心圆表示花绒寄甲各基因,分支处的Bootstrap值位于分支上方The black circular marks are D.helophoroides genes.The bootstrap values are located above the branch图1 花绒寄甲线粒体合成调控基因氨基酸序列系统发育树(NJ)Fig.1 The phylogenetic analysis of mitochondrial synthesis related gene amino acid sequences (NJ)
通过与GenBank中其他物种氨基酸序列比对,花绒寄甲的mtTFA、NRF1及COXⅠ与鞘翅目昆虫相应序列的同源性较高,一致性达80%以上;而PGC1-α和ATP6序列分别与膜翅目麦蜂属昆虫无刺蜂(Meliponaquadrifasciata)和鞘翅目属昆虫Enicmusbrevicornis的同源序列相似,一致性分别为60%和65%。从系统进化树(图1)可以看出,进化分析结果与Blast比对结果一致。花绒寄甲线粒体合成相关基因的氨基酸序列分别与其他物种相应序列聚集在一个分支里,节点值介于69%~100%,表明这些基因的功能具有一定的相似性。其中,花绒寄甲mtTFA先与赤拟谷盗(Triboliumcastaneum)mtTFA氨基酸序列聚集成一支,然后再与膜翅目及双翅目昆虫聚集,形成mtTFA序列的分支;NRF1和ATP6相似,分别优先与同目昆虫赤拟谷盗及龙骨薪甲属的E.brevicornis的NRF1和ATP6序列聚集成一簇。由于GenBank中鞘翅目PGC1-α氨基酸序列的缺失,因此在PGC1-α分支中,膜翅目和半翅目昆虫聚集后再与花绒寄甲PGC1-α形成姐妹群。对于研究较为深入的mtDNA编码的COX Ⅰ 氨基酸序列,花绒寄甲COX Ⅰ 先与皮坚甲科的Cerylonhisteroides聚集成簇,代表较接近的亲缘关系,然后再与鞘翅目其他昆虫的相应基因形成姐妹群。
2.3 线粒体合成调控基因的表达
2.3.1 在花绒寄甲不同组织中的表达 线粒体合成调控基因在花绒寄甲成虫不同组织中的表达情况见图2。

图柱上不同小写字母表示不同处理间差异显著(P<0.05)。下同Different lowercase letters represent significant difference (P<0.05).The same below
由图2可知,PGC1-α、NRF1、mtTFA、COXⅠ和ATP6基因在花绒寄甲成虫不同组织,如头、胸、中肠、后肠、脂肪体、精巢、卵巢和残体中均有表达,但表达量存在显著的组织特异性。整体而言,各基因在精巢和脂肪体中的表达量普遍较高,其中,nDNA编码序列在花绒寄甲精巢中表达量高于脂肪体,而mt DNA编码序列则相反。相对于其他组织,5个基因在花绒寄甲头部和中肠中的表达量较低。各基因的最高表达量和最低表达量之间存在显著的倍数关系,以基因ATP6的差异性最大,其在花绒寄甲脂肪体中的表达量是头部的2×103倍。同一种基因在不同组织中的表达量相差性较大,但是不同基因在相同组织中的表达量之间存在明显的相关性。
2.3.2 在花绒寄甲不同虫态中的表达 线粒体合成调控基因在花绒寄甲不同虫态中的表达情况见图3。
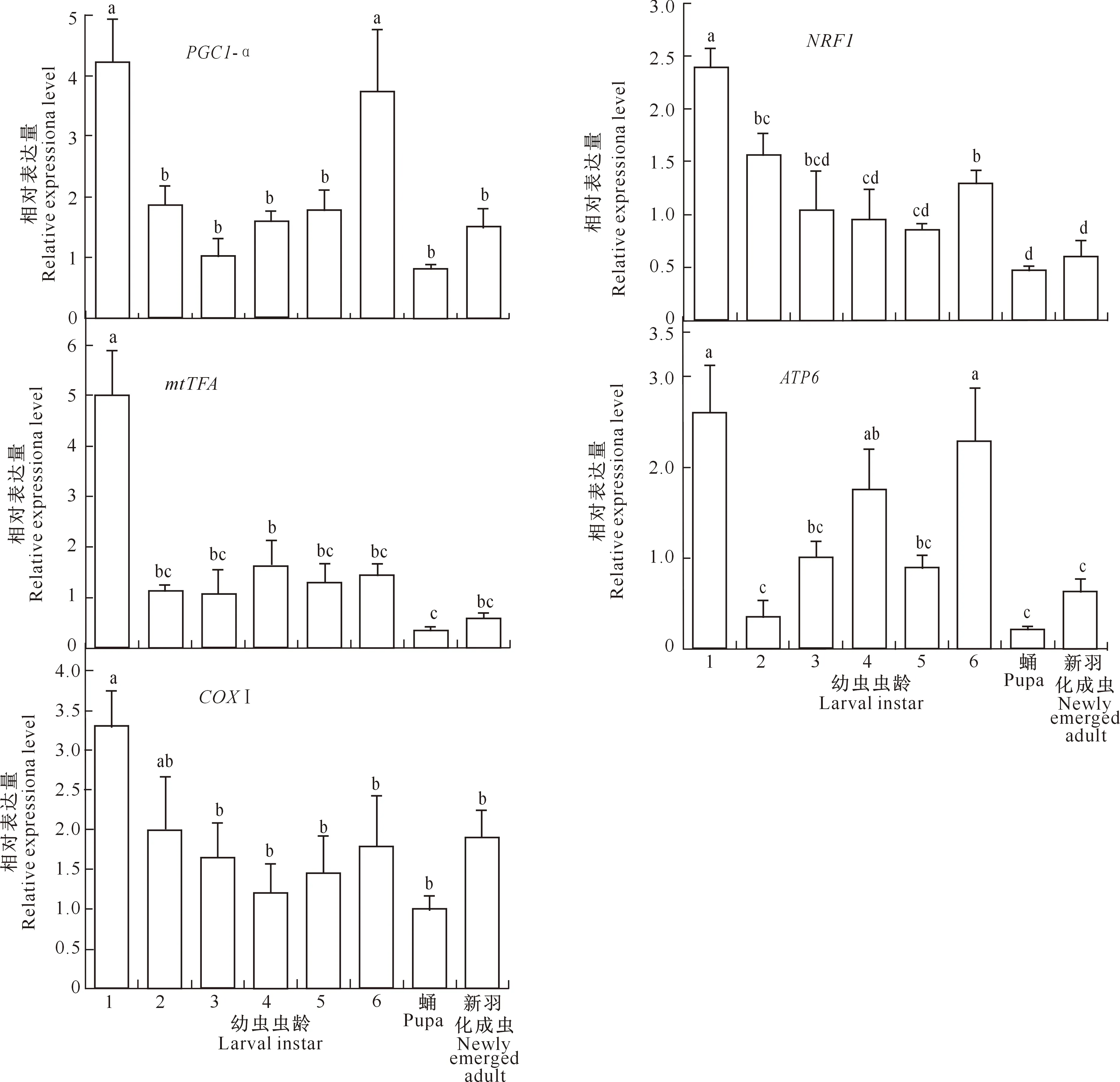
图3 线粒体合成调控基因在花绒寄甲不同虫态中的表达情况Fig.3 The expression levels of mitochondrial synthesis related genes in different developmental stages of Dastarcus helophoroides
由图3可以看出,PGC1-α、NRF1、mtTFA、COXⅠ和ATP6基因在1~6龄幼虫、蛹和新羽化成虫中均有表达,且表达量的差异性显著,其中,各基因在1龄幼虫中的表达量最高,而在蛹中的表达量最小。PGC1-α基因在1龄幼虫中的表达量是蛹中的5.25倍,NRF1基因在1龄幼虫中的表达量是蛹中的5.09倍,mtTFA基因在1龄幼虫中的表达量是蛹中的15.14倍,ATP6和COXⅠ基因在1龄幼虫中的表达量分别是蛹中的11.87倍和3.27倍。相比于2~5龄幼虫,6龄幼虫中PGC1-α和ATP6基因的表达量相对较高。此外,与蛹相比,新羽化成虫中各基因的表达量明显增加,但与蛹中的表达量差异不显著。
2.3.3 在不同虫龄中的表达 为了研究花绒寄甲不同虫龄中PGC1-α、NRF1、mtTFA、COXⅠ和ATP6基因的表达,分别测定了成虫羽化后2,4,10,12,18,20,26,30个月各调控基因的表达量,结果如图4所示。从图4可以看出,纵观各基因在不同虫龄中的表达,在前18个月内,不同时间点的表达量存在一定范围内的上下浮动,但以羽化后2个月和10个月各基因的表达量相对较高。当成虫羽化20个月后,各基因的表达量随着虫龄的增加呈上升趋势,在第30个月达到最大值。
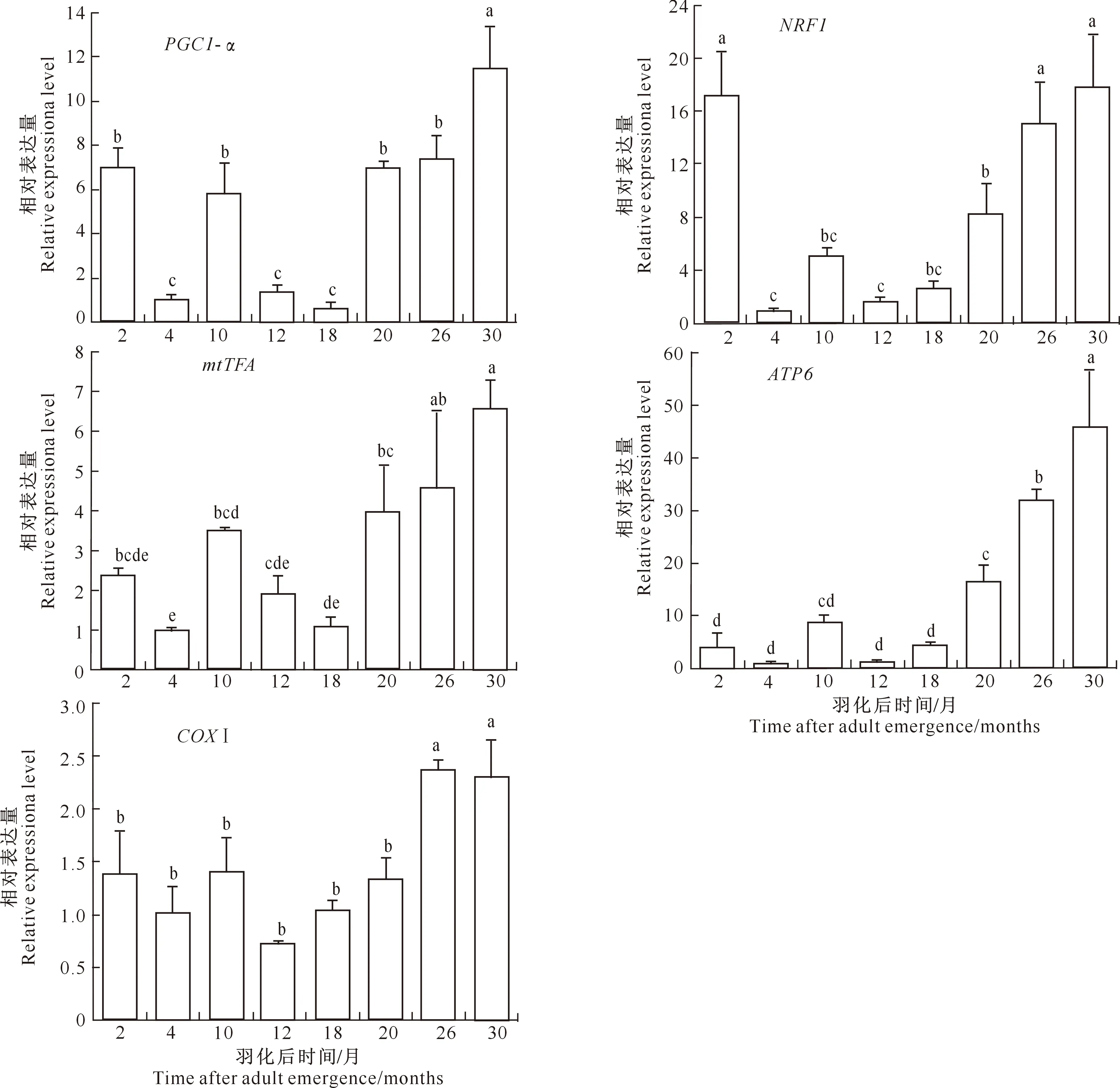
图4 线粒体合成调控基因在花绒寄甲成虫羽化后不同时期的表达情况Fig.4 The expression levels of mitochondrial synthesis related genes in different age groups of Dastarcus helophoroides adult
3 讨 论
线粒体是一种处于核基因组调控下的半自主型细胞器,其合成表达中的大部分组分均由核基因组编码[21]。Jones等[22]研究表明,在哺乳动物小鼠中NRFs的转录活性与转录共活化物PGC-1 密切相关,诱导线粒体的增殖、呼吸、能量代谢及适应性产热。Viader等[23]研究表明,中间协调产物NRFs通过活化mtTFA间接调节一些核编码的蛋白,使其与NRF-1和NRF-2基因共激活mtTFA基因,从而对mtDNA的转录产生影响。此外,呼吸链组分系列酶COXⅠ、COXⅡ、COXⅢ、Cytb、线粒体合成酶6和8亚基等蛋白的表达均与mtTFA的调控密切相关[24]。
在本研究得到的5个花绒寄甲线粒体合成调控基因序列中,mtDNA编码的ATP6和COXⅠ蛋白均为疏水性蛋白。这与张莹等[15]对大鼠中线粒体DNA基因表达的研究结果相似,ATP6亚基和COXⅠ亚基分别是组成ATP合酶复合体(FoF1-ATPase)疏水部分Fo和呼吸链复合体Ⅳ细胞色素C氧化酶(Cytochrome C oxidase)疏水部分的重要结构蛋白。本研究系统发育分析结果显示,花绒寄甲的NRF1、mtTFA和COXⅠ氨基酸序列与鞘翅目昆虫赤拟谷盗、E.brevicornis和C.histeroides的同源序列亲缘关系较近,而与膜翅目、半翅目、鳞翅目和双翅目昆虫亲缘关系较远,这与传统的形态分类学以及分子生物学分类结果一致[25]。
花绒寄甲的线粒体合成调控基因在特定组织和不同生长发育阶段的表达量存在很大差异。在不同组织中,精巢和脂肪体中的表达量明显高于头部和中肠。由于生殖系统精巢中储存着旺盛活动的精子,以产生大量ATP或ATPase来维持生物体的繁殖力[26]。这与雌激素相关受体基因(estrogen-related receptor,ERR)在家蚕化蛹初期精巢中的表达结果明显高于卵巢相同[27]。同时,脂肪体作为中间代谢组织,是蛋白质和糖类相互转化产生能量的主要场所,能合成重要的血糖并释放到血淋巴,为昆虫飞行提供能量[28-30],因此线粒体合成调控基因在这2个组织中的表达量相对较高。此外,相对于坚硬的几丁质外壳构成的头部,线粒体合成调控基因在胸部的表达量较高,昆虫胸部的飞翔肌具有非常强大的线粒体来确保昆虫的飞翔和行走[31-32]。线粒体调控基因在花绒寄甲不同虫态中表达量差异显著性,主要体现在活动力较强的1龄幼虫和其他龄期幼虫之间。花绒寄甲从幼虫、蛹到新羽化成虫的发育过程中,一直处于活动较为迟缓的状态[33]。其中,刚孵化的1龄幼虫拥有原生的足以便快速寻找寄主,致使线粒体合成调控基因在此阶段的表达量明显高于其他虫态[34]。2~5龄幼虫将头部伸进寄主体内而其他部分悬挂在寄主体外几乎不动,6龄幼虫从寄主上脱落准备进入不食不动的蛹期,使蛹中ATP合成调控基因的表达量最低[35]。蛹期是变态发育昆虫生长发育过程中的重要阶段,大量与能量代谢有关的基因在此时期的活性均大幅度减少,如蜕皮激素20E和己糖激酶[36-37]。线粒体合成调控基因在羽化后2个月和10个月的表达量相对较高,可能与花绒寄甲成虫在此时段求偶和产卵行为有关[38]。在羽化后20个月各调控基因的表达量明显上调,整体呈现上升趋势,这与花绒寄甲中Prx6基因的研究结果相似[39],其表达量随着羽化后时间延长而增加,以应对其体内新陈代谢活动所产生的ROS和H2O2。推测随着花绒寄甲存活时间的增加,其体内各组织的能量储备和抗性能力增强,各种基因的表达趋于稳定。但是,由于本试验仅研究到存活30个月成虫的基因表达情况,而各基因的表达量随着存活时间的持续增加如何变化,仍需进一步研究。
通过对花绒寄甲不同组织、虫态及虫龄中PGC1-α、NRF1、mtTFA、COXⅠ和ATP6基因的分析,发现调控线粒体合成的相关基因均有表达且表达量差异显著。本研究为进一步研究昆虫的能量代谢、抗氧化能力、ATP合成和生殖生理活动奠定了一定的理论基础。
[1] 王希蒙,任国栋,马 峰.花绒穴甲的分类地位及应用前景 [J].西北农业学报,1996,5(2):75-78.
Wang X M,Ren G D,Ma F.Classification position ofDastarcushelophoroidesand its applied prospects [J].Acta Agriculturae Boreali-Occidentalis Sinica,1996,5(2):75-78.
[2] 尚 梅,苏宝锋,李孟楼.花绒寄甲幼虫人工饲料的研究 [J].西北林学院学报,2009,24(1):136-139.
Shang M,Su B F,Li M L.Fodder development forDastarcushelophoroideslarvae (Coleoptera:Colydlidae) [J].Journal of Northwest Forestry University,2009,24(1):136-139.
[3] 李孟楼,王培新,马 峰,等.花绒坚甲对光肩星天牛的寄生效果研究 [J].西北农林科技大学学报(自然科学版),2007,35(6):153-156.
Li M L,Wang P X,Ma F,et al.Study on the parasitic efficiency ofDastarcushelophoroidesonAnoplophoraglabripennis[J].Journal of Northwest A&F University(Nat Sci Ed),2007,35(6):152-156.
[4] 李孟楼,李有忠,雷 琼,等.释放花绒寄甲卵对光肩星天牛幼虫的防治效果 [J].林业科学,2009,45(4):78-82.
Li M L,Li Y Z,Lei Q,et al.Biocontrol ofAsianlonghornedbettle larva by releasing eggs ofDastarcushelophoroides(Coleoptera:Bothrideridae) [J].Scientia Silvae Sinicae,2009,45(4):78-82.
[5] 杨忠岐,李建庆,梅增霞,等.释放花绒寄甲防治危害白蜡的云斑天牛 [J].林业科学,2011,47(12):78-84.
Yang Z Q,Li J Q,Mei Z X,et al.Biocontrol ofBatocerahorsfieldi(Coleoptera:Cerambycidae) attacking ash trees by releasing the parasitoidDastarcushelophoroides(Coleoptera:Bothrideridae) [J].Scientia Silvae Sinicae,2011,47(12):78-84.
[6] 卢希平,杨忠岐,孙绪艮,等.利用花绒寄甲防治锈色粒肩天牛 [J].林业科学,2011,47(10):116-121.
Lu X P,Yang Z Q,Sun X G,et al.Biological control ofAprionaswainsoni(Coleoptera:Cerambycidae) by releasing the parasitic beetleDastarcushelophoroides(Coleoptera:Bothrideridae) [J].Scientia Silvae Sinicae,2011,47(10):116-121.
[7] Mitchell P,Moyle J.Chemiosmotic hypothesis of oxidative phosphorylation [J].Nature,1967,213:137-139.
[8] Kotiadis N V,Duchen R M,Osellame D L.Mitochondrial quality control and communications with the nucleus are important in maintaining mitochondrial function and cell health [J].Biochimica et Biophysica Acta-Biomembranes,2014,1840(4):1254-1265.
[9] 陈丽峰,柳君泽.细胞核基因组与线粒体基因组的相互调控 [J].中国病理生理杂志,2005,21(8):1614-1618.
Chen L F,Liu J Z.The coordinated regulation between nuclear DNA and mitochondria DNA [J].Chinese Journal of Pathophysiology,2005,21(8):1614-1618.
[10] 马晓娟,唐燕红.AMPK/PGC1-α通路在骨骼肌中作用的研究进展 [J].卫生与健康,2012(16):301-304.
Ma X J,Tang Y H.The role of AMPK/PGC1-α pathway in skeletal muscle research progress [J].China Science and Technology Review,2012(16):301-304.
[11] 王 艳,黄德强,罗志军.AMPK对线粒体功能的调节 [J].中国细胞生物学学报,2013,35(10):1434-1443.
Wang Y,Huang D Q,Luo Z J.AMPK regulate mitochondrial function [J].Chinese Journal of Cell Biology,2013,35(10):1434-1443.
[12] Wu Z,Puigserver P,Andersson U,et al.Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1 [J].Cell,1999,98:115-124.
[13] Steinberg G R,Kemp B E.AMPK in health and disease [J].Physiological Reviews,2009,89(3):1025-1078.
[14] Kang C H,Ji L L.Role of PGC-1α in muscle function and aging [J].Journal of Sport and Health Science,2013,2:81-86.
[15] 张 莹,别 平,石承先,等.mtTFA、NRF-1对冷保存-再灌注肝移植大鼠线粒体DNAATPase6基因表达的调节 [J].世界华人消化杂志,2008,16(21):2337-2342.
Zhang Y,Bie P,Shi C X,et al.Effects of mitochondrial transcription factor A and nuclear respiratory factor-1 on the expression of mitochondrial DNAATPase6 genes during cold preservation and reperfusion injury in rat orthotopic liver transplantation [J].World Chinese Journal of Digestology,2008,16(21):2337-2342.
[16] 李伟文,陆松敏,方传勤,等.失血性休克大鼠肠上皮细胞mtTFA、COXⅠ、COXⅣ基因表达的改变 [J].中国现代医学杂志,2012,22(24):1-4.
Li W W,Lu S M,Fang C Q,et al.Changes of expressions ofmtTFA,COXⅠandCOXⅣ genes of small intestine epithelial cells in rats during hemorrhagic shock [J].China Journal of Modern Medicine,2012,22(24):1-4.
[17] 宋 旺,王小纪,郭瑞坚,等.花绒寄甲荧光定量PCR分析中内参基因的选择 [J].西北农业学报,2015,24(2):124-129.
Song W,Wang X J,Guo R J,et al.Selection of reference genes for quantitative real-time PCR normalization inDastarucushelophoroides[J].Acta Agriculture Boreali-Occidentalis Sinica,2015,24(2):124-129.
[18] Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods [J].Mol Biol Evol,2011,28:2731-2739.
[19] Livak K J,Schmittgen T D.Analysis or relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J].Methods,2001,25:402-408.
[20] 刘骏恂,俞菊华,李红霞,等.建鲤极长链脂酰辅酶A脱氢酶基因cDNA克隆及相关定量表达分析 [J].南方农业学报,2015,46(4):680-686.
Liu J X,Yu J H,Li H X,et al.Cloning,sequence analysis and relevant quantitative expression analysis ofVLCADcDNA fromCyprinuscarpiovar.Jian [J].Journal of Southern Agriculture,2015,46(4):680-686.
[21] 周海洋,时 多,王学敏.核呼吸因子-1:细胞核调控线粒体功能的一种重要因子 [J].生命的化学,2005,25(3):202-204.
Zhou H Y,Shi D,Wang X M.NRF-1:the important factor which for nuclear controlling mitochondrial function [J].Chemistry of Life,2005,25(3):202-204.
[22] Jones A W,Yao Z,Vicencio J M,et al.PGC-1 family coactivator sand cell fate:roles incancer,neurodegeneration,cardiovascular disease andretrograde mitochondria-nucleus signaling [J].Mitochondrion,2012,12:86-99.
[23] Viader A,Wright-Jin E C,Vohra B P,et al.Differential regional and subtype-specific vulnerability of enteric neurons to mitochondrial dysfunction [J].PLoS One,2011,6:e27727.
[24] 刘 涛,章军建,王 丽,等.慢性脑缺血对大鼠皮质神经细胞PGC-1和mtTFAmRNA表达的影响 [J].中华神经科杂志,2006,39(12):847.
Liu T,Zhang J J,Wang L,et al.The influence of chronic cerebral ischemia to expression ofPGC-1 andmtTFAmRNA in mice cortex nerve cells [J].Chinese Journal of Neurology,2006,39(12):847.
[25] Zhang Z Q,Wang X J,Li R Z,et al.The mitochondrial genome ofDastarcushelophoroides(Coleoptera:Bothrideridae) and related phylogenetic analyses [J].Gene,2015,560:15-24.
[26] Grootegoed J A,Den Boer P J.Energy metabolism in spermatids:a review [C]∥Hamilton D W,Waites G M H.Cellular and molecular events in spermiogenesis.Cambridge:Cambridge University Press,1989:193-215.
[27] 沈关望,胡诗圆,王 勇,等.家蚕雌激素相关受体基因的克隆与表达分析 [J].昆虫学报,2015,58(12):1278-1284.
Shen G W,Hu S Y,Wang Y,et al.Molecular cloning and expression profiling of an estrogen-related receptor gene in the silkworm,Bombyxmori[J].Acta Entomologica Sinica,2015,58(12):1278-1284.
[28] 葛 君,李 兵,沈卫德.昆虫脂肪体与抗药性的关系研究现状与分析 [J].江苏农业科学,2010(6):183-185.
Ge J,Li B,Shen W D.The relationship of insect fat body and drug resistance research status and analysis [J].Jiangsu Agricultural Sciences,2010(6):183-185.
[29] 张道伟,陈 静,郭玉双.白背飞虱海藻糖合成酶基因的克隆及序列分析 [J].黑龙江农业科学,2012(5):14-19.
Zhang D W,Chen J,Guo Y S.Cloning and sequence analysis of trehalose synthase gene fromSogatellafurcifera[J].Heilongjiang Agriculture Science,2012(5):14-19.
[30] 陈 静,张建华,郭玉双,等.白背飞虱海藻糖酶Treh-2基因克隆及生物信息学分析 [J].东北农业大学学报,2013,44(6):112-117.
Chen J,Zhang J H,Guo Y S,et al.Cloning and bioinformatics analysis ofTreh-2 gene fromSogatellafurcifera[J].Journal of Northeast Agricultural University,2013,44(6):112-117.
[31] 冉 莉,涂 晶,肖新华,等.小鼠PGC1-α基因启动子的转录调控功能分析 [J].中南医学科学杂志,2013,41(6):546-550.
Ran L,Tu J,Xiao X H,et al.Analyzing the transcription regulation function ofPGC1-αgene promoter in mouse [J].Medical Science Journal of Central South China,2013,41(6):546-550.
[32] Che X B,Xia N B,Tu Q H.Studies on the ultrastructure of flight muscle in adultDendrolimustabulaeformi[J].Journal of Beijing Forestry University,1996,5(1):90-97.
[33] Urano T.Preliminary release experiments in laboratory and outdoor cages ofDastarcushelophoroides(Fairmaire) (Coleoptera:Bothrideridae) for biological control ofMonochamusalternatusHope (Coleoptera:Cerambycidae) [J].Bulletin of the Forestry and Forest Products Research Institute,2003,2:255-261.
[34] 雷 琼,李孟楼,杨忠岐.花绒坚甲的生物学特性研究 [J].西北农林科技大学学报(自然科学版),2003,31(2):62-66.
Lei Q,Li M L,Yang Z Q.Research onDastarcushelophoroidesbiological characteristics [J].Journal of Northwest A&F University(Nat Sci Ed),2003,31(2):62-66.
[35] Miura K,Abe T,Nakashima Y,et al.Field release of parasitoidDastarcushelophoroides(fairmaire) (Coleoptera:Bothrideridae) on pine logs infested withMonochamusalternatusHope (Coleoptera:Cerambycidae) and their dispersal [J].Journal of the Japanese Forestry Society,2003,85:12-17.
[36] 罗婉冰,何文婧,黄玉秋,等.斜纹夜蛾中肠糖代谢相关基因的克隆及表达模式分析 [J].昆虫学报,2013,56(9):965-973.
Luo W B,He W J,Huang Y Q,et al.Cloning and expression profiling of genes involved in glycometabolism in the midgut ofSpodopteralitura(Lepidoptera:Noctuidae) [J].Acta Entomologica Sinica,2013,56(9):965-973.
[37] Lin X W,Xu W H.Hexokinase is a key regulator of energy metabolism and ROS activity in insect lifespan extension [J].Aging,2016,8(2):1-15.
[38] 王亚红,来燕学,岑定浩,等.花绒寄甲产卵行为和产卵量及对松褐天牛幼虫的寄生作用 [J].环境昆虫学报,2011,33(4):517-522.
Wang Y H,Lai Y X,Cen D H,et al.Behavior and numbers of theDastarcushelophoroidesbeetle’s laying egg and its first-instar larvae parasitism on larvae ofMonochamusalternatus[J].Journal of Environmental Entomology,2011,33(4):517-522.
[39] 郭瑞坚,郝春凤,张正青,等.花绒寄甲Prx6基因的确定和表达分析 [J].西北农林科技大学学报(自然科学版),2016,44(8):148-154,161.
Guo R J,Hao C F,Zhang Z Q,et al.Identification,characterization and expression analysis ofPrx6 genes inDastarcushelophoroieds[J].Journal of Northwest A&F University(Nat Sci Ed),2016,44(8):148-154,161.

