猪源莫拉菌的分离鉴定与部分生物学特性分析
廖倡宇,张鹏飞,王 印,*,杨泽晓,姚学萍,姜睿姣,邬旭龙, 张 博, 周丽军,宋 勇
(1.四川农业大学 动物医学院,四川 成都 611130; 2.动物疫病与人类健康四川省重点实验室,四川 成都 611130; 3.天津瑞普生物技术股份有限公司,天津 300300)
莫拉菌属(Moraxella. ap.)是一类成对状或短链状的革兰阴性菌,短且宽,接近球状。卡他莫拉菌属发现于1896年,当时称卡他微球菌(MicrococcusCatarrhais),是上呼吸道的正常菌群之一。过去人们一致认为无致病性,但近年来研究表明,该菌可寄生于人和其他温血动物黏膜,是一种条件致病菌,当机体免疫力下降时,可单独或与其他细菌共同引起急性中耳炎、鼻窦炎、支气管肺部感染,以及脑膜炎、心内膜炎和败血症等各种感染[1]。所导致的感染为多点散发,偶可引起医院内暴发,卡他莫拉菌是急性中耳炎、鼻窦炎、慢性气管炎急性发作和社区获得性肺炎最主要的致病菌之一,也是小儿脑膜炎及菌血症的常见病因,引起了广泛临床关注[2]。该菌可产生穿孔毒素,引起黏膜和结膜病变,具有传染性[3]。其中,牛莫拉菌可引起牛传染角膜结膜炎,亦称牛红眼病(IBK)[4];该病在美国常见的牛病中居第二位,造成巨大的经济损失,而且全球均有发生[5]。该菌已从兔[6]、骆驼[7]、犬[8]、山羊[9]、绵羊[10]、豚鼠[11]等多种动物分离得到。近年来从患有脑膜炎、心内膜炎的病猪中分离的莫拉菌数量呈上升趋势[12-14]。
2016年11月,从四川某地送检2 头仔猪,症状主要为发热,食欲减低,呼吸急促,眼睑有轻微肿大;病理剖检发现胸腔大量积液,同时心脏上附着有少量伪膜。剖检主要表现为胸膜炎症,与副猪嗜血杆菌病理症状相似,PCR检测圆环2型病毒核酸为阳性。故本研究采用常规的微生物实验技术,通过纯化分离、生化试验、16S rDNA扩增测序、动物试验、药敏试验以及3种耐药基因的PCR扩增分析。对送检的病料进行检测,为该病的临床诊断、药物治疗奠定基础。
1 材料与方法
1.1 病料和试验动物
临床样品采集自四川省某猪场2 头猪的病变心脏; SPF健康昆明鼠18~22 g(购自四川达硕生物科技公司)。
1.2 主要试剂
营养琼脂培养基、麦康凯琼脂培养基、绵羊鲜血平板、药敏纸片及微量生化反应管均购自杭州微生物试剂有限公司;2×TaqPCR Master Mix、DNA分子量标准、凝胶回收试剂盒等均购自成都擎科生物科技有限公司;其他试剂均为国产分析纯。
1.3 细菌分离
无菌采集病料样品接种于胰蛋白胨大豆琼脂(TSA)培养基,37 ℃恒温培养48~72 h后观察细菌生长状况,挑菌后革兰染色镜检,通过平板划线法进行细菌纯化,并用鲜血平板鉴定其溶血性。
1.4 形态学观察与生化鉴定
挑取单菌落接种于已添加5 μL生长因子NAD的微量生化管中,37 ℃培养48~72 h,参照《常见细菌系统鉴定手册》[15]和《伯杰细菌鉴定手册》[16]进行生化特性鉴定。
1.5 16S rDNA的扩增及序列测定
利用试剂盒提取细菌基因组DNA,放置于-20 ℃备用,作为PCR模板。PCR反应体系40 μL: 2×TaqPCR Master Mix 20.0 μL,ddH2O 10.0 μL,上、下游引物各3.0 μL(表1),模板DNA 4.0 μL。反应条件:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸2 min,34个循环;72 ℃延伸10 min。将PCR产物纯化后,送生工生物工程(上海)股份有限公司进行测序。
1.6 系统发育树的构建
PCR扩增产物测序后获得菌株的16S rDNA序列,将该序列在GenBank上采用BLAST进行比对,确定种属范围。选取同属不同动物源性的部分菌株16S rDNA序列用DNAstar软件进行同源性分析,使用MEGA 5.1软件对其运用邻近法(neigh-bour joining)构建进化树(phylogenetic tree)。
1.7 小鼠致病性试验
参照改良寇氏法,分离菌株接种到胰蛋白胨大豆肉汤(TSB)培养基中,37 ℃培养48 h后,将菌液浓度调整为1×109cfu·mL-1的细菌悬液。选择用无特定病原体小鼠(SPF小鼠)(每只18~22 g),每组5 只,设立5 组,腹腔注射每只注射0.2 mL的菌液;同时设立对照组,注射等量的无菌生理盐水。
1.8 药敏试验
参照CLSI推荐的琼脂扩散法(K-B)进行分离株的药物敏感试验。
1.9 耐药基因PCR检测
选取了β-内酰胺酶类Tem-1、DHA-1两种耐药基因和耐受碳青霉烯类药物的耐药基因OXA-48,并分别使用相关特异性引物(表1)进行耐药基因的PCR检测。反应体系40.0 μL: 2×TaqPCR Master Mix 20.0 μL,模板4.0 μL,上下游引物各1.5 μL。反应条件:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸2 min,34个循环;72 ℃延伸10 min。对PCR阳性扩增片段进行胶回收,转化至DH5α感受态细胞中,将产物送成都擎科生物科技有限公司测序,将测序结果进行BLAST分析。
2 结果与分析
2.1 菌体形态观察
菌株ZY20001在普通平板生长不良,麦康凯平板不生长, TSA生长较好, 40 h以上方可见明显菌落。该菌的菌落圆润,半透明,光滑,隆起,菌落直径1~2 mm,无溶血性。革兰染色镜检为革兰阴性菌,短杆状,一般成对状排列(图1)。
2.2 PCR扩增结果和进化树分析
将挑取的ZY20001菌落进行PCR扩增,大小约为1 400 bp(图2)。将其16S rDNA测序结果进行BLAST比对分析,发现与莫拉菌(GenBank登录号GU226327.1)同源性高达99%。在NCBI上选取不同来源的莫拉菌(表2)16S rDNA序列,通过DNAstar比对同源性,发现ZY20001与Moraxellasp.(GenBank登录号:GU226327.1)和(GenBank登录号:NR_042666.1)同源性高达99.5%(图4)。通过MEGA 5.1进行序列比对,发现该株莫拉菌与猪源分支莫拉菌同源性最高(图3),该分支与其他动物源分支莫拉菌为并列关系。
表2试验用引物序列
Table1Primer sequences used in this experiment

基因名称Genename引物序列Primersequence(5'-3')片段长度Productslength/bp扩增基因名称Amplifiedgenename16SrDNAP1:AGTTTGATCCTGGCTCAG150016srDNAP2:TTACCTTGTTACGACTOXA-48P1:CTTTCACAGGTGTGCTGGGT743碳青霉素烯酶P2:GTACGCATACTGGCTTTGCCarvapenmaseDHA-1P1:CTTTCACAGGTGTGCTGGGT405产头孢菌素内酰胺酶P2:GTACGCATACTGGCTTTGCAmpCbeta-lactamaseTEM-1P1:AAATTCTTGAAGAC1075产超广谱内酰胺类酶P2:CCAATGCTTAATCAExtendedspectrumbeta-lactamases
试验用引物序列参照文献[17], 引物由成都擎科生物科技有限公司合成。
Test primer sequences were designed according to the literature [17]. Primers were synthesized by Chengdu Tsingke Biotechnology Technology Limited Engine.

图1 革兰染色结果(10×100)Fig.1 Result of Gram staining (10×100)
2.3 细菌生化特性
分离菌经48~72 h生长后,触酶阳性;V-P试验、MR试验、H2S试验、鸟氨酸脱氢酶、运动性、葡萄糖、乳糖、半乳糖、麦芽糖、七叶酸水解阿拉伯糖、D-葡萄糖产酸产气,0%和1%的NaCl均为阴性。与《伯杰细菌鉴定手册》描述的莫拉菌属部分菌株的部分生化特性相同,该菌生长需要的营养要求较高。普通的单一的营养成分基本无法适应其生长。
2.4 小鼠致病性试验
注射菌液12 h左右,小鼠出现精神不振,部分小鼠停止进食。24 h后,随机选取部分精神状态不佳的小鼠剖检,未发现典型的病变特征,48 h剖检精神状态不佳小鼠,发现小鼠心包少量积液(约0.03 mL),无伪膜。无菌蘸取积液接种于TSA平板,进行分离纯化,经过细菌分离鉴定后再次分离到该菌。96 h后,剩余的小鼠开始逐步进食,饮水。1周内所有小鼠逐步恢复,试验期间,未见死亡。
2.5 细菌的药敏试验
通过对ZY20001菌株的药敏试验,发现其对庆大霉素,阿米卡星等16种抗生素敏感,对奥复星,多粘菌素B等5种抗生素中度敏感,对哌拉西林耐药(表4)。
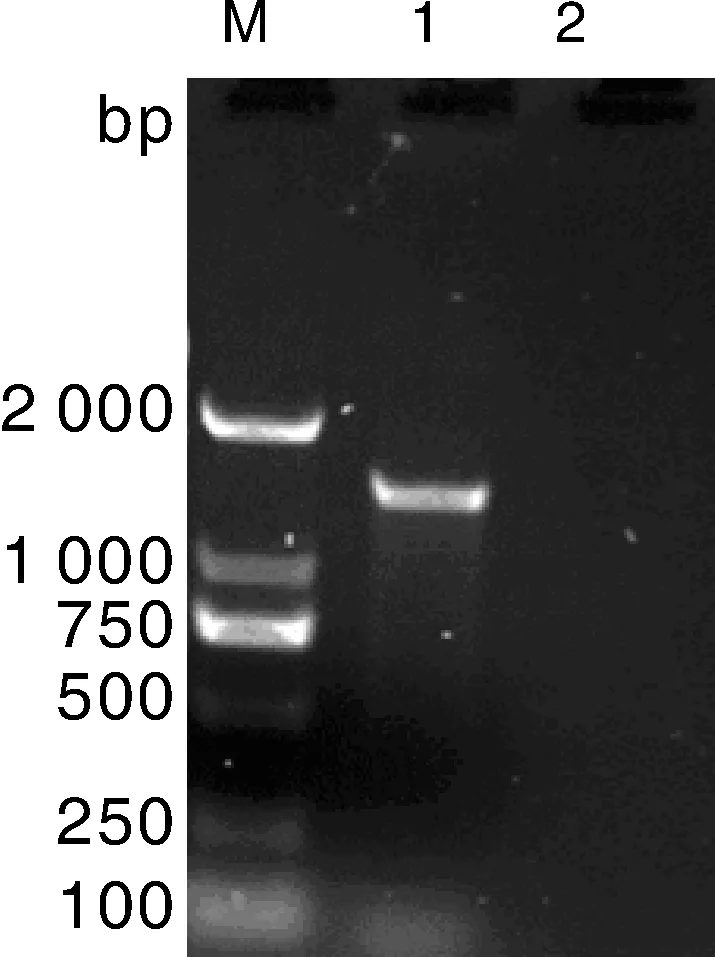
M, DL 2000分子质量标记; 1, 16S rDNA扩增结果; 2, 阴性对照。M, DL 2000 marker; 1, 16S rDNA amplification results; 2, Negative control.图2 16S rDNA扩增结果Fig.2 16S rDNA amplification results
2.6 耐药基因PCR扩增结果
对分离菌株ZY20001进行3种耐药基因的PCR检测,结果显示(图5),Tem-1基因条带阳性,长度为1 075 bp。OXA-48耐药基因和DHA-1耐药基因PCR扩增为阴性。根据药敏结果显示,该菌对青霉素高度敏感,但该菌又含有Tem-1耐药基因。可见含有耐药基因不一定会表现出该基因的耐药表型。
表2菌株说明
Table2Strain description

菌株Strains登录号Accessionnumber来源Source地区RegionsSN10-2MGU226327.1猪Porci西班牙Spain248-01NR_042666.1猪Porci西班牙SpainCD12CA4EF396294.1猪Porci西班牙SpainSN9-4MNR_116918.1猪Porci西班牙SpainCCUG_2154NR_041695.1兔Cunculi瑞典SwedenCCUG2154TAF005188.1兔Cunculi瑞典SwedenMOR44FM244731.1骆驼Camel比利时BelgiumMOR43FM244730.1骆驼Camel比利时BelgiumATCC25238TAF005185.1人Homosapiens瑞典SwedenNe11NR_028669.1人Homosapiens瑞典SwedenATCC25238NR_118775.1羊Ovis瑞典SwedenATCC33078TAF005186.1羊Ovis瑞典Sweden199/55NR_028670.1羊Ovis瑞典SwedenSp346JN001947.1牛Calf乌拉圭UruguaySJ03BJN001946.1牛Calf乌拉圭UruguayFs328JN001948.1牛Calf乌拉圭UruguayN7NR_028914.1犬Canis美国USALMG11194TAJ269511.1犬Canis比利时Belgium
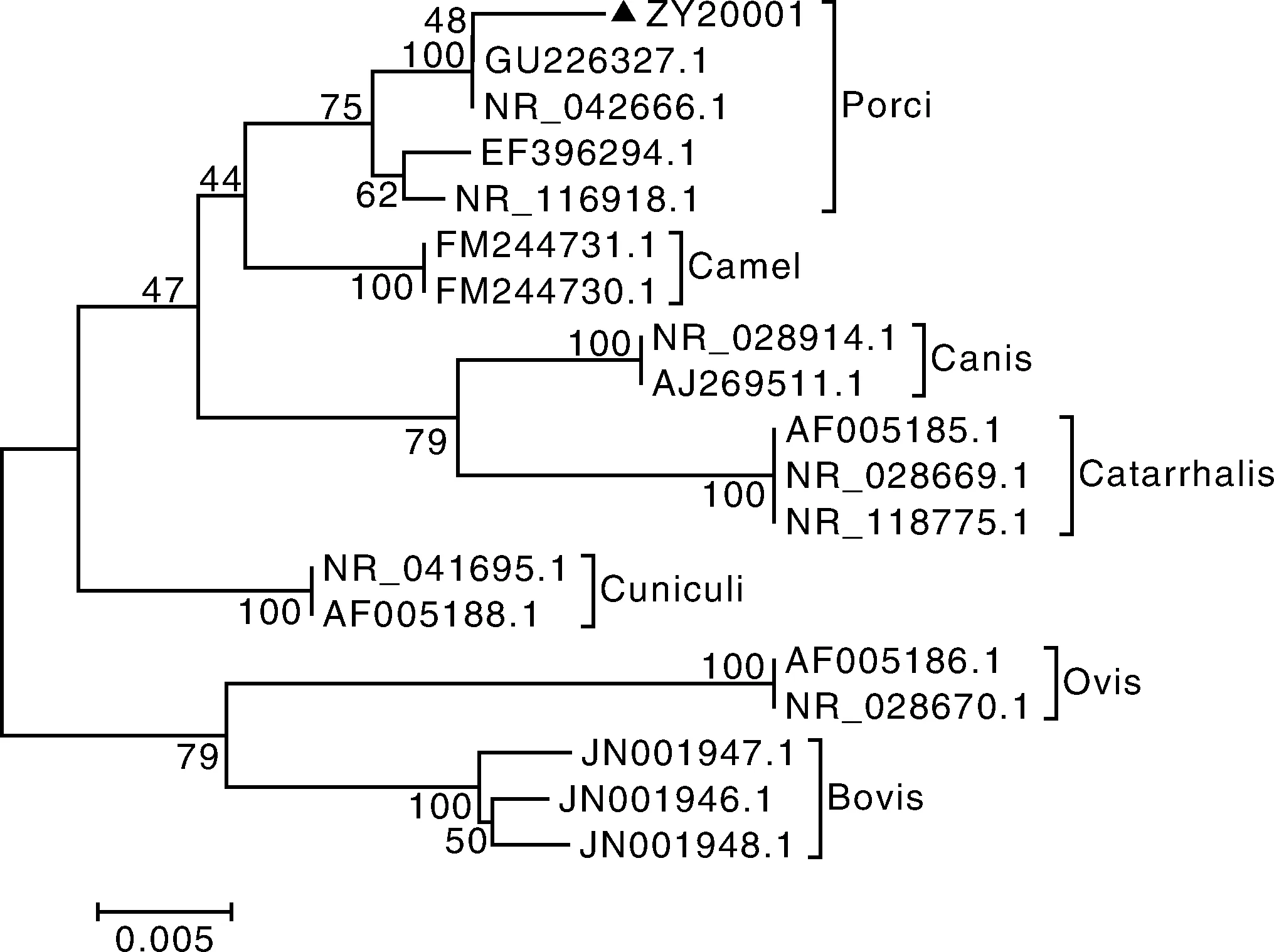
图3 16S rDNA进化树Fig.3 Phylogenetic tree based on 16S rDNA

图4 16S rDNA同源性Fig.4 Homology of 16S rDNA
表4分离株药物敏感性试验结果
Table4Drug sensitivity test results of isolates

药物Drug剂量Dose/μg抑菌圈直径Diameter/mm敏感度Sensitivity庆大霉素Gentamicin1026S阿米卡星Amikacin2024S卡那霉素Kanamycin3016S四环素Cyclomycin3027.5S青霉素Penicillin10U24S哌拉西林Piperacillin1000R头孢曲松Ceferiaxone3024S头孢哌酮Cefoperazone7525S头孢氨苄Cefalexin3023S奥复星Ofloxacin518I多西环素Doxycycline2425S诺氟沙星Norfloxacin1014I环丙沙星Ciprofloxacin518I氟苯尼考Florfenicol3020S左氧氟沙星Levofloxacin524S恩诺沙星Enrofloxacin1020S多粘菌素PolymyxinB3014I复方新诺明Cotrimoxazole23.7516I呋喃唑酮Furazolidone30024S红霉素Erythromycin1540S头孢曲松Rocephin3020S麦迪霉素Mydecamycin3020S
S为敏感; I为中度敏感; R为耐药。
S,Sensitive; I, Intermediary; R, Resistance.

M, DL 2000分子质量标记; 1、2、3分别为Tem-1,OXA-48,DHA-1; Tem-1长度是1 075 bp。M, DL 2000 marker. 1, 2, 3 were Tem-1,OXA-48,DHA-1,respectively. The length of Tem-1 is 1 075 bp.图5 ZY20001部分耐药基因PCR扩增产物的琼脂糖检测Fig.5 Agarose detection results of ZY20001 partial resistance gene PCR amplification products
3 讨论
国内外对猪源莫拉菌研究较少,但近年来,分离出的致病猪源莫拉菌呈现上升趋势,国内却未见报道。本研究所分离的猪源莫拉菌国内尚属首例。
由于国内尚无对猪源莫拉菌较为系统的划分,故本研究将部分莫拉菌属的16S rDNA序列按动物源将莫拉菌进行分型,发现猪源莫拉菌是属于莫拉菌的一个亚种,与牛源莫拉菌、兔源莫拉菌、犬莫拉菌、卡他莫拉菌一样,形成一个独立的分支,这与Vela等[14]的研究结果一致。实验过程中发现,猪源莫拉菌对营养要求较高,生长周期较慢,40 h左右才出现明显的菌落,对兽医临床常用抗生素表现不同程度的敏感,在环境中极易死亡[3]。故临床样本中极少能分离出该菌。
菌株ZY20001对21种抗生素表现出不同程度的敏感性。菌株ZY20001具有TEM型β-内酰胺酶基因,药敏试验结果显示对青霉素敏感,其耐药的表型与基因型不符,菌株ZY20001具有潜在抗药性。由于环境和遗传调控着抗生素耐药性表型表达,已有研究表明,过长的生长周期将导致β-内酰胺类的抗生素药效降低。该菌生长周期较缓慢,但菌株ZY20001依然表现明显的敏感性,并且对多种抗生素表现出敏感,极有可能是菌株ZY20001摄取抗生素的能力较强,即使细菌产生β-内酰胺酶,但是酶尚不足以完全作用于进入菌体的青霉素。在某些情况下,例如在PhoPQ系统中,脂质A的改变,其降低负电荷并且导致阳离子肽静电排斥到细胞表面。这与生物膜中观察到的另一个常见的反应类似:多重耐药外排泵的增加,增加抗生素的外排或降低的抗生素摄取的能力,这些功能与代谢活性降低或膜的成分变化有关[19]。综上,可能是菌株ZY20001的TEM型β-内酰胺酶的耐药基因位点发生突变、耐药基因水平转移等因素导致或该菌具有较强的抗生素摄取的能力。
莫拉菌属作为一类条件致病菌,主要侵袭部位为人和动物的黏膜。受感染的患畜多伴有黏膜部位或结膜部位的炎症,在一定条件下可引起仔猪的全身感染。本研究表明,猪源莫拉菌对营养要求较高,对环境的耐受较差,该菌对多种抗生素敏感,这可能也是该菌引起的相关疾病偶有发生,未大面积出现的重要原因。该菌含有TEM型β-内酰胺酶基因,却少见地表现出对青霉素敏感。可见,有TEM型β-内酰胺酶基因并不一定会表现出青霉素耐药,这为猪源莫拉菌的临床用药和进一步耐药机理研究提供了科学依据。
[1] 李光辉,张永信. 卡他莫拉(布兰汉)菌研究现状[J]. 国外医学(微生物学分册),1995(1):20-21, 37.
LI G H, ZHANG Y X. The present situation of theMoraxellacatarrhalis(Branhamella)[J].ForeignMedicine(MicrobiologySection), 1995(1):20-21, 37. (in Chinese)
[2] 周庆琳. 卡他莫拉菌肺炎1例[J]. 湖北职业技术学院学报, 2003, 6(2):80-81.
ZHOU Q L. One case ofMoraxellacatarrhalispneumonia[J].JournalofHubeiVocationalandTechnicalCollege, 2003, 6(2):80-81. (in Chinese)
[3] 陆承平. 兽医微生物[M]. 5版. 北京:中国农业大学出版社,2012: 112.
[4] 谷永江, 王亚军, 李娜,等. 奶牛传染性角膜结膜炎的综合治疗[J]. 吉林农业月刊, 2014, 35(16):54-54.
GU Y J, WANG Y J, LI N, et al. Comprehensive treatment of infectious corneal conjunctivitis in dairy cows[J].JilinAgriculturalMonthly, 2014, 35 (16):54-54. (in Chinese)
[5] HOLZHAUER M, VISSER I, VAN MAANEN K. Infectious bovine keratoconjunctivitis (IBK) in cows, clinical and lab review at four farms[J].TijdschriftVoorDiergeneeskunde, 2004, 129(16):526-529.
[6] 肖西志, 梁成珠, 张彦明,等. 兔皮中有害细菌16s rDNA RFLP指纹图谱分析方法的建立[C]//动物检疫学分会2010年学术年会论文集,2010.
[7] TEJEDORJUNCO M T, GUTIERREZ C, GONZALEZ M, et al. Outbreaks of keratoconjunctivitis in a camel herd caused by a specific biovar ofMoraxellacanis[J].JournalofClinicalMicrobiology, 2010, 48(2):596-598.
[8] 刘美清, 王占伟, 梁小红,等. 急性心肌梗死患者术后血液中分离出奥斯陆莫拉菌1株[J]. 检验医学与临床, 2016, 13(10):1453-1454.
LIU M Q,WANG Z W,LIANG X H, et al. Isolated 1 strain ofMoraxellaamericanain postoperative blood of patients with acute myocardial infarction[J].JournalofLaboratoryMedicineandClinicalMedicine, 2016, 13 (10):1453-1454. (in Chinese with English abstract)
[9] 张素辉, 黄勇富, 付利芝,等. 山羊源奥斯陆莫拉菌的分子鉴定与分析[J]. 中国人兽共患病学报, 2014, 30(1):12-16.
ZHANG S H, HUANG Y F, FU L Z, et al. Molecular classification and analysis ofMoraxellaosloensisfrom goats[J].ChineseJournalofZoonoses, 2014, 30 (1): 12-16.(in Chinese with English abstract)
[10] 王江博. 一株莫拉氏菌新种的分离鉴定与特性研究 [D]. 雅安:四川农业大学, 2016.
WANG J B.Study on the identification and characterization of a new species ofMoraxella[D]. Ya’an: Sichuan Agricultural University, 2016.(in Chinese with English abstract)
[11] SUGIMOTO C, MIVAGAWA E, NAKAZAWA M, et al. Cellular fatty acid composition comparisons ofhaemophilusequigenitalisandMoraxellaspecies[J].InternationalJournalofSystematicBacteriology, 1983, 33(2):181-187.
[12] VELA A I, COLLINS M D, LAWSON P A, et al.Uruburuellasuisgen. nov., sp. nov., isolated from clinical specimens of pigs[J].InternationalJournalofSystematic&EvolutionaryMicrobiology, 2005, 55(Pt 2):643-647.
[13] LARSEN J L, BILLE N, NIELSEN N C. Occurrence and possible role ofMoraxellaspecies in pigs[J].ActaPathologicaetMicrobiologicaScandinavica, 1973, 81B(2):181-186.
[14] VELA I, SANCHEZ-PORRO C, ARAGN V, et al.Moraxellaporcisp. nov., isolated from pigs[J].InternationalJournalofSystematic&EvolutionaryMicrobiology, 2010, 60(Pt 10):2446-2450.
[15] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册 [M]. 北京:科学出版社,2001.
[16] 布坎南 R E. 伯杰细菌鉴定手册 [M]. 8版. 北京:科学出版社, 1984.
[17] 蒙正群, 冷依伊, 任梅渗,等. 一株牛源肺炎克雷伯氏菌的分离鉴定与耐药基因型检测[J]. 浙江农业学报, 2017, 29(4):534-541.
MENG Z Q, LENG Y Y, REN M S. Isolation and identification ofKlebsiellapneumoniaeand detection of drug resistance genotypes in a cattle source[J].ActaAgriculturaeZhejiangensis, 2017, 29 (4):534-541. (in Chinese with English abstract)
[18] 李宏,韦晓兰. 表型组学:解析基因型-表型关系的科学[J]. 生物技术通报,2013,22(7):41-47.
LI H, WEI X L. Phenotypic histology: Science to analyze genotype-phenotypic relationships[J].BiotechnologyBulletin, 2013, 22(7):41-47. (in Chinese with English abstract)
[19] HUGHES D,ANDERSSON I. Environmental and genetic modulation of the phenotypic expression of antibiotic resistance[J].FEMSMicrobiologyReviews, 2017, 41(3):374-391 .

