白细胞介素12对耐药结核大鼠模型的影响
李昱,杨庚
白细胞介素12对耐药结核大鼠模型的影响
李昱,杨庚
710086 西安,武警工程大学医院卫勤科(李昱),检验科(杨庚)
观察、评价白细胞介素 12(IL-12)对耐药结核大鼠模型的脏器菌落变化和细胞因子水平的影响。
将 60 只 SD 雌性大鼠经尾静脉感染结核分枝杆菌耐利福平株,每只 106CFU,制成耐药结核大鼠模型,随机分为对照组和 IL-12 组,每组 30 只。给予 PBS 或 IL-12 治疗 7 d,ELISA 法检测血清 IFN-γ 水平、流式细胞术行 T 细胞亚群检测和平板计数法测定器官菌落计数,观察治疗后生存率。
IL-12 组大鼠 1 只死亡,肺、肝、脾菌落数分别为(254 ± 98)× 105、(5 ± 2)× 105和(16 ± 4)× 105CFU/ml,IFN-γ(1125 ± 378)pg/ml;PBS 组 10 只死亡,肺、肝、脾菌落数分别为(682 ± 304)× 105、(28 ± 17)× 105和(108 ± 35)× 105CFU/ml,IFN-γ(532 ± 198)pg/ml,两组比较差异有显著性。淋巴细胞亚群测定显示 IL-12 促进 Th1 细胞反应,改变了 Th1/Th2 平衡,两组比较差异有显著性。
IL-12 诱导 IFN-γ 产生,促进 Th1 细胞反应,改变了 Th1/Th2 平衡,对结核分枝杆菌感染大鼠产生保护效应。
白细胞介素 12; 广泛耐药结核; 大鼠; 白细胞介素 18; Th1-Th2 平衡
半个世纪以来,结核病的传染性在全球一直高居前列[1]。随着社会经济和医学技术的发展,耐多药结核病俨然成为结核病控制工作的重中之重,严重威胁人们在结核病控制领域取得的成就。患者在治疗时常常由于出现不良反应而失去继续治疗的信心,治疗依从性大大降低。而耐多药结核病疫情回升已成为威胁全球的公共卫生问题。我国作为全球 27 个耐多药肺结核高负担国家之一,每年新发耐多药结核患者位居全球第二位。
随着结核病学的发展和研究,抗结核药物的开发和应用使得结核病的传染得到了有效控制[2]。异烟肼(INH)和利福平(RFP)是目前医学上抗结核病应用最为广泛的一线药品,是决定结核病治疗效果和治疗方案的关键因素之一[3-5]。然而,由于长期大剂量的药物使用,耐药菌株不断产生。已有研究表明,利福平耐药性结核分枝杆菌往往会同时表现出多种耐药性,因此,研究耐利福平结核病对结核患者的治疗具有重要意义。此外诸多研究还表明,结核分枝杆菌的机体感染可能引起较为强烈的机体免疫反应。其免疫反应主要表现在:T 细胞亚群比例失衡;γ-干扰素(IFN-γ)、白细胞介素 12(IL-12)等细胞因子分泌水平明显上调。这提示这些淋巴细胞的分化和细胞因子分泌水平的变化可能会有助于缓解结核病的发展。
传统的化学药物疗法已颇显弊端,近年来更具针对性的生物免疫因子疗法成为解决这一难题的重要手段[6-8]。IL-12 主要由单核细胞、巨噬细胞等产生,近年来在抗病毒感染、抗寄生虫入侵和抗肿瘤等方面表现出了极佳的疗效[9-11],并日益受到免疫学家的青睐。作为一种具有多种活性的生物免疫应答调变器,IL-12 可以促进 T 细胞增殖活化,诱导 T0 细胞向 Th1 分化,提高 Th1/Th2 的比例;可刺激多种免疫细胞 IFN-γ、IL-2、TNF-α 等细胞因子,进而提高机体杀灭病原微生物的能力[12-14]。本研究旨在通过IL-12 对耐药结核模型大鼠的治疗,探究实验动物脏器菌落、细胞因子水平以及T 淋巴细胞亚群比例的影响,以研究IL-12 对耐利福平结核分枝杆菌感染实验动物的保护作用,以期为结核病的生物免疫因子治疗提供借鉴和支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康 SD 大鼠 60 只,雄性,约 2.5 月龄,体重 300 ~ 350 g,由陕西省医学实验动物中心实验室提供。室温 25 ℃,湿度 50% ~ 80%,SPF 环境下自由饮水和采食。
1.1.2 仪器与试剂 PBS 磷酸缓冲液由美国Hyclone 公司提供;细菌培养箱购自北京金恒祥仪器有限公司;CD3(APC-CD3)、叶绿素荧光蛋白(PreCP)等免疫抗体购自美国 Santa Cruz 公司;ELISA 试剂盒购自南京建成生物有限公司;结核分枝杆菌耐利福平株购于中国疾病预防控制中心结核病防治临床中心。
1.2 方法
1.2.1 建立实验模型及实验分组 将 60 只 SD 大鼠经尾静脉注射结核分枝杆菌耐利福平株,106CFU/只,制成耐药结核大鼠模型。将所有实验动物平均随机分为两组,即对照组和 IL-12 组。对照组大鼠每只腹腔注射 200 μl PBS 磷酸缓冲液,IL-12 组腹腔注射 200 μl 重组大鼠 IL-12(含有 0.2 μg IL-12 的 PBS 溶液),从结核分枝杆菌感染大鼠后当天下午开始,连续腹腔注射 7 d。
1.2.2 ELISA 法检测血清 IFN-γ 水平 连续给药 7 d 后,各实验组分别取 10 只大鼠称重,按照 0.3 ml/100 g 注射 100 g/L 水合氯醛溶液麻醉,眼球抗凝管采血备用。取部分大鼠血液,4000 r/min离心机离心取血清,用 ELISA 试剂盒测定 IFN-γ 含量。
1.2.3 器官菌落计数 取新鲜大鼠肺、肝、脾脏的全份脏器,10 000 r/min 组织匀浆,30 s 制成组织匀浆液。用高温灭菌的 PBS 对实验动物的脏器匀浆液以 1:10 的重量体积比进行稀释,按1 × 102/ml将其接种在结核分枝杆菌平板罗氏培养基上,细菌培养箱培养 23 d 后统计菌落数。
1.2.4 大鼠脏器中结核分枝杆菌 HE染色 将大鼠的胸腹腔剖开用注射器吸取灭菌生理盐水,将针头准确刺入心腔,缓慢注入 10 ml 进行心脏的灌流。将肺、肝、脾取出放入平皿中,置于冰上,用 PBS 缓冲液进行冲洗。取各部分组织固定,经分级系列酒精脱水,纵向切片,厚度约 20 μm。行 HE 及抗酸染色,并观察。
1.2.5 流式细胞术行 T 细胞亚群检测 取新鲜外周静脉血 3 ml,密度梯度离心法分离外周血淋巴细胞,随后离心洗涤两次;将外周血淋巴细胞重悬于 1 ml RPMI1640 培养液中,调整 PBMC 浓度为 1.00 × 106/ml。以加入 50 μg/ml PMA 和 0.75 μg/ml 离子霉素的 RPMI1640 培养液对外周血淋巴细胞进行刺激,置于细胞培养箱中培养 4 h 后,取出离心洗涤,加入 APC-CD3 抗体、PreCP-CD8 抗体表面标记染色细胞,室温避光孵育 15 min,洗涤后破膜,再次洗涤后加入 FITC-IFN-γA 和 PE-IL-4A 抗体。室温避光孵育并洗涤后,用 PBS 磷酸缓冲液重悬细胞,18 ~ 24 h 内流式细胞术检测 Th1 细胞和 Th2 细胞。每份样品计数 20 000 ~ 30 000 个细胞。
1.2.6 观察治疗后生存率 观察剩余的 40 只大鼠的存活情况,以结核杆菌感染当天开始计时,观察 60 d 后各实验组大鼠的生存率。
1.3 统计学处理

2 结果
2.1 血清 IFN-γ 水平检测结果
与对照组大鼠血清中 IFN-γ 水平[(532 ±198)pg/ml]相比,IL-12 组大鼠血清中的 IFN-γ 水平显著提高[(1125 ± 378)pg/ml],差异具有显著性意义(< 0.05)。
2.2 各组器官菌落计数
如表 1 可知,即对照组大鼠 3 个脏器中结核分枝杆菌菌落数均显著高于 IL-12 组,差异具有显著性意义(0.05)。由图1 可见,对照组大鼠3 个脏器可见慢性肉芽肿性炎性改变,对照组较 IL-12 组明显。
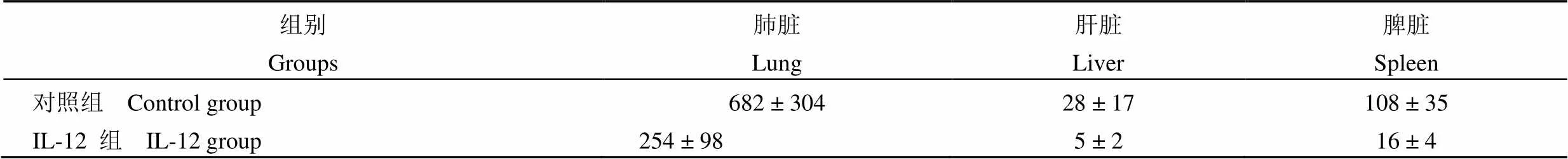
表 1 IL-12 对耐药结核分枝杆菌感染大鼠模型肺脏、肝脏和脾脏中菌落数目的影响(× 105 CFU)
注:与对照组比较,< 0.05。
Note: Compared with control group,< 0.05.
2.3 血液 T 淋巴细胞亚群的变化
如表 2 所示,与对照组相比,IL-12 组大鼠血液中 Th1、Th2、Th1/Th2 细胞百分率均升高(均< 0.05)。
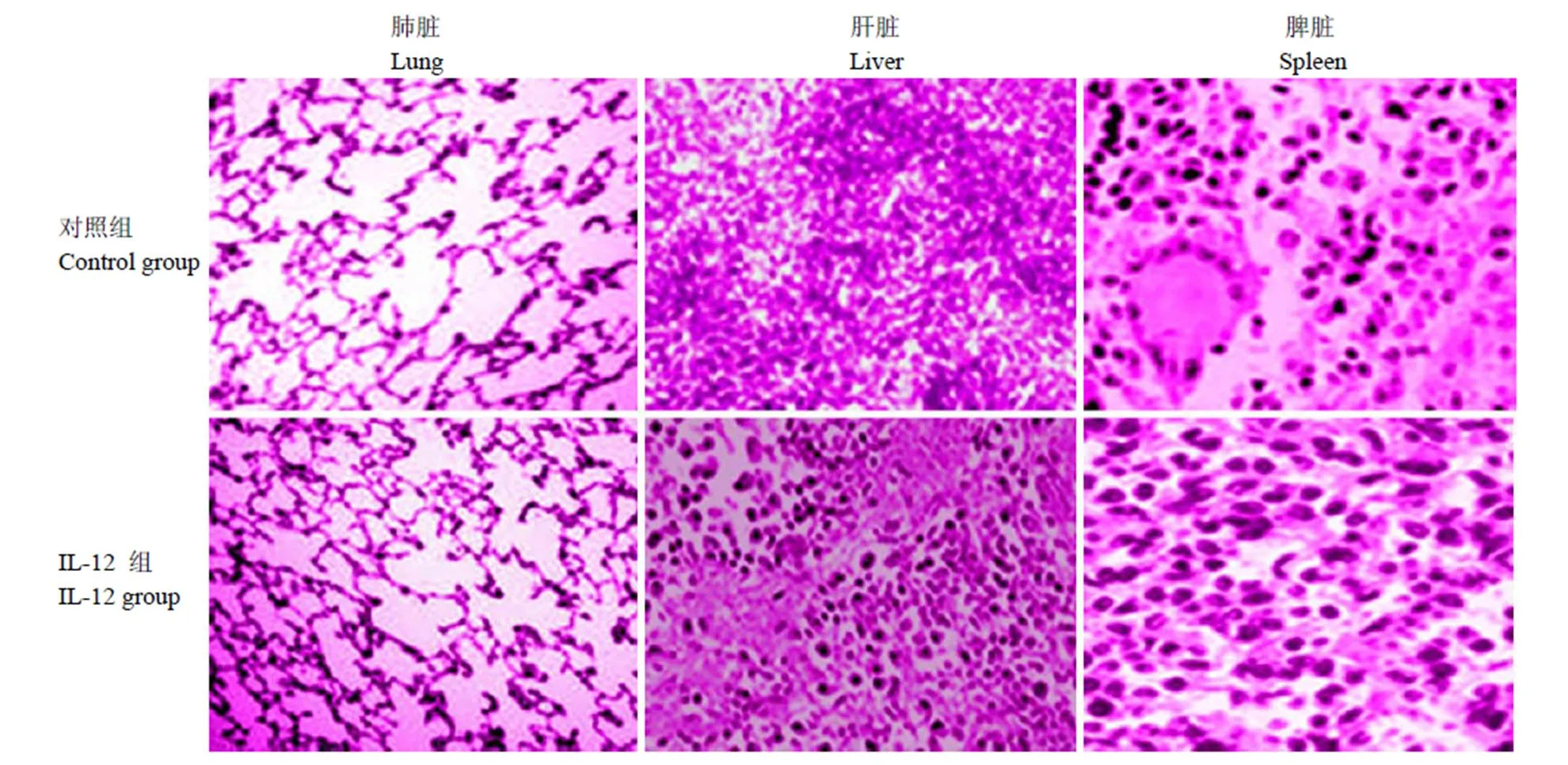
图 1 各组大鼠 3 个脏器中结核分枝杆菌观察(HE × 40)
Figure 1 Observation of mycobacterium tuberculosis in 3 organs of rats in each group (HE × 40)
表 2 IL-12 对耐药结核杆菌模型大鼠血液中=Th1/Th2 的影响(%)
Table 2 The effect of IL-12 on the blood Th1/Th2 in the ratmodel of drug-resistant mycobacterium tuberculosis (%)

组别 GroupsTh1Th2Th1/Th2 对照组 Control group2.73 ± 0.251.78 ± 0.321.69 ± 0.27 IL-12组 IL-12 group5.41 ± 0.46*2.54 ± 0.41*2.64 ± 0.24*
注:*与对照组比较,< 0.05。
Note:*Compared with control group,< 0.05.
2.4 治疗后生存率
腹腔注射大鼠 60 d 后,记录两个实验组共40 只大鼠的存活情况。结果显示,对照组大鼠死亡 10 只,生存率50%,而 IL-12 组大鼠死亡1 只,生存率95%。
3 讨论
IL-12 是机体内一种重要的生物免疫调节剂,常作为联系先天固有免疫和后天获得性免疫的桥梁而发挥特殊的免疫作用[15-17]。IL-12 可以诱导 T 淋巴细胞亚群的免疫应答平衡变化,引起Th1 的增殖和分化并增强 T 细胞的免疫能力,促进 T 淋巴细胞和自然杀伤细胞分泌更高水平的 γ 型干扰素。外源性 IL-12 也常作为免疫调节剂使用[18-20],外源 IL-12 可以诱导淋巴细胞表面 IL-2 受体的高水平表达,而 IL-2 又可以诱导 IL-12 受体的表达增强,进一步提高机体的免疫反应水平。世界卫生组织发布的《2017 全球结核病报告》指出,结核病为全球第九大致死疾病,甚至高于艾滋病。2016 年,全球HIV 阴性人群中有约 130 万结核病患者,HIV 呈阳性人群中有 37.4 万人因结核病死亡。随着利福平等药物的临床应用,耐药性结核分枝杆菌的危害也在逐年增加。因此,寻求具有针对性且安全有效的治疗手段迫在眉睫。
本实验通过尾静脉注射耐药性结核分枝杆菌构建结核病大鼠模型,并腹腔注射外源性IL-12,探讨了外源 IL-12 腹腔注射治疗干预对结核病大鼠的保护效应。结果显示,IL-12 的腹腔干预治疗显著提高了实验大鼠血清中干扰素-γ 的分泌水平,提高了 Th1 淋巴细胞的数目并调节了 Th1/Th2 平衡,显著降低了大鼠脏器中结核分枝杆菌数目;显著延长了实验动物的存活时间并明显降低了大鼠的死亡率。这与张天托等[21]的研究结果较为一致。IL-12 可以诱导 Th0 向 Th1 细胞的分化,促使 T 淋巴细胞亚群平衡的漂移,此系 IL-12 干预治疗结核病的重要机制之一。Th1 是分泌 IFN-γ 细胞因子的重要淋巴细胞,且 IFN-γ 具有选择 Th1 细胞亚群为主要免疫应答的特点。IFN-γ 可正反馈加强自身优势,进一步影响 Th1/Th2 两种亚群之间的平衡。干扰素-γ 是抗结核的重要免疫细胞因子,其可以协同巨噬细胞杀灭机体内的结核分枝杆菌,并且阻止结核菌的扩散[22]。
IL-12 可通过诱导 IFN-γ 分泌,抑制 IL-4 合成,从而调节 Th1/Th2 平衡,对结核分枝杆菌感染患者产生保护性的免疫反应。IL-12 尤其适应细胞免疫功能低下宿主合并结核分枝杆菌感染的状态,其可作为结核免疫调节剂,对结核新疫苗的开发研制具有指导意义。陈敬等[23]对 25 例结核患者的研究表明,IL-12 可以通过诱导 IFN-γ 的分泌,起到抑制 IL-4 合成,从而调节Th1/Th2 平衡的作用,对结核分枝杆菌感染患者产生保护性的免疫反应。IL-12 能够作为结核免疫调节剂,并可用于开发结核新疫苗。因此,人为免疫细胞因子干预治疗可以有效控制结核病,本实验的成功为结核病的免疫治疗开拓了新的途径和思路。
综上所述,我们认为 IL-12 作为免疫细胞因子在自身免疫性疾病等方面的治疗中有着广阔的应用前景。有关IL-12 的治疗时机、最佳剂量、毒副作用和合并使用抗结核药物的相互关系以及疗程、安全性、疗效等问题仍需多中心、大样本、观察期长的临床研究提供更有力的依据,积累更多的临床用药经验,以便更好地指导临床治疗工作。
[1] Pang Y, Xia H, Jiang GL, et al. Genotyping and drug resistance analysis of Mycobacterium tuberculosis from China. Chin Jo Lab Med, 2011, 34(11):1023-1028. (in Chinese)
逄宇, 夏辉, 姜广路, 等. 中国结核分枝杆菌寡核苷酸基因分型及其耐药性分析. 中华检验医学杂志, 2011, 34(11):1023-1028.
[2] Xu LQ, Yu H. Advances in molecular mechanism of mycobacterium tuberculosis drug resistance. Lab Med Clin, 2009, 6(11):887-890. (in Chinese)
徐龙强, 于红. 结核分支杆菌耐药的分子机制研究进展. 检验医学与临床, 2009, 6(11):887-890.
[3] Pang Y, Li GL, Wang YF, et al. Study on the molecular mechanism of mono-rifampicin resistance in Mycobacterium tuberculosis. ChinJ Antituberculosis, 2012, 34(5):275-279. (in Chinese)
逄宇, 李桂莲, 王玉峰, 等. 单耐利福平结核分枝杆菌耐药分子机制研究. 中国防痨杂志, 2012, 34(5):275-279.
[4] Rodríguez AM, Pascutti MF, Maeto C, et al. IL-12 and GM-CSF inDNA/MVA immunizations against HIV-1 CRF12_BF Nef inducedT-cell responses with an enhanced magnitude, breadth and quality. PLoS One, 2012, 7(5):e37801.
[5] Kalams SA, Parker S, Jin X, et al. Safety and immunogenicity of an HIV-1 gag DNA vaccine with or without IL-12 and/or IL-15 plasmid cytokine adjuvant in healthy, HIV-1 uninfected adults. PLoS One, 2012, 7(1):e29231.
[6] Sun BH, Zhao AG. Prospective study of adverse drug reactions monitoring in patients treated with anti-tuberculosis drugs. China Med Herald, 2012, 9(19):155-156. (in Chinese)
孙碧慧, 赵安贵. 常用抗结核药物不良反应监测前瞻性研究. 中国医学导报, 2012, 9(19):155-156.
[7] Shu XR, Wu JJ. Multidrug-resistant tuberculosis and MDR-TB treatment progress. Tianjin Pharm, 2011, 1(23):44-46. (in Chinese)
舒向荣, 吴剑涓. 耐多药结核病和严重耐多药结核治疗进展. 天津药学, 2011, 1(23):44-46.
[8] Li R, Deng F, Fu Y, et al. Pharmacokinetics and pharmacodynamics of subcutaneous injection and intravenous infusion of recombinant human interleukin-12 and recombinant human interleukin-12 combined with hepatitis B surface antigen in cynomolgus monkeys. Pharmacology, 2010, 85(6):319-327.
[9] Fan HY, Wei J. Research progress of IL-12 antagonist in viruses infection. Med Recapitulate, 2014, 20(11):1940-1942. (in Chinese)
范怀艳, 韦嘉. 白细胞介素12在病毒感染中作用的研究进展. 医学综述, 2014, 20(11):1940-1942.
[10] Yang Z, Zhang Q, Xu K, et al. Combined therapy with cytokine-induced killer cells and oncolytic adenovirus expressing IL-12 induce enhanced antitumor activity in liver tumor model. PLoS One, 2012, 7(9):e44802.
[11] Xu R, Liu YM, Guo ZY. Advances in genetic polymorphisms and susceptibility to liver damage induced by antituberculosis drugs. Beijing Med J, 2012, 34(9):846-849. (in Chinese)
许瑞, 刘亚敏, 郭振勇. 基因多态性与抗结核药物致肝损害易感性研究进展. 北京医学, 2012, 34(9):846-849.
[12] Zhang SN, Choi IK, Huang JH, et al. Optimizing DC vaccination by combination with oncolytic adenovirus coexpressing IL-12 and GM-CSF. Mol Ther, 2011, 19(8):1558-1568.
[13] Chiu TL, Peng CW, Wang MJ. Enhanced anti-glioblastoma activity of microglia by AAV2-mediated IL-12 through TRAIL and phagocytosis in vitro. Oncol Rep, 2011, 25(5):1373-1380.
[14] Zhao H, Zhang RB. The research progress of T cells in mycobacterium tuberculosis infection. Med Recapitulate, 2010, 16(18):2740-2742. (in Chinese)
赵辉, 张荣波. T细胞在结核杆菌感染中的研究进展. 医学综述, 2010, 16(18):2740-2742.
[15] Xu Q, Guo L, Gu X, et al. Prevention of colorectal cancer liver metastasis by exploiting liver immunity via chitosan-TPP/ nanoparticles formulated with IL-12. Biomaterials, 2012, 33(15): 3909-3918.
[16] Yuan XL, Lei JP, Li GM, et al. Effect of different pathways and doses of inoculation on establishment of experimental tuberculosis in SD rats. J Chin Antituberculosis Assoc, 2008, 30(2):90-95, insert1-insert2. (in Chinese)
袁小亮, 雷建平, 李光明, 等. 不同感染途径和接种菌量对建立SD大鼠结核菌感染模型的影响. 中国防痨杂志, 2008, 30(2):90-95, 插1-插2.
[17] Wang RT, Chen CM, Zhu XH, et al. Experimental research on the detection of MTB IFN-γ in vitro release by ELISA. Chin J Health Lab Technol, 2011, 21(5):1163-1164, 1166. (in Chinese)
王荣堂, 陈春梅, 朱晓华, 等. 体外释放酶联免疫法检测结核杆菌γ-干扰素的实验研究. 中国卫生检验杂志, 2011, 21(5):1163-1164, 1166.
[18] Zhang GM, Jia H, Hou SH, et al. Establishment of a double antibody sandwich ELISA against bovine IFN-γ and its preliminary application in clinical diagnosis of bovine tuberculosis. Acta Veterinaria Et Zootechnica Sinica, 2014, 45(10):1693-1698. (in Chinese)
张改梅, 贾红, 侯绍华, 等. 检测牛IFN-γ双抗体夹心ELISA的建立及在牛结核病诊断上的初步应用. 畜牧兽医学报, 2014, 45(10): 1693-1698.
[19] Liu N, Su MX, Yang YH. The clinical value of T lymphocyte subsets analysis with flow cytometry in bronchoalveolar lavage fluid of patients with pulmonary tuberculosis. J Kunming Med Univ, 2016, 37(2):103-106. (in Chinese)
刘宁, 苏明霞, 杨永辉, 等. 流式细胞检测肺结核患者肺泡灌洗液T淋巴细胞亚群评价. 昆明医科大学学报, 2016, 37(2):103-106.
[20] Zhou J, Xiao ZL, Tian K, et al. The value of combined detection of CRP and T-lymphocyte subsets in BALF in differential diagnosis of lung cancer and tuberculosis. Med J Natl Defending Forces Southwest China, 2014, 24(8):835-837. (in Chinese)
周菁, 肖贞良, 田坤, 等. 检测BALF中CRP和T细胞亚群对肺结核与肺癌鉴别诊断的意义. 西南国防医药, 2014, 24(8):835-837.
[21] Zhang TT, Kawakami K, Tang YC, et al. Therapeutic effect of interleukin-12 on murine infection with Mycobacterium tuberculosis through modulating Th1 and Th2 cytokine balance. Chin J Tuberc Respir Dis, 2000, 23(6):358-360. (in Chinese)
张天托, 川上和义, 唐英春, 等. 白细胞介素12调节小鼠Th1/Th2的抗结核分支杆菌感染研究. 中华结核和呼吸杂志, 2000, 23(6): 358-360.
[22] Wang Y, Wang HY, Liu HL, et al.Role of cytokine IL-12 in pathogenesis of asthma in mice. Chin J Ind Med, 2015, 28(3):171-174. (in Chinese)
王袁, 王红阳, 刘和亮, 等. 细胞因子IL-12在哮喘小鼠发病机制中的作用. 中国工业医学杂志, 2015, 28(3):171-174.
[23] Chen J, Dong DQ, Yang YH, et al. The effect of interleukin-12 on the production of Th1 and Th2 cytokines by peripheral blood mononuclear cells from patients with tuberculosis. Chin J Tuberc Respir Dis, 2002, 25(5):292-295. (in Chinese)
陈敬, 董德琼, 杨渝浩, 等. 白细胞介素12对结核病患者TH1/TH2平衡的影响. 中华结核和呼吸杂志, 2002, 25(5):292-295.
The effect of interleukin-12 on rat model of drug-resistant tuberculosis
LI Yu, YANG Geng
Author Affiliations: Medical Services Section (LI Yu), Laboratory (YANG Geng), People's Armed Police Hospital Engineering University, 710086 Xi’an, China
To observe and evaluate the effect of interleukin-12 (IL-12) on the changes of total bacterial count in viscera and cytokine levels of rats with resistant tuberculosis.
The 60 resistant tuberculosis animal models were made by tail vein injection of rifampin-resistant tuberculosis (106CFU/rat). The 60 rats were divided into control group (n = 30) and IL-12 group (n = 30). The rats in control group and IL-12 group were intraperitoneally injected into PBS or IL-12 treatment for 7 d. The IFN-γ levels in the plasma of rats were measured by the ELISAmethod. The subpopulations of T lymphocytes were determined by the flow cytometry. The bacteria counts were measured by the plant colony counting method, and the survival rates of rats were tested after the treatment.
In the IL-12 group, one rat was dead. In this group, the bacteria colony counts in the lung, liver and spleen were (254 ± 98) × 105, (5 ± 2) × 105, and (16 ± 4) × 105CFU/ml, respectively. The IFN-γ level of IL-12 treatment group was (1125 ± 378) pg/ml. In the control group, ten rats were died, the bacteria colony counts in the three organs were (682 ± 304) × 105, (28 ± 17) × 105, and (108 ± 35) × 105CFU/ml, respectively. The IFN-γ concentration of rats in IL-12 group was (532 ± 198) pg/ml. The significant difference was observed in both experimental groups. The results of the T lymphocytes subpopulations showed that the treatment of IL-12 significantly improved the Th1 cell-mediated immunity and adjusted the balance of Th1/Th2.
The treatment of IL-12 possesses a protective effect on rats of rifampin-resistant tuberculosis by triggering the IFN-γ production, improving the Th1 cell immunity, and changing the balance of Th1/Th2.
Interleukin-12; Extensively drug-resistant tuberculosis; Rats; Interleukin-18; Th1-Th2 balance
LI Yu, Email: baidongqwe@163.com
武警工程大学基础研究基金(WJY201620)
李昱,Email:baidongqwe@163.com
10.3969/j.issn.1673-713X.2018.01.011
2017-11-06

