绵羊iPS细胞诱导及转录组学分析
张译元,郭延华,王聪慧,唐 红,南海艳,王立民,周 平
(1.新疆农垦科学院畜牧兽医研究所/省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆石河子 832000;2.陕西西安市阎良区动物疾病预防控制中心,西安 710000)
0 引 言
【研究意义】在绵羊的遗传育种与品种改良进程中,快速、定向选育具有某些优质性状的新品种或品系,是绵羊种质资源保护和绵羊生产的关键环节。以往转基因技术克隆成功率低,且获得的转基因后代个体往往存在繁殖障碍。诱导性多能干细胞(induced pluripotent stem cells, iPS)。iPS细胞是一类具有无限增殖能力[1]和多向分化潜能[2]的细胞类群,可塑性强,能够高效实现外源基因的导入、敲除和改造。iPS最初是由日本科学家山中伸弥(Takahashi, Yamanaka, 2006)通过病毒载体将OCT4(Octamer binding transcription factor 4)、SOX2(SRY(sex determining region Y)-box2)、KLF4(Kruppel-like factor 4)、c-Myc(Myelocytomatosis oncogene)这四个转录因子转入小鼠成纤维细胞中,使之重编程构建出来的。如果把iPS细胞诱导技术和基因打靶技术、细胞核移植技术、嵌合体技术相结合,对绵羊的转基因育种和生产意义重大。【前人研究进展】迄今为止,有关人(Homosapiens)[3,4]、小鼠(Musmusculus)[5]、大鼠(Rattusnorvegicus)[6]、猴子(Macacamulatta)[7]、猪(Susscrofa)[8]、绵羊(Ovisaries)[9]的iPS细胞系构建均已有研究报道。2006年Takahashi和Yamanaka将小鼠成纤维细胞诱导为多能干细胞,并通过四倍体囊胚嵌合技术,进一步证实小鼠iPS细胞能够发育成完整的个体[10]。2007年Thomson和Yamanaka两实验室又分别将人体皮肤成纤维细胞诱导成iPS细胞[3,4]。在绵羊iPS细胞系研究方面,Bao等[5]和Liu等[11]先后获得了能形成畸胎瘤和拟胚体并具有正常核型的绵羊iPS细胞系。Liu等[11]将绵羊iPS细胞注射到二倍体或四倍体胚胎中,形成了内细胞团的部分结构,但未形成嵌合体。Sartori等[12]将Oct4、Sox2、 Klf4、c-Myc四个转录因子(OSKM)转入绵羊成纤维细胞,形成了具有正常核型的iPS细胞,并形成畸胎瘤和拟胚体;将获得的iPS细胞植入到胚胎后,生出了嵌合体小羊。【本研究切入点】绵羊iPSCs诱导技术取得了阶段性进展,但绵羊iPSCs形态特征及鉴定方法并无统一的标准,诱导方法及培养条件也形色各异。目前,绵羊iPS细胞的诱导基本采用病毒载体转染的方式,存在一定安全风险;其次,由于物种不同,多能性基因、信号通路也会不同[13],重编程因子的选择对iPS细胞的诱导效率会造成一定影响。因此,如何提高诱导效率、降低致癌率和抑制iPSCs的分化是目前绵羊iPSCs急需解决的问题。试验以绵羊成纤维细胞为基础材料,通过电转,导入五种转录因子OCT4、SOX2、KLF4、l-Myc、Lin28,构建绵羊iPS细胞系;在此基础上结合转录组测序技术重点对不同诱导时期的iPS细胞进行高通量测序。【拟解决的关键问题】分析相关因子在诱导不同阶段的表达变化,研究差异基因所涉及的信号通路,选择更为适合绵羊iPS细胞诱导的重编程因子,为丰富绵羊iPS建系机制提供一定的基础资料,为绵羊转基因育种及动物种质资源保护提供理论依据。
1 材料与方法
1.1 材 料
试验动物来自新疆农垦科学院转基因种羊场。
重组质粒:PCXLE-Hoct3/4-shp53(Oct3/4)、PCXLE-hSK(Sox2, Klf4)、PCXLE-hul(l-Myc, lin28)等,均购自美国Addgene公司,Lonza 4D-Nucleofector电转仪与P2电转染试剂盒购自德国LONZA公司;反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser购自TAKARA公司;碱性磷酸酶试剂盒、免疫荧光染色所用抗体购自上海斯丹赛生物技术有限公司,DAPI 染料购自ROCHE公司。
1.2 方 法
1.2.1 绵羊iPS细胞的诱导及培养
离心收集对数期的绵羊成纤维细胞,细胞密度至5×106mL-1;添加20 μL电转液和重组质粒,重悬细胞,选择EH-100程序进行电转;静置10 min,加入80 μL细胞培养液(10%胎牛血清的DMEM培养基),混匀后全部移至培养皿,37℃、5%CO2条件下培养9~12 h后更换培养液,36 h时观察细胞的贴壁情况。3 d后换成iPS细胞培养液(20% KSR、0.1 mol/L β-巯基乙醇、0.02 mol/L谷氨酰胺、0.01 mol/L非必需氨基酸(NEAA)、0.005 g/L b FGF的Knockout DMEM培养基),培养液中添加终浓度为0.05 mg/L VC,隔天换液。
1.2.2 碱性磷酸酶(AP)染色
用4%(M/V)多聚甲醛固定iPS克隆样细胞,15 min后弃固定液,PBS洗涤2次,滴加染色液(现配现用),待染色液掩盖孔底,室温避光15~20 min,弃染色液,PBS洗涤1次,显微镜下观测染色结果。
1.2.3 免疫荧光染色
4%(W/V)多聚甲醛固定细胞20 min,1×PBS浸洗2次,无水乙醇浸泡2次,每次20 min;1×PBS浸洗2次,吸水纸吸干PBS,在细胞上滴加5%(W/V)牛血清白蛋白(BSA),37℃封闭30 min;吸水纸吸掉封闭液,不洗,滴加足够量稀释好的一抗,4℃过夜孵育,PBST浸洗细胞3次,每次5 min;吸水纸吸干细胞上多余液体后滴加稀释好的荧光二抗,37℃孵育1 h,PBST浸洗细胞3次,每次5 min。复染核:滴加1 μg/mL的DAPI避光孵育5 min, PBST 5 min×3次洗去多余DAPI,吸水纸吸去细胞上残余液体,然后在荧光显微镜下观察采集图像。
1.2.4 实时荧光定量PCR检测
提取细胞的总RNA,反转录成cDNA,以绵羊GAPDH基因(F: ACGGGAAGCTCACTGGCATGG R: GCCAGCCCCAGCATCGAAG)为靶标,对Oct4(F: TACACTGTACTCTTCGGTCCCATT R: AGCATCATTGAACTTCACCTTCCC)、Sox2(F:TACGGTAGGAGCTTTGCAGAAAGT R: TGCACGTTTGCAACTGTCCTAAAT)、Nanog(F:CAAGTATTTCAGTTCCCAGCAGCA R: TGCACGTTTGCAACTGTCCTAAAT)基因使用LightCycler© 480实时荧光定量PCR仪(Roche公司)进行荧光定量PCR检测,反应条件:95℃预变性5 min,95℃变性15 s,60℃退火30 s,72℃延伸1 min,反应进行45个循环,65℃再延伸1 min并在这一过程中进行熔解曲线分析。基因的相对表达量采用2-△△Ct法计算,使用GraphPad Prism 5进行数据统计处理分析。
1.2.5 转录组测序
分别收集诱导0、10、20和30 d的细胞,由北京华诺生物科技有限公司提供测序服务,使用Illumina HiseqTM2000平台测序。
1.3 数据处理
测序所得数据称之为raw reads,将其测序接头序列末端质量低于20 bp的碱基、含N比率大于5%和质量较低的reads去除,去除后的数据称为clean reads。对clean reads使用Trinity软件进行De novo组装得到Unigene,然后使用Tgicl软件对这些序列进行同源转录本聚类,得到最终的Unigene。之后将Unigene序列与蛋白数据库NR、Swiss-Prot、KEGG和COG作blastx比对(evalue<0.000 01),获得相应的注释信息。针对Unigene表达量的计算,使用FPKM法(Fragments Per kb per Million fragments)。以FDR≤ 0.001且倍数差异在2倍以上的基因定义为差异表达基因,将所得到的差异基因GO数据库和KEGG数据库富集进行注释与统计分析。
2 结果与分析
2.1 形态学鉴定
该细胞排列紧密,呈圆形或不规则集落状生长,形似鸟巢,在集落边缘可见部分分化细胞。碱性磷酸酶染色(AP)呈强阳性。图1
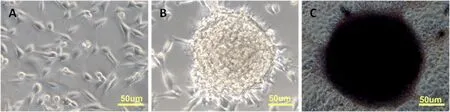
图1 A:绵羊成纤维细胞;B:绵羊iPSC克隆;C:绵羊iPSC克隆碱性磷酸酶染色
Fig.1 A: sheep fibroblast cells; B: OiPSC colony ; C: AP staining
2.2 免疫荧光检测
对诱导培养的绵羊iPS细胞进行细胞免疫荧光检测,结果显示克隆多能性蛋白SOX2、OCT4和表面标记SSEA-1呈阳性。图2
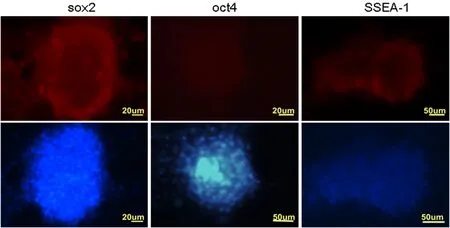
图2 绵羊iPS细胞蛋白免疫荧光检测
Fig.2 The immune fluorescence identification of OiPSC
2.3 实时荧光定量RT-PCR
随机选取4个绵羊iPS细胞,以绵羊成纤维细胞为阴性对照,实时荧光定量PCR检测OCT4、SOX2、Nanog的表达水平。结果显示:绵羊iPS细胞中多能性基因的表达水平极显著高于成纤维细胞(P< 0.01)。图3

图3 OiPSCs的Oct4、Sox2、Nanog基因的qPCR检测
Fig.3 The quantitative PCR analysis of Oct4, Sox2 and Nanog in OiPSCs
2.4 转录组测序
2.4.1 不同诱导时期细胞RNA-Seq转录组数据拼接
统计诱导0、10、20和30 d Unigenes数量,分别获得55 795、47 416、48 069和48 927条Unigenes序列。
2.4.2 不同诱导时期差异基因的表达
不同诱导时期差异基因的表达水平(图4A-B)。以诱导0 d的细胞作为对照,诱导30 d的细胞共获得9 465个差异表达基因,其中上调基因6 987个,下调基因2 478个。利用Blast2GO软件,按照参与的细胞组分(Cellular Component)、分子功能(Molecular Function)和生物过程(Biological Process)(图4C)对30和0 d的差异基因进行分类注释。经比对共有5 374个差异基因对比到GO数据上。在参与的生物学过程中,细胞过程(cellular process)所占比例最多,占12.6%,其次为单体过程(single-organism process)和代谢过程(metabolic process),分别占10.5%和10.4%;在细胞成分(cell component)分类中,细胞组分(cell part)所占比例最多,占18.7%,其次是细胞(cell)和细胞器(organelle),分别占18.6%和15.9%;在分子功能(molecular function)分类中,分子绑定(binding)所占比例最高,占49.3%,其次是催化活性(catalytic activity)和酶调节活性(enzyme regulator activity),分别占25.6%和4.5%。图4
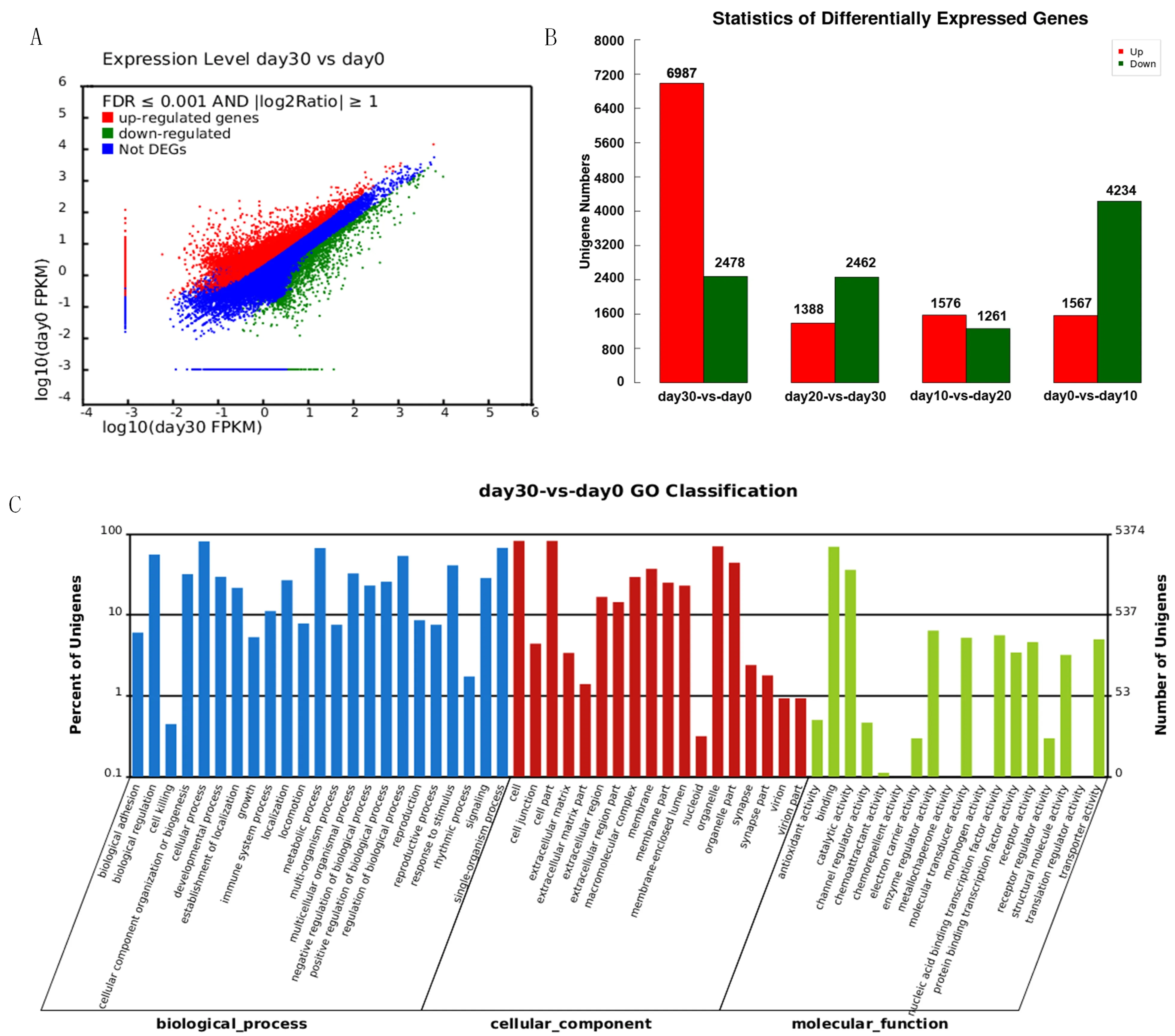
图4 30和0 d细胞中基因差异表达
Fig.4 Different UniGene expression profiles between 30 cell and 0 d cell
2.4.3 部分干性相关基因诱导0和30 d表达量差异性比较
利用Cufflinks软件,计算每个Unigene在各个样本中的表达量FPKM值,FPKM法能消除基因长度和测序量差异对计算基因表达的影响,计算得到的基因差异表达量可直接用于比较不同样本间的基因表达差异。l-Myc、Sox2、Oct4在绵羊成纤维细胞重编程过程中基因表达量均呈上调趋势,其中,l-myc和Sox2基因表达量差异性显著,Oct4基因差异不显著。图5
2.4.4 诱导30和0 d细胞差异表达基因的KEGG富集
将已注释的差异表达基因与KEGG数据库进行比对,共有5 773个基因比对到KEGG数据库,共涉及到259条通路,其中富集通路最多的是剪接体通路,其次是卵母细胞成熟分裂通路和P53信号通路,说明这三条通路在绵羊多潜能干细胞诱导过程中最活跃。表1
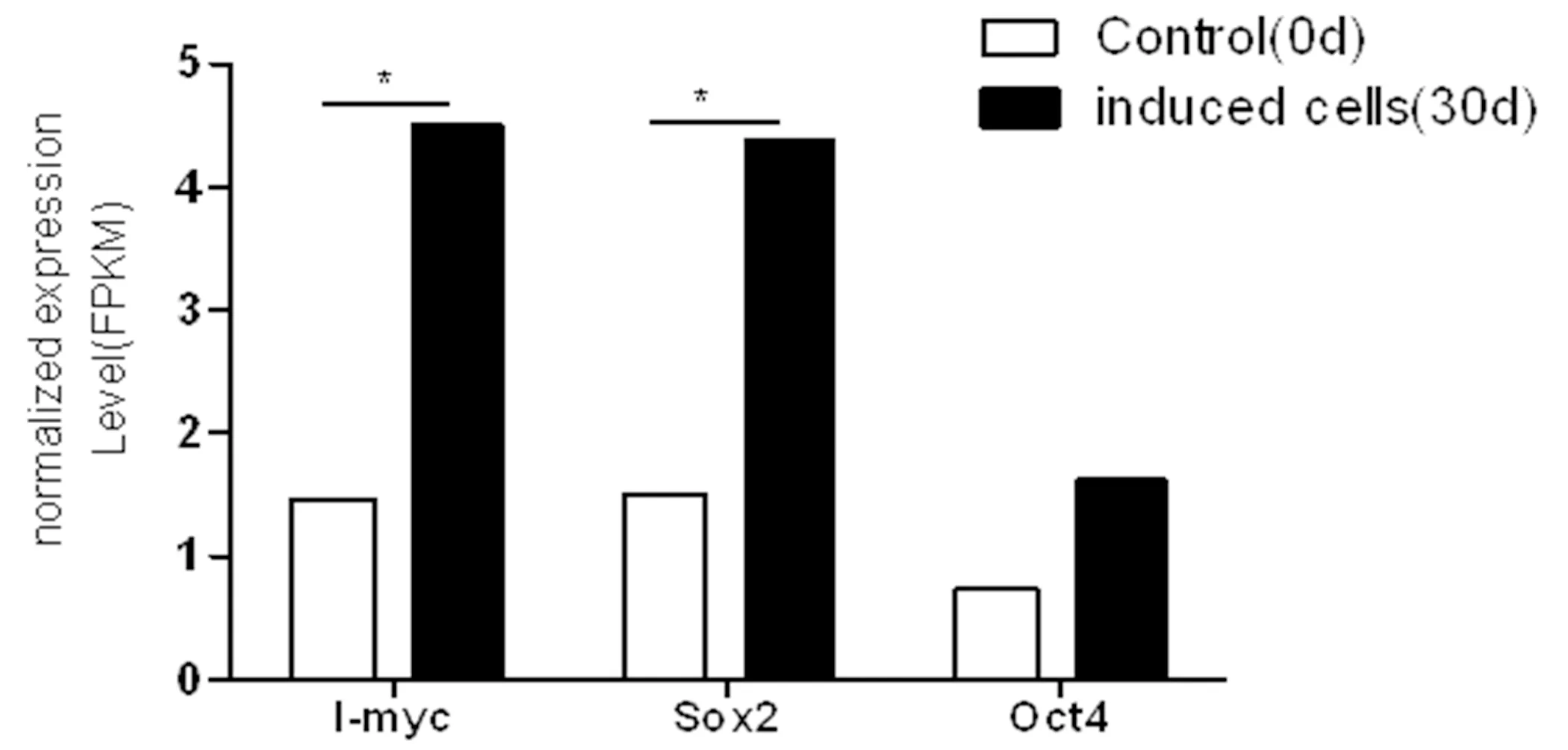
图5 RNA-Seq分析绵羊成纤维细胞重编程的基因表达
Fig.5 Gene analyses in reprogramming of Ovis fibroblasts using RNA-seq表1 差异表达基因KEGG代谢途径分类
Table 1 KEGG classification of differentially expressed genes
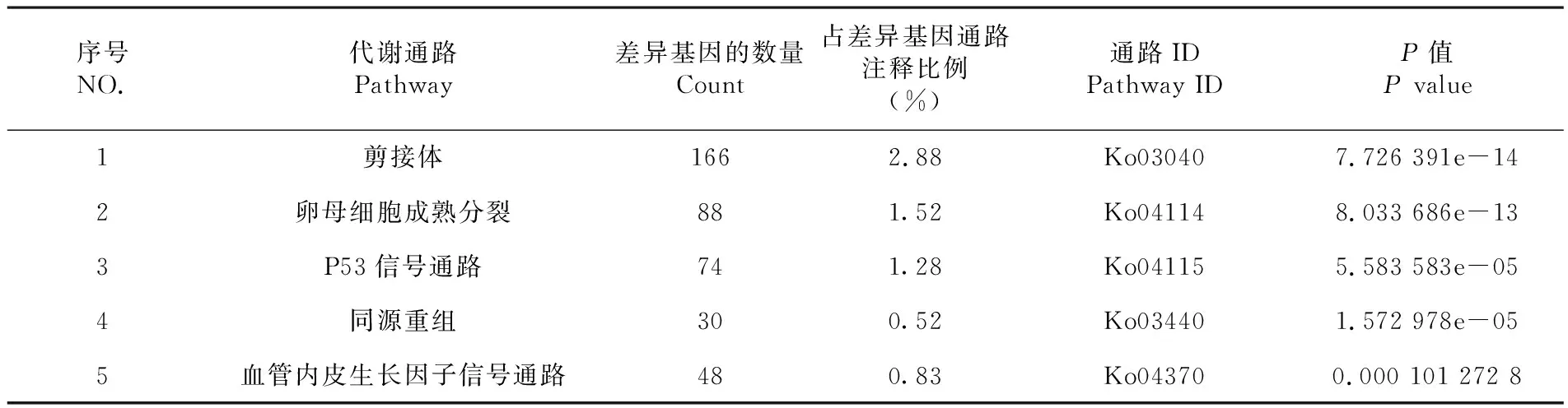
序号NO.代谢通路Pathway差异基因的数量Count占差异基因通路注释比例(%)通路IDPathway IDP值P value1剪接体1662.88Ko030407.726 391e-142卵母细胞成熟分裂881.52Ko041148.033 686e-133P53信号通路741.28Ko041155.583 583e-054同源重组300.52Ko034401.572 978e-055血管内皮生长因子信号通路480.83Ko043700.000 101 272 8
3 讨 论
诱导性多能干细胞是经体细胞重编程形成的,但重编程的分子调控机制至今尚未完全清楚,尤其是在大动物的iPSCs的研究略有滞后。在绵羊iPSCs诱导技术方面最为成熟的是iPS细胞诱导分化成三胚层,并且能检测到iPSCs的标记。Li等[14]成功将慢病毒介导的Oct4、Sox2、Klf4、c-Myc四因子转入绵羊成纤维细胞,培养14 d后出现类似人胚胎干细胞样形态的克隆,经碱性磷酸酶染色、畸胎瘤三胚层组织学鉴定均证明是干细胞。Bao等[5]将四环素诱导慢病毒系统介导的Oct4、Sox2、Klf4、c-Myc四个转录因子,同时补充添加Nanog、Lin28、SV40 large T和人端粒酶反转录酶hTERT转染至胎羊成纤维细胞,用Knockout血清替代品(Knockout serum replacement, KSR)代替胎牛血清培养细胞,11~20 d出现克隆,形态类似小鼠胚胎干细胞,经碱性磷酸酶染色,Oct4、 Sox2、 Nanog、SSEA-1、Tra1-60以及Tra-1-81这些标记物染色都为阳性。另有研究表明,尽管Oct4、Sox2、Klf4、c-Myc这四个限定因子具有高度的保守性,但iPSCs的形态、增殖能力和相应的分子机制存在种属差异。譬如,人和小鼠的iPS细胞形态和自我更新的分子机制具有明显的差异。与人和小鼠相比,绵羊iPSCs较难获得[9]。一般认为,Oct3/4 和 Sox2 是诱导多能性所需的核心因子,而Klf4 和 c-Myc则能提高Oct3/4和Sox2的诱导效率[15]。Esteban等[16]认为,四因子诱导法中,去除c-Myc可获得较好的iPS,建系成功率也显著提高。Nakagawa等[17]研究表明,去除c-Myc诱导iPS细胞时,诱导时间较长且效率较低,但特异性强。这说明c-Myc的作用可能是促进细胞的增殖而不是细胞的重编程[18]。研究采用Oct4、Sox2、Klf4、l-Myc、lin28五因子诱导法,结果显示,在其他条件一致的情况下,选择质粒浓度质量比1∶1∶1时,更有利于形成AP+克隆[19]。常见的质粒转染方法包含病毒载体法、脂质体法和电转法等,鉴于电转保护剂既能降低细胞死亡率,又能提高电转效率,试验采取电转法并且使用KSR代替胎牛血清培养绵羊iPS细胞,细胞传代明显增强,可传至第4代。
细胞表面标记能有效识别和区分多能干细胞,是鉴定多能干细胞重要的工具。SSEAs作为一种表面标记物被广泛用于监测胚胎干细胞的多能性,它包括SSEA-1、SSEA-3、SSEA-4。 Dattena等[20]报道,绵羊胚胎干细胞表达SSEA-1、SSEA-3、SSEA-4,Li等[14]研究显示,绵羊iPSCs只表达Oct4、Sox2、Nanog、SSEA-4,未表达SSEA-1和SSEA-3;而试验显示绵羊iPSCs只表达Sox2、Oct4、SSEA-1,部分转染的基因表现沉默。这可能与不同实验室采用的诱导方案及诱导产生iPSCs重编程程度有关,也有可能是其他一些因素影响了细胞状态,尚需进一步的试验佐证。Chin等[21]通过比较不同代数人iPS细胞和人胚胎干细胞的基因表达图谱,结果显示,代数高的人iPS细胞(第54~61代)比代数低的人iPS细胞(第5~9代)更接近于胚胎干细胞。由此推测,持续培养的过程对完善iPS细胞重编程意义重大。从试验实时荧光定量PCR检测结果来看,绵羊iPS细胞中多能性基因Oct4,Sox2,Nanog的表达量均显著增高,和RNA-Seq的结果相一致,初步证实了获得的iPS细胞具有一定的多能性。
比较绵羊iPSCs和用于重编程的成纤维细胞之间基因的表达情况对于了解绵羊多能性干细胞诱导的分子过程是非常重要的。高通量转录组测序技术为揭示研究动、植物基因表达及调控发挥了重要作用,尤其在侧重了解动物发育某一方面的基因表达,挖掘差异表达基因备受关注[22]。研究利用高通量测序技术构建了诱导0、10、20和30 d细胞的转录组文库,获得了大量基因信息。重点针对诱导30和0 d的阳性细胞测序结果分析发现,筛选到的差异表达基因显著富集在卵母细胞成熟分裂、同源重组、P53信号通路等通路上。其中,显著富集的P53信号通路参与细胞的生长调控过程。已有研究证实,P53基因的突变和删除与一系列肿瘤相关联;P53基因编码的蛋白在细胞损伤的情况下可诱导激活下游的P21蛋白,触发DNA修复和细胞凋亡,P53~P21蛋白通路能抑制干细胞的分化和增殖,因此,抑制P53基因的表达可提高重编程的效率[23]。研究表明,敲除P53蛋白的和ASF1A蛋白能够提高绵羊肾脏细胞重编程的效率[24]。有趣的是,不同于成熟细胞中的低水平P53,这种蛋白在ESC和iPSCs中呈高丰度表达[25]。研究结果进一步证实了绵羊成纤维细胞在向着iPSC转变。
4 结 论
利用电转法将Oct4、Sox2、Klf4、l-Myc、Lin28五个转录因子导入至绵羊成纤维细胞中,经AP染色、细胞免疫荧光及荧光定量PCR检测,细胞均呈阳性,且表达Oct4、Sox2、SSEA-1等多种ES细胞的多能性标记基因;转录组测序结果获得了大量的绵羊候选功能基因,经生物信息学分析发现,差异表达基因主要涉及细胞组分、分子结合、细胞过程等诸多生理生化过程,同时参与多种信号通路,其中,P53信号通路显著富集,且其在干细胞增殖方面起着非常重要的作用,获得了绵羊诱导性多能干细胞。
参考文献(References)
[1] Molofsky, A. V. , Pardal, R. , & Morrison, S. J. . (2004). Diverse mechanisms regulate stem cell self-renewal.CurrentOpinioninCellBiology, 16(6): 700-707.
[2] Odorico, J. S. , Kaufman, D. S. , & Thomson, J. A. (2001). Multilineage differentiation from human embryonic stem cell lines.StemCells, 19(3): 193-204.
[3] Takahashi, K., Tanabe, K., Ohnuki, M., Ichisaka, T., Tomoda, K. & Yamanaka, S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors.Cell, 131(5): 861-872,
[4] Yu, J. , Vodyanik, M. A. , Smuga-Otto, K. , Antosiewicz-Bourget, J. , Frane, J. L. , & Tian, S. , et al. (2008). Induced pluripotent stem cell lines derived from human somatic cells.Obstetrical&GynecologicalSurvey, 63(3): 154-155.
[5] Zhao, X. Y. , Li, W. , Lv, Z. , Liu, L. , Tong, M. , & Hai, T. , et al. (2010). Ips cells produce viable mice through tetraploid complementation.ChinaBasicScience,461(7260): 86-90.
[6] Liao, J. , Cui, C. , Chen, S. , Ren, J. , Chen, J. , & Gao, Y. , et al. (2009). Generation of induced pluripotent stem cell lines from adult rat cells.CellStemCell, 4(1):11-15.
[7] Liu H; Zhu F; Yong J; Zhang P; Hou P; Li H; Jiang W; Cai J; Liu M; Cui K; Qu X; Xiang T; Lu D; Chi X; Gao G; Ji W; Ding M; Deng H. (2008). Generation of induced pluripotent stem cells from adult rhesus monkey fibroblasts.CellStemCell, 3(6): 587-590.
[8] Wu, Z. , Chen, J. , Ren, J. , Bao, L. , Liao, J. , & Cui, C. , et al. (2009). Generation of pig induced pluripotent stem cells with a drug-inducible system.JournalofMolecularCellBiology, 1(1): 46-54.
[9] Bao, L. , He, L. , Chen, J. , Wu, Z. , Liao, J. , & Rao, L. , et al. (2011). Reprogramming of ovine adult fibroblasts to pluripotency via drug-inducible expression of defined factors.CellResearch, 21(4): 600-608.
[10] Takahashi, K., Okita, K., Nakagawa, M., & Yamanaka, S. (2006). Induction of pluripotent stem cells from fibroblast cultures.NatureProtocols, 51(15): 3,081-3,089.
[11] Liu, J. , Balehosur, D. , Murray, B. , Kelly, J. M. , Sumer, H. , & Verma, P. J. . (2012). Generation and characterization of reprogrammed sheep induced pluripotent stem cells.Theriogenology, 77(2): 338-346.
[12] Sartori, C. , Didomenico, A. I. , Thomson, A. J. , Milne, E. , & Whitelaw, C. B. A. . (2012). Ovine-induced pluripotent stem cells can contribute to chimeric lambs.CellularReprogramming, 14(1): 8-19.
[13]王峰,刘灿,潘传英.大家畜诱导多潜能干细胞(iPSCs)研究进展[J]. 农业生物技术学报,2014, 22(10): 1 286-1 297.
WANG Feng, LIU Can, PAN Chuang-ying. (2014). Progress of induced pluripotent stem cells (iPSCs) of big domestic animals [J].JournalofAgriculturalBiotechnology, 22(10):1,286-1,297. (in Chinese)
[14] Li, Y. , Cang, M. , Lee, A. S. , Zhang, K. , & Liu, D. . (2011). Reprogramming of sheep fibroblasts into pluripotency under a drug-inducible expression of mouse-derived defined factors.PLOSONE, 6(1): e15947:1-8.
[15]陈倩,史庆华. iPS细胞的遗传安全性[J]. 遗传,2012, 34(3): 260-268.
CHEN Qian, SHI Qing-hua. (2012). The genetic safety of induced pluripotent stem (ips) cells[J].Hereditas, 34(3): 260-268. (in Chinese)
[16] Esteban, M. A. , Wang, T. , Qin, B. M. , Yang, J. Y. , Qin, D. J. , & Cai, J. L. , et al. (2010). Vitamin c enhances the generation of mouse and human induced pluripotent stem cells.CellStemCell, 6(1): 71-79.
[17] Nakagawa, M. , Koyanagi, M. , Tanabe, K. , Takahashi, K. , Ichisaka, T. , & Aoi, T. , et al. (2008). Generation of induced pluripotent stem cells without myc from mouse and human fibroblasts.NatureBiotechnology, 26(1): 101-106.
[18] Pera, M. F. , & Hasegawa, K. . (2008). Simpler and safer cell reprogramming.NatureBiotechnology, 26(1): 59-60.
[19]王聪慧,赵帅,张译元,等.电穿孔转染制备绵羊诱导多潜能干细胞条件的优化[J].西北农业学报,2015, 24(9): 9-15.
WANG Cong-hui, ZHAO Shuai, ZHANG Yi-yuan, et al. (2015). Optimization of inducing pluripotent stem cells by 0; electroporation in sheep [J].ActaAgriculturaeBoreali-occidentalissinica, 24(9): 9-15. (in Chinese)
[20] Dattena, M. , Chessa, B. , Lacerenza, D. , Accardo, C. , & Cappai, P. . (2006). Isolation, culture, and characterization of embryonic cell lines from vitrified sheep blastocysts.MolecularReproductionandDevelopment, 73(1): 31-39.
[21] Chin, M. H. , Mason, M. J. , Xie, W. , Volinia, S. , Singer, M. , & Peterson, C. , et al. (2009). Induced pluripotent stem cells and embryonic stem cells are distinguished by gene expression signatures.CellStemCell, 5(1):111-123.
[22]朱志明,陈红萍,林如龙,等.山麻鸭开产期和产蛋高峰期卵巢组织转录组分析[J].中国农业科学,2016, 49(5): 998-1 007.
ZHU Zhi-ming, CHEN Hong-ping, LIN Ru-long, et al. (2016). Transcriptome analysis of ovary tissue in early laying period and egg laying peak period of Shanma ducks [J].ScientiaAgriculturaSinica, 49(5): 998-1,007. (in Chinese)
[23] Bao, X. , Wu, H. , Zhu, X. , Guo, X. , Hutchins, A. P. , & Luo, Z. , et al. (2015). The p53-induced lincrna-p21 derails somatic cell reprogramming by sustaining h3k9me3 and cpg methylation at pluripotency gene promoters.CellResearch, 25(1): 80-92.
[24] Shi H, Fu Q, Li G, Ren Y, Hu S, Ni W, Guo F, Shi M, Meng L, Zhang H, Qiao J, Guo Z, Chen C. (2015). Roles of p53 and asf1a in the reprogramming of sheep kidney cells to pluripotent cells.CellularReprogramming, 17(6): 441-452.
[25] Lee, D. F. , Su, J. , Ang, Y. S. , Carvajalvergara, X. , Muleronavarro, S. , & Pereira, C. F. , et al. (2012). Regulation of embryonic and induced pluripotency by aurora kinase-p53 signaling.CellStemCell, 11(2): 179-194.

