浅析基础有机合成路线设计的几点策略
吴春峰+高晓莹+邓善银


摘要:有机合成路线的设计对学生的思维能力提出了较高的要求,是中学化学教与学的难点。学生对合成路线的设计往往缺乏相应的合成策略。结合近几年高考合成路线设计类相关试题讨论了有机合成中反应次序先后、官能团的保护以及化学选择性等常见策略,并介绍了相关策略涉及的原理和规律,以期为高中教学提供有益的参考。
关键词:路线设计;反应次序;官能团保护;化学选择性
文章编号:1005-6629(2017)8-0084-07
中图分类号:G633.8
文献标识码:B
有机合成路线的设计是利用有机化学反应将简单、易得的有机化合物制备成较复杂的有机化合物的过程,该设计对学生的思维能力提出了较高的要求。教学实践发现,学生在解决该类问题时信心不足,效果不尽如人意。存在的主要问题是:没有真正领会有机物的结构与性质之间的关系,对题给信息“生搬硬套”;没有综合考虑整个合成计划,而是着眼单一的某一步转化或反应,缺乏相应的合成策略。设计具体有机物的合成路线时,需要从多个角度加以分析评价,本文拟从反应次序的先后、官能团的保护以及化学反应的选择性三个常见的角度作简要讨论。
1反应次序的先后
有机物分子中基团之间存在相互影响,先引入的基团在反应活性、定位效应上最好有利于其他基团的引入,因而基团的引入自然有先后之分。中学阶段的有机合成路线的设计比较青睐于考查苯环上引入基团的先后顺序,但教材的编写基本上沿用实验感知式和事实陈述式的叙事法,鲜有对结构与性质关系的深入探究。这种基于表象和经验的归纳学习,学生往往“不求甚解”,无法习得“结构决定性质”的学科思想,那么如何理解并正確运用该次序规则呢?
其实上述规则在选修5《有机化学基础》中已有渗透,譬如-CH3、-OH和-NO2对苯环上相关位置的反应活性的影响,但学生并未理解并加以灵活运用。基于学生学过物质结构的相关知识,譬如共用电子对的偏移(共价键的极性)、苯环内大π键(共轭π键)等概念,不妨适时、适当、适度地介绍与中学阶段相关度较高的规律和原理,帮助学生深入把握有机化学的内涵,让学生借助电子效应(诱导效应、共轭效应等)来理解有机物的结构与性质之间的关系,从而合理安排反应的次序。
诱导效应是指分子中由于原子的电负性不同,导致成键电子云沿原子链向电负性大的方向移动,导致化学键极化,且渐远渐弱。若一个分子中同时存在诱导效应与共轭效应,通常共轭效应占主导作用。此处简要分析共轭效应如何影响基团的取代定位。
共轭效应适用于分子内的共轭体系,即至少存在三个或三个以上的相邻、共面的原子,这些原子具有一组相互平行且垂直于原子所在平面的p轨道,可以侧面重叠形成多中心、多电子的大π键。共轭体系类型有以下两种(见图1、图2)。参与共轭体系的电子,并不是局限在某两个原子之
[评价]路线1:题给信息没能很好吸收利用,或对题给信息解读不够。该路线中的苯甲酸的硝化不符合定位规则,因为羧基是间位定位基团,所以硝基不易取代在羧基的邻位。
路线2:邻甲基苯胺的氧化不符合题给信息,因为氨基容易被酸性高锰酸钾溶液氧化(见已知条件)而破坏分子结构,所以氧化之前应该先用醋酸酐反应,起保护氨基的作用。
路线3:由于超共轭效应,甲基为邻、对位取代基。甲苯硝化时,硝基进入甲基的邻位,对位异构体可分离出去,再还原得邻甲基苯胺,在用酸性高锰酸钾溶液氧化甲基之前,用醋酸酐进行酰化,合成路线合理。
通过以上分析可知,有机合成路线的步骤设计不可随心所欲,需要在理解基团间相互影响的基础上考虑基团引入的先后顺序,合理安排转化步骤,有时还要考虑对特定基团进行保护,如果无法通过调整步骤来防止基团的氧化时,此时需要考虑用相应的保护基来实现特定官能团的保护。
2官能团的保护
针对官能团的保护,需弄清为什么需要保护。当有机物中有多个官能团,我们只需选择对其中某个官能团进行操作(反应),其他官能团保持不变,此时需对其他官能团进行保护。官能团保护就是将不希望反应的官能团与相关试剂作用转变成随后反应中安定的衍生物。用于官能团保护的基团称为保护基。合适的保护基具有以下特点:①对被保护基团容易接上进行保护;②保护基能承受其他官能团希望进行的反应,即其他官能团反应时它是比较稳定的;③实现保护后,最终保护基要容易脱除,即去除保护基使用的试剂不影响分子结构的其他部分。中学阶段,我们熟知一些基团易被氧化,譬如醛基、羟基、酚羟基、氨基和碳碳双键等,这些基团在遇到氧化剂时容易导致分子结构的破坏;某些基团容易被还原,譬如醛基等,也需要根据要求进行保护。常见的保护基团、具体实例及其保护方法见表2。
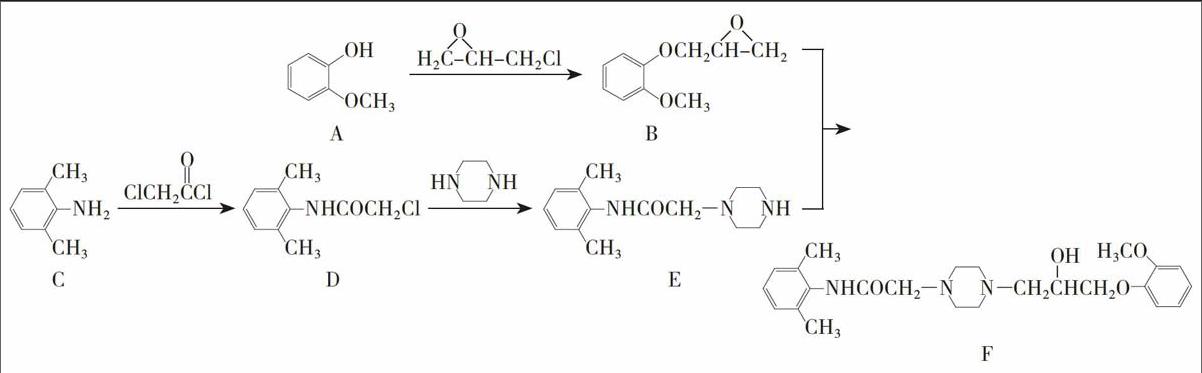
[评价]路线1:因为氨基容易被氧化(见已知条件),所以对甲基苯胺硝化时分子结构可能被硝酸氧化而破坏,应对氨基加以保护(见表2),可利用题给试剂(CH3Co)2o与氨基反应(见已知合成路线G→H)将其转化为酰胺基进行保护,最后再水解(见已知条件)脱除酰胺基保护基,恢复氨基。
路线2:甲基在苯环上为邻、对位定位基团,硝基可以取代在甲基的对位,但是硝基在苯环上为间位定位基团,观察第二个硝基的取代的位置既不符合甲基的定位也不符合硝基的定位。考察第二步转化,两个硝基均能被还原,选择性不是很好。
路线3:第一步转化符合甲基的定位效应,第二步模仿已知合成路线中的第⑤步还原硝基为氨基,接着与醋酸酐反应保护氨基,硝化时由于酰胺基对苯环的共轭效应强于甲基对苯环的超共轭效应,优先考虑酰胺基对苯环的定位(见表1),所以硝基上到酰胺的邻位(对位已占甲基),当然通过对比产物和中间体的结构,也要求硝基取代在酰胺基的邻位,最后水解恢复氨基,路线设计合理。endprint
通过以上分析可知,将官能团的保护以信息的形式融入已知的合成路线中,让学生辨认出来,再将该知识用来设计某种新物质的合成路线,对学生提取并应用关键信息提出了较高要求。了解官能团保护的一般思维模型,将有助于问题的解决,即先将需要保护的基团保护起来,然后实现其他基团的转化,最终将被保护的基团还原出来。若遇到路线2中两个基团均能反应,但实际只需让一个基团反应,这涉及化学选择性问题。
3化学选择性
若分子中存在两个不同活性的反应基团,则活性高的基团优先反应;若分子中某基团与试剂反应时,第一次反应的产物还能与该试剂继续发生反应,这样就可能连续发生两次原理相同的反应,但合成时只需该基团反应一次,这些情况都涉及到化学选择性问题。
[评价]路線1和路线2的共同之处是间二甲苯硝化时硝基取代在两个甲基的邻位(见表1),相当于定位效应得到强化,接着还原硝基为氨基。两条路线的差异是氯代乙酰氯与氨基反应的产物结构不同。氯代乙酰氯的结构与性质之间的关系如何呢?分析已知合成路线的步骤C→D、D→E,发现氯代乙酰氯两端的氯原子均能与氨基(亚氨基)发生取代,再看步骤C→D,氯代乙酰氯与氨基反应优先发生酰氯的取代,通过对比得小酰氯部分的反应活性更强,优先取代反应。因此路线1第三步转化不合理,路线2合理。
路线3:氯代乙酰氯与二乙胺反应时,虽然产物的形式符合要求,但是原则上行不通,因为不符合化学选择性。建议利用切断法进行逆向分析时,将酰胺键最后切断,正向合成时优先合成。
[评价]利用提供的信息,大部分学生认为二乙胺的合成路线只能如此。果真如此吗?少数学生提出了质疑:既然卤代烃(溴乙烷)能与氨在一次取代的基础上再进行二次取代得到合成产物二乙胺,若按照该反应的原理应该还能进行第三次取代得到三乙胺,导致产物二乙胺中混有较多杂质且产率低,该合成路线不太合理需改进。课后经过教研组讨论,觉得少数学生提出的问题是合理的,合成该胺类物质更加常见的方法是通过和羰基化合物反应来代替烷基化,相应的转化为通过羰基化合物反应生成亚胺,再进行还原胺化,这是制备胺类化合物的较为重要的方法。该路线设计过程中,少数学生能认清原理、据理力争值得肯定。可以相信的是,若给出进一步的拓展信息,学生利用基础原料,辅以相应策略尝试合成二乙胺,应该是水到渠成。
4结语
有机合成往往需要综合考虑多种策略才能形成合理的路线设让平时教学过程中可以选择一些典型物质的合成作为实例,辅以相关原理、规律的适度介绍,鼓励学生设计并展示多种可能的合成路线,引导学生开展基于证据、原理的分析评价和逻辑推理,在质疑、反思中得到合理结论,使学生在不知不觉中理解基础有机合成路线设计的一些策略与方法。endprint

