文心兰不育花粉粒形态观察及相关基因克隆与表达分析
高玉莹,时 欢,王 云,陈 燕,赖钟雄,叶开温,2*
(1 福建农林大学 园艺植物生物工程研究所,福州 350002;2 台湾大学 植物科学研究所,台北 10617)
植物雄性不育是指雌雄同花植物中雄性器官由于受到种种内在和外界因素的影响发育不全,花药皱缩,花粉空瘪,无法散粉的现象。植物雄性不育现象在自然界中普遍存在,据Kaul[1]统计,已在43个科162个属320种植物中发现617例天然的或种间杂交来源的雄性不育,这个数字还在日益增加[2]。植物雄性不育促使植物发生杂交的几率大大增加,能够促进植物有性生殖时遗传物质的重组,在植物物种进化上有重要意义[3]。植物雄性不育是作物杂种优势利用的重要途径,因此对花药及花粉发育的深入研究具有重要的应用价值[3]。细胞学研究是连接雄性不育分子水平和个体调控育性的重要环节[4],其目的在于探讨花粉发生败育的时期和方式以及花粉败育与花药中间层、绒毡层细胞的异常行为的关系等[5],对全面认识植物花粉败育机理有很大帮助[6]。Laser等[7]曾对多种细胞核雄性不育类型花粉败育时期进行统计,发现花粉败育在造孢细胞(sporogenous cell,SC)至二核花粉各时期均有可能发生,其中有70% 的植物败育时期发生在四分体以后。由于控制花粉或小孢子发育的基因各不相同,导致植物的败育时期和方式也会因基因表达时期和作用机制的不同而各异[5],将细胞学观察与分子生物学研究相结合,有利于从整体上了解植物雄性不育的原因及机理。
越来越多的研究表明,一些转录因子能够调控花药发育相关基因的表达,是功能性花粉形成的关键因子[8]。其中,MYB类转录因子在花粉发育过程中起非常重要的调节作用,现已经挖掘出很多与植物雄性不育相关的MYB转录因子,它们能通过各种形式调节花药发育进而影响植物育性[9]。整个转录调控中如果出现MYB转录因子表达异常,不管过量表达还是基因沉默,都会影响花药的正常发育,产生畸形、空瘪的花粉,导致部分或完全雄性不育的发生[8]。如拟南芥的AtMYB103(之后称为MYB80)能够在绒毡层中特异表达,抑制该基因的表达能够让绒毡层的细胞程序性死亡(programmed cell death,PCD)提前,导致绒毡层无法完成正常的生理功能,而导致不育[10];水稻中也发现了AtMYB103的直系同源基因OsMYB103,该基因的敲除导致绒毡层发育缺陷,成熟花药中大多数小孢子缺乏外壁,植物育性降低[11];拟南芥中AtMYB108突变体植物的花药开裂延迟,花粉活力降低。与野生型相比,AtMYB108突变体植物的繁殖能力明显下降,这些表型在MYB108MYB24双突变体中都被加剧,并且雄蕊的花丝也明显变短[12]。总之,MYB转录因子在花粉的发育过程中具有重要的调控作用,涉及了花粉形成过程中各个关键步骤,包括绒毡层的代谢、花粉细胞壁的形成、单核小孢子的分化等[8],研究MYB转录因子与花粉败育的关系是研究植物雄性不育分子机制的主要方向。
文心兰(Oncidiumspp)为兰科文心兰属的植物,是热带和亚热带气生兰类。‘柠檬绿’作为台湾地区极受欢迎的文心兰切花品种,具有花粉败育和自交不亲和特性。相关研究人员长期观察发现,‘柠檬绿’在自然条件下无法进行天然授粉而获得果荚,并且经多方努力进行杂交试验,仍无法利用其育出新品种。本研究对文心兰品种‘巧克力’(可育)和‘柠檬绿’(雄性不育)的花粉团和花粉粒进行对比研究,并对MYB转录因子家族成员OnMYB106基因进行克隆和表达分析,为进一步探讨‘柠檬绿’花粉败育产生的原因及分子机理提供理论基础。
1 材料和方法
1.1 试验材料
文心兰品种‘柠檬绿’(雄性不育)及‘巧克力’(可育)均由台湾大学植物科学研究所提供。2018年4月取‘柠檬绿’和‘巧克力’的花粉团和花粉粒置于固定液(酒精∶醋酸=3∶1)中保存备用;取‘柠檬绿’和‘巧克力’的花粉团、‘柠檬绿’的不同组织部位(根、假鳞茎、上端叶、下端叶和花)及不同花期(花苞期、绽口期、半开放期、盛开前期、盛开期)的花为试验材料,在液氮中速冻后存于-80 ℃冰箱中保存备用。
1.2 方 法
1.2.1花粉团的解剖显微镜观察和扫描电镜观察于盛花期采集上述材料的花蕾(同一温度处理),用镊子将采集后新鲜花蕾的花粉团剥离下来于解剖显微镜下观察,并选择典型花粉团拍照。同时,将‘巧克力’和‘柠檬绿’的部分花粉团置于培养皿中,干燥处理约24 h后,将花粉团粘于铝金属的胶膜上,经过处理后喷金镀膜(日立SCB Ⅱ离子溅射仪),在扫描电子显微镜下(日立S-3400N)观察花粉团外观形态、饱满程度及表面纹饰并拍照。
1.2.2花粉粒的显微观察和扫描电镜观察从花梗抽出至花苞形成,分别采集上述材料的花粉,并浸入固定液(酒精∶醋酸=3∶1)中,10 h后在电子显微镜下观察花粉粒的细胞形态。同时,取上述材料的部分成熟花粉团放于已加入少许双蒸水的离心管中,静置15 min,待花粉团吸水胀破,低速离心,用移液枪吸取上清液于圆形的盖玻片上,干燥处理10 h后,将圆形盖玻片粘在铝金属台上进行喷金镀膜(日立SCB Ⅱ离子溅射仪),在扫描电子显微镜(日立S-3400N型)下观察并拍照。
1.2.3‘柠檬绿’总RNA与基因组DNA提取采用Trizol up RNA试剂盒(全式金生物技术有限公司)提取‘柠檬绿’花器官总RNA。采用改良的CTAB法进行‘柠檬绿’基因组DNA的提取。用超微量分光光度计(Thermo Electron Corp)检测RNA及DNA样品浓度,并用1% 琼脂糖凝胶电泳检测其质量和纯度。cDNA第一链的合成使用SMARTTMRACEA cDNA Amplification Kit反转录试剂盒(TaKaRa),具体操作见说明书。
1.2.4OnMYB106基因克隆以‘柠檬绿’转录组数据中TR28980_c0_g1_i2的核酸序列作为克隆OnMYB106的参考序列,通过对序列进行筛选、拼接,发现TR28980_c0_g1_i2具有完整的ORF序列。在TR28980_c0_g1_i2的ORF两端设计拼接验证引物OnMYB106-ORF-F和OnMYB106-ORF-R(表1),分别以‘柠檬绿’花器官的cDNA和gDNA为模版,进行PCR扩增。利用GSDS 2.0在线软件将OnMYB106 的cDNA与gDNA序列进行比对。试验中所使用的引物委托上海铂尚生物技术有限公司进行合成。
PCR反应体系为25 μL,其中cDNA模版1 μL,上下游引物各1 μL,Dream TaqTMGreen PCR Master Mix(2X) 12.5 μL,ddH2O 9.5 μL。反应程序为94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,34个循环后72 ℃继续延伸5 min,并用1%琼脂糖凝胶电泳分离PCR产物,将获得的目的片段切胶回收,经过TA克隆后挑选阳性克隆子送至铂尚生物技术有限公司测序。
1.2.5生物信息学分析利用DNAMAN6.0软件分析核苷酸序列;采用ExPASy ProtParam(http://web.expasy.org/protparam/)进行翻译蛋白的理化性质预测;利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质的信号肽;通过NCBI Conserved Domain Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白保守结构域预测;采用MEGA4.0软件中的Neighbor-Joining(NJ)构建MYB106蛋白的系统发育树,并利用DNAMAN6.0软件进行多序列比对。
1.2.6qRT-PCR分析根据已克隆的‘柠檬绿’OnMYB106的cDNA序列,利用DNAMAN6.0软件设计特异引物q-OnMYB106-F和q-OnMYB106-R(表1),以Actin为内参基因进行qRT-PCR反应。反应在罗氏LightCycler 480仪器中进行,反应体系为20 μL,其中SYBR Ⅱ 10 μL,cDNA模版1 μL,上下引物各0.6 μL,ddH2O 7.8 μL。反应程序:95℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,40次循环。利用Excel软件将所得的数据进行统计和分析,根据2-ΔΔCt计算基因相对表达量,利用SPASS软件进行方差分析。

表1 实验所用引物序列
2 结果与分析
2.1 花粉团形态观察
‘巧克力’和‘柠檬绿’的花粉团形态和大小无明显差异,外观形态都呈椭圆形(图1)。相对来说,‘巧克力’花粉团形态更加饱满(图1,B、C),含有较多花粉;花粉团的外观结构呈蜂巢状,构成花粉团的单粒花粉形态饱满、排列紧密(图1,D)。而‘柠檬绿’的花粉团形态比较干瘪、皱缩(图1,F、G),花粉含量少;花粉团表面不平整,由形状不规则的花粉堆积而成,构成花粉团的单粒花粉形状不规则,比较干瘪(图1,H)。
2.2 花粉粒形态观察
‘巧克力’花粉细胞近圆形,大小规则,形状正常(图2,A、B);‘柠檬绿’花粉细胞大小和形状不规则,细胞质高度液泡化(图2,C、D)。‘巧克力’和‘柠檬绿’花粉粒均比较小(10~25 μm)。其中,‘巧克力’花粉粒在未失水情况下近球形(图3,A~C),赤道面观为圆形(图3,A),极面观为三裂圆形(图3,C),具有三孔沟,外壁比较光滑无饰纹。‘柠檬绿’成熟的花粉团中无明显花粉粒,在所观察到的极少数花粉粒中包含长球形花粉粒(图3,D、F)、极度变形的花粉粒(图3,E、H),长球形花粉粒的赤道面观为稍宽的长椭圆形(图3,D、F),极面观为三裂圆形(图3,G),未见到孔沟,花粉壁发育不连续,有很多孔洞(并非萌发孔;图3,D~H)。

A、E分别为‘巧克力’和 ‘柠檬绿’花器官;B、C为‘巧克力’花粉团;D为‘柠檬绿’花粉团表面 形态的扫描电镜图;F、G为‘柠檬绿’花粉团;H为‘柠檬绿’花粉团的表面形态扫描电镜图图1 花粉团的解剖显微观察和扫描电镜观察结果 A, E represent Oncidium Sharry Baby and Oncidium Honey Angel flower, respectively; B,C represent Oncidium Sharry Baby pollen cluster; D represents SEM image of the pollen cluster surface morphology from Oncidium Sharry Baby; F,G represent Oncidium Honey Angel pollen cluste; H represents SEM image of the pollen cluster surface morphology from Oncidium Honey AngelFig.1 Observation of pollen cluster surface by dissecting microscope and scanning electronic microscopy

A、B为‘巧克力’花粉粒;C、D为‘柠檬绿’花粉粒;箭头所指空泡化细胞图2 花粉粒的显微观察结果 A,B represent Oncidium Sharry Baby pollen grains; C,D represent Oncidium Honey Angel pollen grains; Arrow denotes vacuolated cellsFig.2 Microscopic observation of pollen grains

A~C为‘巧克力’花粉粒;D~H为‘柠檬绿’花粉粒;箭头所指萌发孔沟图3 花粉粒的扫描电镜观察结果 A-C represent Oncidium Sharry Baby pollen grains; D-H represent Oncidium Honey Angel pollen grains; Arrow indicates the germination holesFig.3 Microscopic observation of pollen grains by scanning electron microscopy
2.3 OnMYB106基因克隆与生物信息学分析
以‘柠檬绿’花器官的cDNA为模板,进行OnMYB106基因的PCR扩增(图4,A)。切胶、回收和测序结果显示,‘柠檬绿’MYB106基因编码区序列长819 bp,与转录组数据库中TR28980_c0_g1_i2的序列一致,将该基因命名为OnMYB106。以‘柠檬绿’花器官的DNA为模板,PCR扩增OnMYB106的gDNA序列,扩增获得1 005 bp目标条带(图4,B)。将OnMYB106基因的cDNA序列与gDNA序列进行在线比对,结果显示该基因含有2个内含子和3个外显子。
利用DNAMAN6.0软件分析发现,OnMYB106基因编码区长819 bp,编码272个氨基酸(图5)。利用ExPASy ProtParam分析OnMYB106蛋白的理化性质显示,该蛋白分子式C1349H2130N398392S12,等电点9.70,属于碱性蛋白。Signal P3.0 Server信号肽预测结果显示,OnMYB106不含信号肽,属于非分泌蛋白。NCBI Conserved Domin Search鉴定结果显示,OnMYB106属于SANT 超家族,具有2个连续的MYB DNA-binding结构域,为典型的R2R3-MYB转录因子(图6)。

A. cDNA;B. gDNA;M. DL2000;箭头所指目标条带图4 OnMYB106基因的PCR扩增 A. cDNA; B. gDNA;M. DL2000; Arrows show the target bandsFig.4 PCR amplification of OnMYB106
2.4 OnMYB106进化树分析与氨基酸序列比对
为验证‘柠檬绿’OnMYB106蛋白与其他植物MYB106蛋白的进化关系,从NCBI中筛选出18个物种的MYB106蛋白序列,采用MEGA 6.0软件构建系统进化树(图7)OnMYB106与高粱(XP_002444392.1)、水稻(LOC_Os08g33660.1)和二穗短柄草(XP_024316299.1)聚在同一分支,进化上更为保守。将OnMYB106与其同一进化分支上的同源基因进行氨基酸序列比对(图8),结果表明它们之间的相似性为70.68%,同源区域主要集中在N端R2R3 DNA结合结构域,在C端保守性不高。

ATG为启始密码子;TAA为终止密码子图5 OnMYB106基因编码序列和推测的氨基酸序列 ATG represents initiation codon; TAA represents stop codonFig.5 Coding sequence and deduced amino acid sequence of OnMYB106

图6 OnMYB106保守结构域的预测结果Fig.6 Prediction of OnMYB106 conserved domains
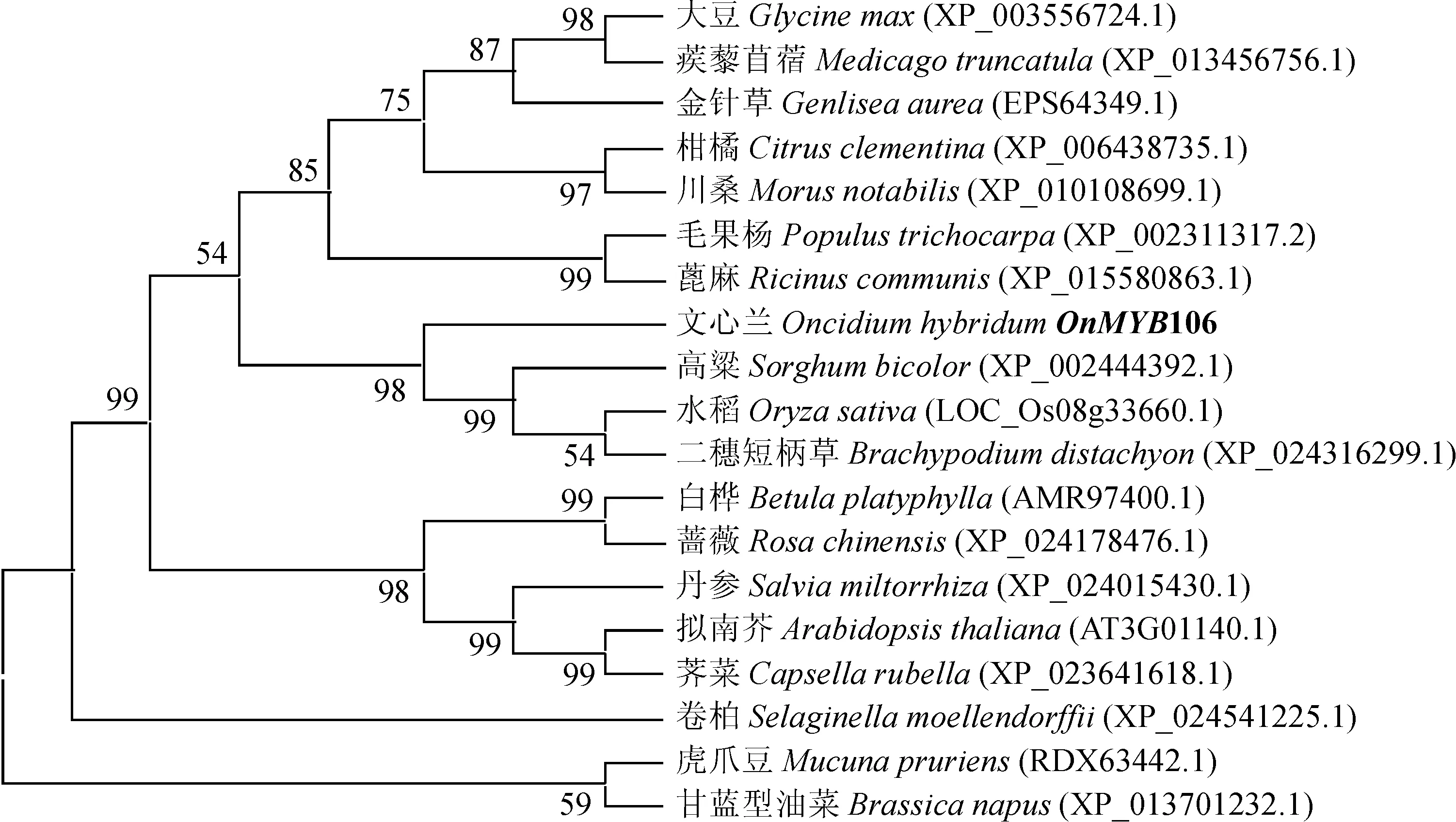
节点上的数值表示Bootstrap重复1 000次的置信度,括号内为蛋白登录号图7 不同植物中MYB106进化树分析 Numbers on branches indicate the percentage of 1 000 bootstrap replicates that support the adjacent node and the accession number of each protein is given in the bracketFig.7 Phylogenetic analysis of deduced amino acid sequences of MYB106 proteins from different plants

OnMY106. 文心兰;OsMYB106. 水稻(LOC_Os08g33660.1);BdMYB106. 二穗短柄草(XP_024316299.1); SbMYB106. 高粱(XP_002444392.1)图8 OnMYB106与其他物种MYB106氨基酸序列比对 OnMYB106. O. hybridum; OsMYB106. Oryza sativa (LOC Os08g33660.1); BdMYB106. Brachypodium distachyon (XP 024316299.1); SbMYB106. Brachypodium distachyon (XP 024316299.1)Fig.8 Amino acid sequence alignment of OnMYB106 and MYB106s of other species
2.5 OnMYB106在‘柠檬绿’和‘巧克力’花粉团中的表达分析
‘柠檬绿’和‘巧克力’同一组织(花粉团)中的定量结果表明(图9),OnMYB106在‘柠檬绿’中表达量极低(0.11),‘巧克力’的表达量约是‘柠檬绿’的88倍,二者之间差异达到极显著水平。
2.6 OnMYB106在‘柠檬绿’不同组织器官中的表达分析
以Actin为内参基因,对‘柠檬绿’不同组织部位(根、假鳞茎、上端叶、下端叶、花)进行了组织特异性分析。qRT-PCR结果表明(图10),OnMYB106在不同器官中均有表达,具有明显的组织差异性;OnMYB106在花中的表达量最高,假鳞茎中的表达量最低,花中的表达量约为假鳞茎中的49倍,叶片和根表达次之;OnMYB106在花中的表达量与假鳞茎、根、叶片之间有显著性差异(P< 0.05),说明OnMYB106可能主要调控‘柠檬绿’花器官的生长发育。

不同小写字母表示差异显著P < 0.05,下同图9 ‘柠檬绿’和‘巧克力’花粉团的OnMYB106 基因表达 Different letters mean significant difference at 0.05 level, the same as belowFig.9 Expression analysis of OnMYB106 gene in pollen clusters of Oncidium Honey Angel and Oncidium Sharry Baby
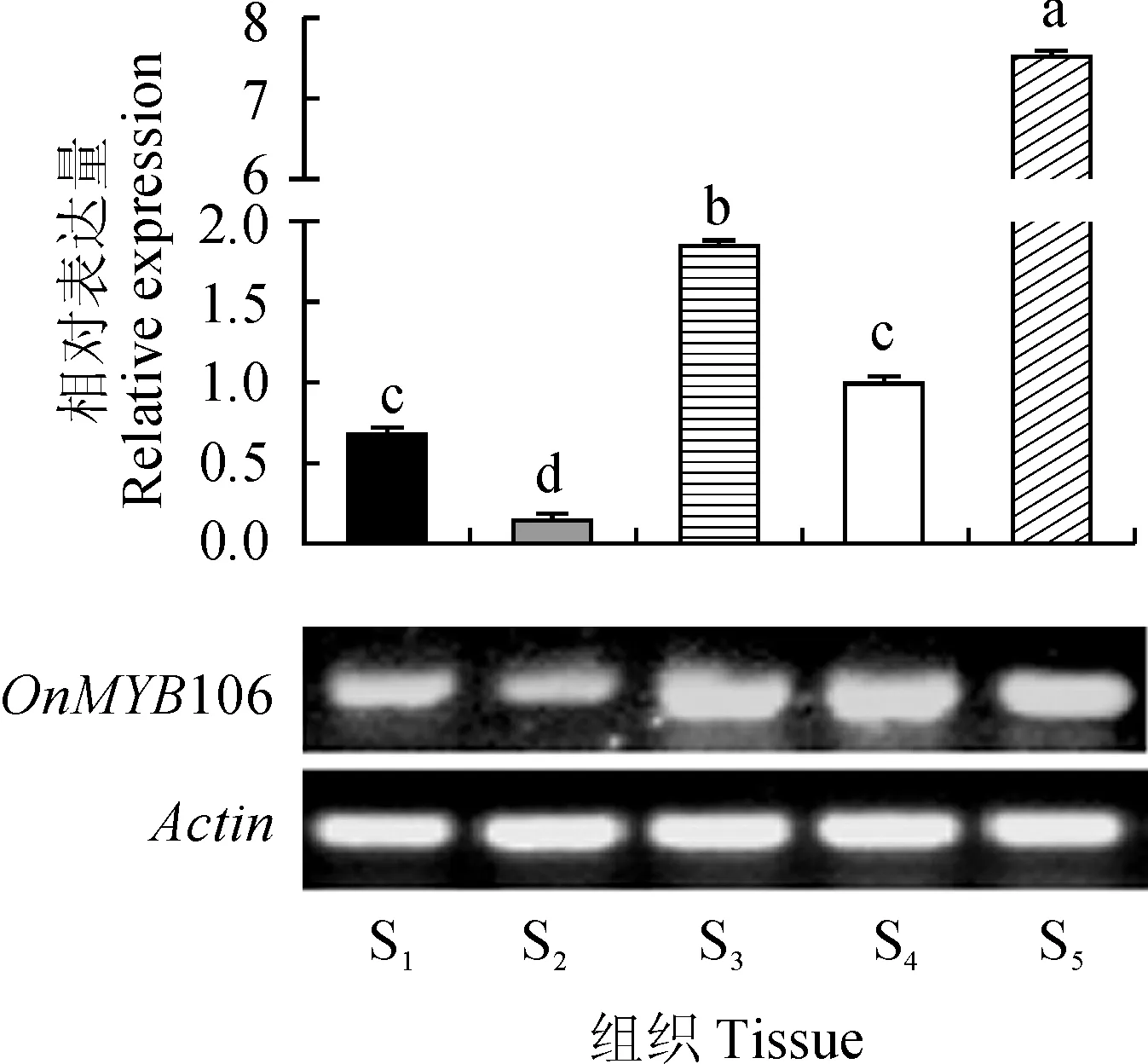
S1 ~ S5分别为‘柠檬绿’根、假鳞茎、上端叶、下端叶、花图10 ‘柠檬绿’不同组织部位的OnMYB106基因表达 S1-S5 represent roots, pseudobulb, upper leaves, bottom leaves and flower, respectivelyFig.10 Expression analysis of OnMYB106 gene in various tissues of Oncidium Honey Angel
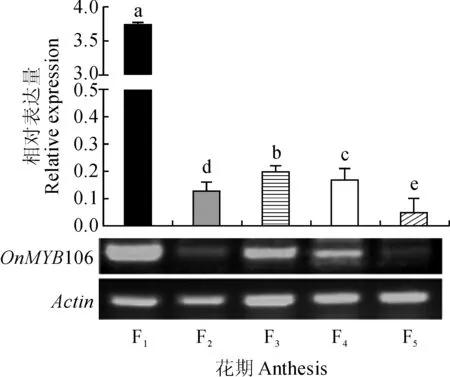
F1 ~ F5分别为‘柠檬绿’花苞期、绽口期、 半开放期、盛开前期、盛开期图11 ‘柠檬绿’不同花期的OnMYB106基因表达 F1-F5 represent bud period, bud opening period, semi-open period, bloom prophase and blooming period, respectivelyFig.11 Expression analysis of OnMYB106 gene in different flowering stages of Oncidium Honey Angel
2.7 OnMYB106在‘柠檬绿’不同花期中的表达分析
‘柠檬绿’不同花期(花苞期、绽口期、半开放期、盛开前期、盛开期)的定量结果表明(图11),OnMYB106的表达具有明显的时间特异性;从花苞期到盛开期,OnMYB106表达量基本成逐渐下降趋势,花苞期的表达量最高,盛开期的表达量最低,花苞期的表达量约为盛开期的81倍;花苞期与另外4个时期的表达量均有显著性差异。
3 讨 论
3.1 ‘柠檬绿’花粉败育特征分析
本研究通过将文心兰品种‘巧克力’和‘柠檬绿’的花粉团和花粉粒形态进行对比研究,发现‘柠檬绿’的花粉团形态比较干瘪、皱缩,花粉含量少;花粉细胞大小与形状不规则,花粉内含物缺失,细胞质空泡化严重;花粉粒异常,花粉壁发育不连续,出现很多孔洞。花粉内含物不仅对花粉壁的建构起重要作用,其代谢产物还能为花粉壁的形成提供原料[13-14]。而花粉壁是花粉发育过程中相对独立且最具特色的一部分,其发育异常是导致花粉不具备正常生物学功能的原因之一[15]。花粉壁主要起保护花粉细胞内部结构完整的作用,没有花粉壁的包裹,花粉细胞内含物会发生渗漏,从而引起花粉败育[16]。‘柠檬绿’花粉壁发育缺陷不仅会造成花粉皱缩塌陷[13, 17-18],还可能与花粉内含物的降解有关。此外,‘柠檬绿’花粉壁上的孔洞可能是一种细胞质穿孔现象。相关研究证明,在不育植物中会经常看到花粉细胞壁穿孔现象[19],细胞质穿壁会对花粉的发育带来一系列不良后果,如导致花粉母细胞(PMC)中染色体的数目减少或增多,形成无核或双核花粉粒,致使花粉粒大小不一致,最终产生无活力花粉粒或连体花粉粒,进而引起花粉败育[19]。‘柠檬绿’花粉壁发育异常可能是导致其花粉败育的一个主要原因。
3.2 ‘柠檬绿’OnMYB106蛋白特性分析
本研究以‘柠檬绿’为研究对象,在已知‘柠檬绿’转录组测序的基础上,利用RT-PCR技术克隆获得OnMYB106全长cDNA序列,序列分析表明OnMYB106属于SANT 超家族,具有2个连续的MYB DNA-binding结构域,为典型的R2R3-MYB转录因子。进化树分析与氨基酸序列比对结果表明,OnMYB106与高粱、水稻和二穗短柄草的MYB106蛋白处于同一进化分支,这4个同源基因的氨基酸序列相似性高达70.68%,表明它们在进化上更为保守。陈利维等[20]的研究表明水稻的OsMYB106基因能够调控花药的发育,OsMYB106 RNAi转基因植株表现出矮化及花粉败育的现象,花粉壁发育相关基因OsMS2和CYP704B2在OsMYB106 RNAi转基因植株中表达显著下降,因此推测该基因可能通过调控OsMS2和CYP704B2的表达来影响花粉壁形成进而影响花粉育性。并且相关研究证明,植物MYB转录因子主要通过调控绒毡层的发育、胼胝质的降解和沉积、花粉细胞壁的形成、光合产物的运输以及雄配子体的形成来影响花粉的育性[20-23]。因此推测文心兰OnMYB106可能与其同源基因OsMYB106功能相似,也属于调控花粉壁发育来影响花粉育性的一类转录因子,对于此推测还需进一步的研究和验证。
3.3 OnMYB106可能属于调控花粉壁发育的一类转录因子
本研究的qPT-PCR结果表明,OnMYB106在‘巧克力’花粉团中的表达量是‘柠檬绿’的88倍,二者之间差异达到极显著水平。OnMYB106在花粉正常发育的‘巧克力’品种中超表达,说明该基因可能与花粉的正常发育有关。不同组织器官的定量结果显示,OnMYB106在‘柠檬绿’花中的表达量最高,上端叶和下端叶次之,根和假鳞茎中表达量最低,花中的表达量与假鳞茎、根、叶片之间有显著性差异(P< 0.05),说明该基因可能对花的生长发育起重要的调控作用;结合不同花期的定量结果显示,OnMYB106表达量变化呈现一定的规律性,从花苞期到盛开期基本成逐渐下降趋势,在花苞期显著表达。Mascarenhas等[24]把花粉中的基因表达分为“早期”和“晚期”两个阶段。一般推测,“早期”基因主要用于编码细胞骨架蛋白、细胞壁合成蛋白或淀粉积累所需的蛋白;而“晚期”基因编码的蛋白被认为是花粉成熟或花粉管的发育所需要的[15]。OnMYB106在花苞期的表达量最高,此时花粉正处于发育早期,因此推测该基因属于花粉发育“早期”表达基因,结合其同源基因OsMYB106的功能验证结果,初步推测OnMYB106主要影响‘柠檬绿’花粉壁的形成,但具体的作用机制有待进一步研究证明。后续可以借助转基因技术或其他方法抑制该基因在文心兰可育品种中表达,进一步确定该基因与花粉育性的关系。

