番茄SlWRKY31基因启动子的克隆与逆境应答模式分析
高永峰,杨丰铭,李琴中,张国燕,王 丹,姚银安,刘继恺
(西南科技大学 生命科学与工程学院,四川绵阳 621010)
在植物生长和发育的不同阶段或在响应外部刺激时,不同组织和器官中基因表达的调控是通过转录、转录后和翻译后3个水平进行的[1]。转录调控在基因表达的激活和抑制中起关键作用,并且在很大程度上是通过基因启动子及其贡献的顺式作用元件控制的[2]。在植物的抗逆研究中,选择逆境胁迫诱导型启动子构建植物表达载体,来驱动抗逆基因在植物体内特定时间、特定组织定量表达,是解决植物应对逆境胁迫问题的一个有效方法,并对植物抗逆能力及其调控的研究具有重要价值[3]。目前能应用于植物转基因研究的逆境诱导型启动子已有报道,但多数启动子都只受到单一的逆境胁迫诱导,如棉花盐诱导的GhNHX1 启动子[4],菊花 Cd 诱导的DREBa启动子[5],番茄和小麦高温诱导的LeMTshsp和Hvhsp17 启动子[6-7]等。而对于同时受到多种逆境胁迫诱导的诱导型启动子的克隆和功能研究却鲜有报道。实际上,在植物的整个生长过程中,不仅仅只受到单一的逆境胁迫,而是往往会在不同的生长发育时期受到不同的逆境胁迫,甚至会在同一生长发育时期同时受到多种逆境胁迫,因此单一的逆境胁迫诱导型启动子在对提高植物综合抗逆性能(广谱抗性)的应用中就显示出一定的局限性,而多种逆境胁迫诱导型启动子的应用将更具优势。
植物体内存在大量响应逆境胁迫的基因,而这些基因的表达受到其启动子的调控。在植物众多的逆境胁迫应答基因中, WRKY 转录因子可以和抗逆基因启动子中的 W-box 相互作用来调节该基因的转录,在植物逆境胁迫的防卫应答过程中起着关键作用[8-9]。研究表明:WRKY基因在植物体内主要是诱导表达型,能响应盐、干旱、高低温、病原体以及食草动物攻击等不同的环境因子,其表达特点为速度快、时间短并经常在特定的组织中表达[10],这不仅使目的基因的表达产物在特定时间和环境下积累,避免非积累时间过量表达,也避免了植物营养的非必要浪费。研究发现[11],番茄中存在 81 个SlWRKY基因,并通过基因芯片和实时荧光定量 PCR 分析鉴定出了其中的 27 个SlWRKY基因分别受到 6 种不同的生物逆境(病原菌)和非生物逆境(干旱、高盐)的诱导表达。本研究以野生型番茄为材料,克隆得到SlWRKY31 基因5′端上游约 1 849 bp启动子序列,并利用该启动子驱动GUS(β-glucuronidase)基因在野生型番茄中表达。对获得的转基因番茄在不同胁迫处理后的 GUS 染色和定量分析研究,为番茄或其他作物的抗逆遗传改良提供一种可选择的响应多种逆境的启动子工具。
1 材料和方法
1.1 材 料
实验材料为番茄(Solanumlycopersicum)品种 ‘Ailsa Craig’,试验于 2015 年 6 月至 2017年 3 月在西南科技大学植物生物学实验室和人工温室完成。
基因克隆所用的大肠杆菌(Escheriachiacoli)DH5α 和农杆菌(Agrobacteriumtumefaciens)菌株EHA105,植物表达载体 pBI21SX 由西南科技大学植物生物学研究室保存。植物表达载体 pBI121SX 是通过在 pBI121 载体的HindⅢ 位点后面加入SpeI、XbaI 酶切位点前面加入XhoI 位点改造而成。
限制性内切酶为 Fermentas公司产品,高保真酶 PrimeSTAR HS 为 TaKaRa 公司产品,Taq DNA 聚合酶、T4DNA 连接酶、pEasy-Blunt 载体连接试剂盒和凝胶回收纯化试剂盒均购自 TransGen 公司,PCR 引物合成及测序工作由华大基因公司完成。
1.2 方 法
1.2.1番茄SlWRKY31启动子的克隆与序列分析用番茄SlWRKY31 基因核苷酸序列(Solyc06g066370.2.1)在 SGN 网站(https://solgenomics.net/tools/blast/)进行序列比对。根据比对出的序列,找到该基因的上游启动子序列,设计特异的 PCR 引物SlWRKY31Pro-F1/R1(表1)。以番茄的基因组 DNA 为模板,SlWRKY31Pro-F1/R1 为引物,利用高保真酶 PrimeSTAR HS(TAKARA公司)扩增SlWRKY31 基因启动子SlWRKY31-Pro。扩增程序为:98 ℃ 变性 10 s,55 ℃ 退火 15 s,72 ℃ 延伸 15 s,32 个循环。琼脂糖凝胶电泳后胶回收与目的启动子大小相近的片段,连接至克隆载体 pEASY-Blunt,转化大肠杆菌。挑选阳性克隆并送华大基因科技股份有限公司测序,测序正确的克隆被命名为 pEASY-Blunt-SlWRKY31-Pro。
利用启动子顺式作用元件在线分析网站 PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)[12]与 PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[13]预测SlWRKY31-Pro 序列上包含的顺式作用元件。
1.2.2番茄SlWRKY31基因的组织表达和诱导表达模式按照植物总 RNA 提取试剂盒(DP432,TianGen公司)说明书操作,分别提取野生型番茄不同组织(包括根、茎、叶、花、果实、种子)的总 RNA,经反转录获得 cDNA 第一链,置于 -20 ℃ 冰箱保存备用;将2周大的野生型番茄无菌幼苗分别置于含有 200 mmol/L NaCl、300 mmol/L 甘露醇、1 mmol/L SA、0.2 mmol/L ABA 的 1/2 MS液体培养基中及42 ℃热胁迫进行处理,以1/2 MS 液体培养基为对照,每个处理保留 6 株,分别在处理前和处理后的 2 和 6 h 进行取样,液氮速冻后按照上述的方法提取各处理样品的总 RNA。以番茄SlUBI3(GenBank 登录号为X58253)为内参基因,利用实时荧光定量 PCR(qRT-PCR)方法分析番茄SlWRKY31 基因在不同组织器官和不同胁迫处理下 mRNA 的相对表达水平。以上述获得的 cDNA 第一链为模板,qRT-SlWRKY31-F1/R1 和内参 qRT-SlUBI3-F1/R1 为引物(表1)进行 PCR 扩增。反应体系为 SYBR Green Supermix(2X)5 μL、上下游引物(10 mmol/L)各 0.3 μL、模板 cDNA 10~100 ng,最后加 ddH2O 至 10 μL。PCR 反应程序为 95 ℃ 预变性 3 min,95 ℃ 变性 10 s,60 ℃ 退火+延伸 30 s,40 个循环;65 ℃ 到 95 ℃ 每 1 ℃ 读数1次,持续 1 s。基因相对表达量的计算方法采用 2-ΔΔCt法。
1.2.3SlWRKY31启动子植物表达载体的构建将 1.2.1 中测序正确的阳性质粒 pEASY-Blunt-SlWRKY31-Pro 和改造好的植物表达载体pBI121SX 分别用SpeI和XhoI(Thermo公司)进行双酶切,并进行凝胶回收,用 SlWRKY31-Pro 启动子去替换 pBI121SX 的 CaMV35S 启动子,形成植物表达载体 pBI121SX-SlWRKY31-Pro::GUS。将重组质粒用冻融法[14]转入到农杆菌 EHA105 感受态细胞中。
1.2.4番茄的遗传转化及纯合体筛选野生型番茄种子用 15% 次氯酸钠振荡消毒 15 min,无菌水冲洗,置于 1/2 MS 固体培养基上进行暗培养,待种子露白后转入光照下,在第一片真叶长出前剪下子叶,放置于预培养基上 2 d。将携带重组质粒的农杆菌 28 ℃ 振荡培养 24 h,离心,去上清,用诱导培养基稀释至 OD600=0.1。将子叶浸泡在菌液中 15 min,倒掉菌液,将子叶置于无菌滤纸上,吸干多余菌液后,转到共培养基上培养 3 d, 然后转入再生培养基上进行继代筛选培养,每 3 周换1次培养基。待不定芽长到 3 cm 左右时,将其切下并转移至生根培养基上生根。等根发育好后,移出,温室盆栽。参照刘继恺等鉴定转基因阳性植株的方法[15],对新霉素磷酸转移酶Ⅱ(Neomycin phosphotransferaseⅡ,NPTⅡ)基 因 片 段进行扩增。随后,选取筛选到的转基因阳性植株培养至番茄果实成熟,收获成熟的番茄种子(即 T1代转基因种子)。将 T1代番茄种子灭菌后播种于含有 50 mg/L 硫酸卡那霉素的 1/2 MS 固体选择培养上,置于光照培养箱中。经筛选培养,得到含有硫酸卡那霉素抗性基因的转基因番茄幼苗。将筛选得到的转基因番茄阳性幼苗转移至盆中,在温室内培养至番茄果实成熟,并收获成熟的番茄种子(即 T2代转基因种子)。每株阳性苗(T2代幼苗)单独收种,按照 T1代种子的筛选方法进行再次筛选,如果播撒的种子全部成活,则相应的种子为单基因纯合(根据孟德尔分离定律筛选纯合子),为实验所需材料。

表1 实验中使用的引物
注:下划线表示添加的酶切位点
Note:The underlined sequences indicate the sites of restriction enzymes
(1)预培养基:MS + 1 mg/L 6-BA + 0.04 mg/L IAA。 (2)诱导培养基(100 mL):5 mL AB盐 + 2 mL MES缓冲剂 + 2 mL磷酸钠盐缓冲剂 + 91 mL 1%葡萄糖。(3)共培养基:MS+ 0.2 mg/L KH2PO4+ 0.1 mg/L Kinetin + 0.2 mg/L 2,4-D + 15 mg/L乙酰丁香酮。(4)再生培养基:MS + 500 mg/L羧卞青霉素钠 + 70 mg/L硫酸卡那霉素 + 2 mg/L 6-BA + 0.2 mg/L IAA。(5)生根培养基:1/2MS + 500 mg/L羧卞青霉素钠 + 30 mg/L硫酸卡那霉素 + 2 mg/L IAA。以上各培养基的pH值均为6.0。
1.2.5转基因植株的胁迫处理将2周大的转基因番茄无菌幼苗分别进行胁迫处理(同1.2.2)24 h,然后将上述所得的材料分别进行 GUS 组织化学染色和定量分析,染色结果用体视镜(Leica M205C)观察。
1.2.6GUS组织化学染色分析参考 Jefferson 等[16]的GUS染色方法,将1.2.5中处理后的转基因幼苗浸入适量 X-Gluc 溶液中,密封,37 ℃ 避光过夜,然后依次用 50%、75%、90% 和 100% 酒精脱色,用单反相机(Nikon D90)进行拍照观察。
1.2.7GUS酶活的定量分析1) 蛋白的提取 称取新鲜的植物组织100 mg左右,在液氮中研成粉末,加入1 mL预冷的GUS提取液(50 mL 0.1 mol/L 磷酸缓冲液pH 7.0,1 mL 10% SDS,2 mL 0.5 mol/L EDTA pH 8.0,100 μL Triton X-100;100 μL β-巯基乙醇,加水定容至100 mL),并混匀,然后4 000 g离心15 min, 吸出上清液,并利用Bradford[17]方法测定蛋白浓度。
2) 4-MU 标准曲线的绘制 在0.2 mol/L Na2CO3的终止液中加入4-MU,配成不同浓度4-MU溶液,然后利用HITACHI F-7000 荧光分光光度计测其产生的荧光(激发光365 nm,发射光455 nm,缝隙宽度为10 nm),绘制标准曲线。
3) GUS定量 吸取l00 μL 蛋白提取液加入到400 μL GUS检测液中(在GUS提取液中加入1 mmol/L的4-methylumbelliferyl-β-D-glucuronide,MUG),37 ℃ 反应30 min后取混合反应物200 μL加入到800 μL 0.2 mol/L Na2CO3反应终止液中终止反应。然后利用HITACHI F-7000 荧光分光光度计进行荧光测定(激发光365 nm,发射光455 nm,缝隙宽度为10 nm)。重复3次取平均值,根据标准曲线计算出4-MU浓度。计算公式:GUS酶活性=反应底物(4-MU)的物质的量/反应时间×蛋白含量。
2 结果与分析
2.1 番茄 SlWRKY31 启动子克隆与序列分析
以番茄的基因组DNA为模板,SlWRKY31Pro-F1/R1为引物,进行 PCR 扩增,产物经凝胶电泳后发现在接近 2 000 bp 区域出现单一的条带,与预计结果大小一致(图1),说明启动子克隆成功。
测序结果显示,扩增的片段大小为 1 849 bp。在线软件分析结果发现(图2):该启动子除含有 14 个光响应元件和 4 个组织特异与发育相关的响应元件之外,还含有大量的与非生物胁迫相关的应答元件,如含有 3 个热胁迫的响应元件 HSE(AAAAAATTTC)、2 个受干旱诱导的响应元件 MBS(CAACTG)、1 个参与防御和胁迫反应的元件 TC-rich repeats(ATTTTCTTCA)、1 个参与创伤反应的元件 WUN-motif(AGGAAATTT),1 个水杨酸(SA)响应元件 TCA-element(GAGAAGAATA),以及 4 个植物激素相关的响应元件,如 1 个脱落酸(ABA)响应元件 ABRE(TACGTG), 2 个赤霉素(GA)响应元件 TATC-box(TATCCCA)和 1 个生长素的响应元件 TGA-element(AACGAC)(表2)。预测结果表明SlWRKY31 基因启动子可能会受到干旱、热、创伤等非生物胁迫和 SA以及ABA 等植物激素的诱导。
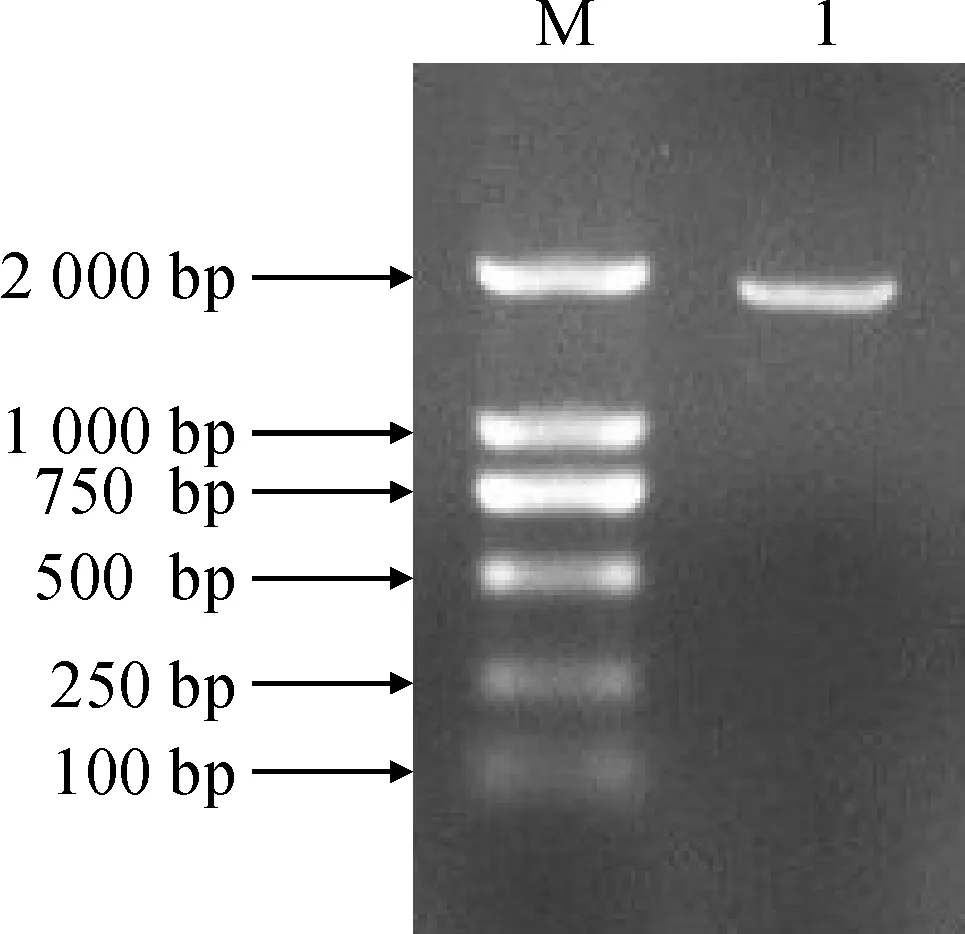
M. DL2 000;1. 目的片段图1 番茄 SlWRKY31 启动子的 PCR 扩增产物M. DL2 000;1. PCR product of target fragmentFig.1 PCR amplified product of SlWRKY31 promoter

下划线表示不同顺式作用元件的 DNA 核心序列图2 番茄 SlWRKY31 启动子的 DNA 序列 The underlined DNA sequences in theFigure indicate DNA core sequences of different Cis-acting elementsFig.2 DNA Sequences of SlWRKY31 promoter from tomato
2.2 番茄 SlWRKY31 基因在不同组织和胁迫诱导下的表达模式
分别提取野生型番茄根、茎、叶、花、果实以及种子的总 RNA,反转录得到第一链 cDNA,利用实时荧光定量 PCR 检测SlWRKY31 基因在番茄不同组织中的表达情况。结果显示(图3),SlWRKY31 在所有组织中均有表达,不具有组织特异性,但在叶以及不同成熟期果实中的表达水平相对较高,在茎中表达量最低。
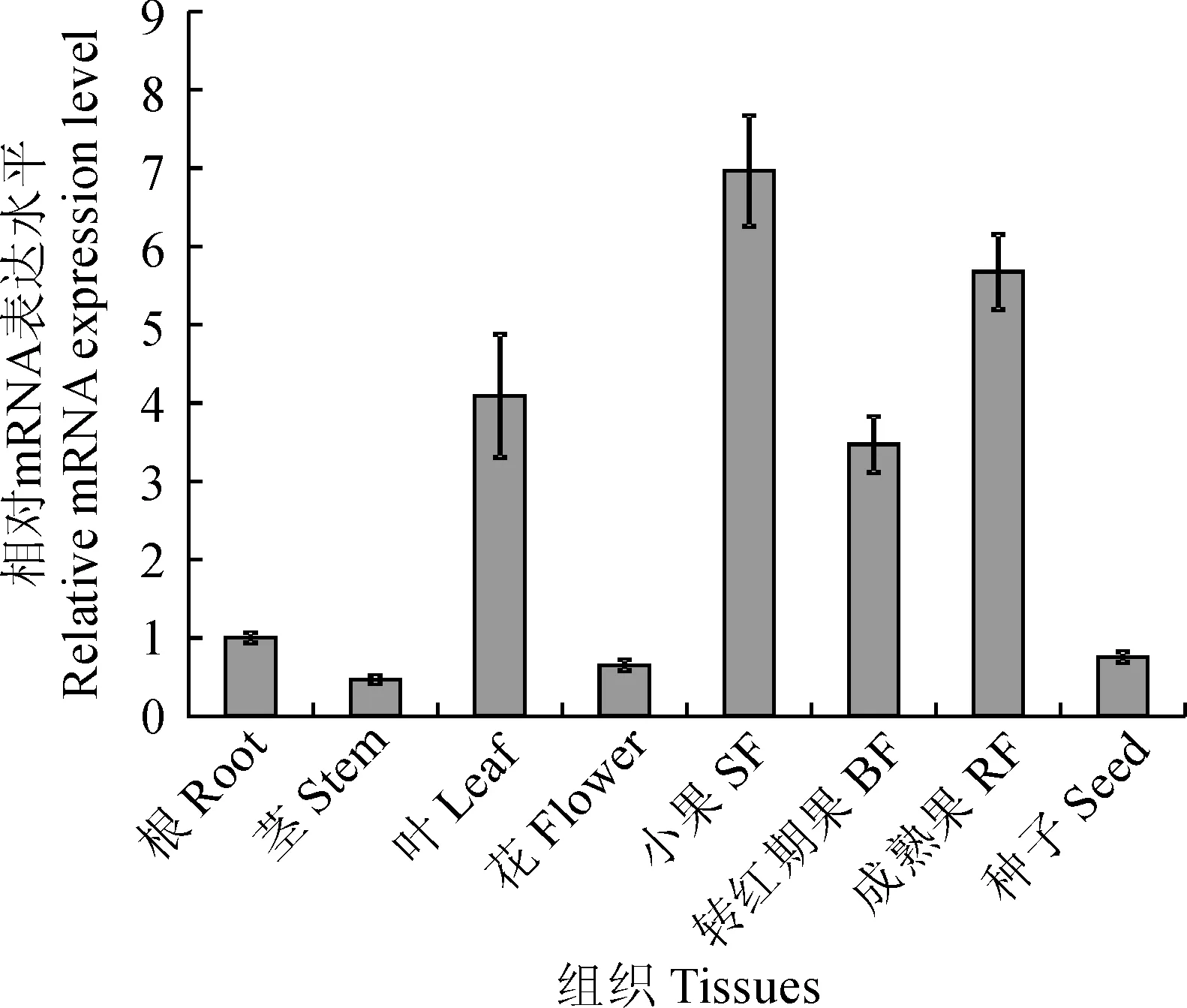
图3 番茄SlWRKY31基因在不同组织中的表达Fig.3 Expression patterns of SlWRKY31 gene in different tissues of tomato
利用实时荧光定量 PCR 检测SlWRKY31 基因在不同胁迫处理下的表达情况。结果显示(图4):盐、干旱、热、SA 以及ABA 的胁迫处理均能够显著诱导SlWRKY31 基因mRNA的表达水平,其中在盐处理后的 2和 4 h 分别升高至处理前的 6.3和 9.5 倍,在干旱处理后的 2 和 4 h 分别升高至处理前的 4和 5 倍,在 42 ℃ 高温胁迫处理后的 2和 6 h 分别升高至处理前的 2.2和 6.6 倍,在 ABA 处理后的 2 和 6 h 分别升高至处理前的 1.6和1.5 倍。在 SA 处理后的 2 和 6 h 分别升高至处理前的 1.9和 1.2 倍。说明番茄SlWRKY31 基因的表达显著受到非生物胁迫,如盐、干旱和高温,以及植物激素SA和ABA 的诱导上调。

表2 SlWRKY31 启动子中的顺式作用元件
注:N表示A、C、G或T
Note:N indicates A, C, G or T

不同小写字母表示同一处理不同时间的差异显著 (P<0.05,LSD检验)图4 SlWRKY31 基因在不同胁迫条件下的表达模式Different letters represent significant differences among different times with same treatment (P<0.05, LSD test)Fig.4 Expression patterns of SlWRKY31 gene under different stress treatments
2.3 番茄 SlWRKY31 启动子植物表达载体的构建与遗传转化
用测序正确的SlWRKY31启动子去替换 pBI121SX 载体上的 CaMV35S 启动子,形成植物表达载体(图5)。通过SpeⅠ 和XhoⅠ 对构建好的植物表达载体进行双酶切鉴定,酶切下的条带正确,证明SlWRKY31 启动子已成功连入表达载体(图6)。
用含有上述重组质粒 pBI121SX-SlWRKY31-Pro::GUS 的农杆菌菌株侵染经过预培养 3 d 的番茄子叶和下胚轴,并通过组织培养获得转基因番茄再生植株。
本研究共获得 11 棵组培再生植株,以提取获得的组培植株的 DNA 为模板,NPTⅡ-F/R 为引物进行PCR 验证阳性植株,预期扩增长度应为 857 bp。结果表明(图7),野生型烟草未能扩增出条带,而抗性植株能够扩增出预期大小的条带,共检测出 9 棵抗性植株,阳性率为 82%。
2.4 番茄 SlWRKY31 启动子的活性分析
取转基因番茄的根、茎、叶、花和果实进行 GUS 组织化学染色,染色结果显示(图8),所有被检测的组织中都能够观察到明显的蓝色,这说明SlWRKY31 启动子能够驱动GUS基因在番茄的各个组织中表达,没有明显的组织特异性,是一个组成型的启动子。
2.5 不同胁迫处理对 SlWRKY31 启动子的活性影响
对不同胁迫和对照处理 24 h 后的转基因番茄幼苗,进行 GUS 组织化学染色和 GUS 酶活定量检测显示:对照组番茄幼苗经 GUS 染色后,仅在番茄幼苗的根、子叶和叶片中的少数的部位呈现较弱的浅蓝色,而经 200 mmol/L NaCl 和 300 mmol/L 甘露醇处理的番茄幼苗,其根、茎和叶均呈现深蓝色(图9,A~C),其 GUS 活性分别为4.037和3.216,分别为对照组(1.379)的 2.9 和 2.3 倍(图10);在 0.2 mmol/L ABA 和42 ℃ 高温处理条件下,经 GUS 染色后的番茄幼苗在其根、茎和叶片也呈现出深蓝色(图9,D~E),其 GUS 活性分别为2.394 和3.023,分别为对照组的 1.7 和 2.2 倍(图10);而在 1 mmol/L SA 处理条件下,其番茄幼苗的所有叶片均呈现出较深的蓝色,其 GUS 活性为2.598,是对照组的 1.8 倍(图10),但在根和茎中却没有蓝色显示(图9,F)。以上结果表明,SlWRKY31 启动子显著受到NaCl 、甘露醇、SA、ABA 和 42 ℃ 的诱导表达,表明该启动子是一个可以响应多种逆境胁迫的诱导型启动子。

Nos P. Nos 启动子;NPTⅡ. 新霉素磷酸转移酶 Ⅱ; Nos Ter. Nos 终止子图5 植物表达载体基因表达盒示意图Nos P. The promoter of Nos gene;NPTⅡ. Neomycin phosphotransferase Ⅱ;Nos Ter. The terminator of Nos geneFig.5 Schematic diagram of plant expression vector

M. DL15 000;1. pBI121SX-SlWRKY31-Pro::GUS; 2. pBI121SX-SlWRKY31-Pro::GUS 质粒双酶切产物图6 植物表达载体双酶切鉴定M. DL15 000;1. pBI121SX-SlWRKY31-Pro::GUS; 2. The fragments of pBI121SX-SlWRKY31-Pro::GUS plasmid by restriction enzyme digestedFig.6 Double digestion of plant expression vector
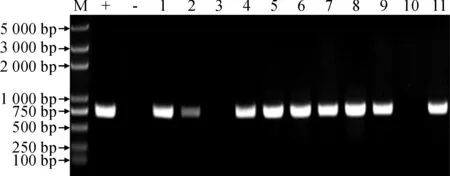
M. Trans2k Plus;+. pBI121SX-SlWRKY31-Pro::GUS; -. 野生型植株;1~11. 转基因植株图7 转基因植株NPTⅡ基因的PCR检测M. Trans2k Plus;+. pBI121SX-SlWRKY31-Pro::GUS ; -. Wild type; 1~11. Transgenic plantsFig.7 PCR analysis for NPTⅡ gene in transgenic plants

A. 根;B. 根的横切;C. 茎;D. 茎的横切;E. 叶片;F. 花;G. 果实的纵切图8 转基因番茄的 GUS 组织化学染色分析 A. Roots;B. Cross sections of roots;C. Stems;D. Cross sections of stems;E. Leaves;F. Flowers; G. Longitudinal sections of fruitsFig.8 Histochemical GUS assay of transgenic tomato
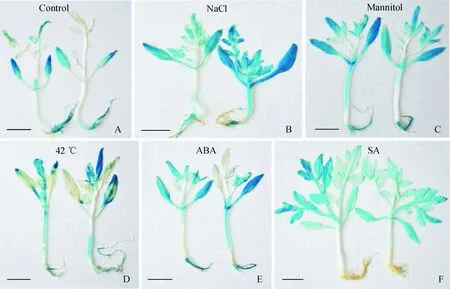
A. 对照;B. 200 mmol/L NaCl 处理;C. 300 mmol/L 甘露醇处理;D.热胁迫 42 ℃ 处理;E. 0.2 mmol/L ABA 处理; F. 1 mmol/L SA 处理图9 不同胁迫条件下转基因番茄幼苗的 GUS 组织化学染色 A. Control;B. 200 mmol/L NaCl treatment;C. 300 mmol/L Mannitol treatment;D. Heat stress 42 ℃ treatment;E. 0.2 mmol/L ABA treatment;F. 1 mmol/L SA treatmentFig.9 Histochemical GUS assay of transgenic tomato seedlings under different stresses

不同小写字母表示不同处理间的差异显著(P<0.05,LSD检验)图10 不同胁迫条件下转基因番茄幼苗的 GUS 定量分析 Different letters represent significant differences among different treatment (P<0.05, LSD test)Fig.10 Quantification of GUS activity in transgenic tomato seedlings under different stresses
3 讨 论
在植物的抗逆基因工程研究中,如果使用组成型启动子持续过量地表达转化的外源基因会阻碍植物的生长并且减少其产量[18-19],因为外源基因的过量表达往往会竞争植物在正常生长条件下需要的能量并且阻碍蛋白质或者 RNA 的合成[20]。而如果选择逆境诱导型启动子,使得外源基因只在胁迫条件下才大量表达,这样不仅会获得目的产物、达到预定目标,而且也不会产生副作用。因此,逆境诱导启动子的克隆和开发在植物的抗逆基因工程育种中具有重要意义。近年来的研究发现,WRKY 转录因子与植物的非生物胁迫应答密切相关[21],在利用基因芯片和 Northern 印迹技术对模式植物拟南芥和水稻的研究中发现,有一些WRKY基因受到高温、低温、干旱、盐碱、缺素等非生物逆境胁迫因子的诱导表达[22]。此外,也有一些 WRKY 转录因子同时受到几种非生物逆境胁迫因子的诱导表达,如拟南芥的AtWRKY25、AtWRKY28、AtWRKY40和AtWRKY70 基因能同时受到冷和盐胁迫的诱导表达[23];在对重金属污染治理的模式植物遏蓝菜(Thlaspicaerulescens)的TcWRKY53 基因的研究中也发现该基因同时受盐、冷和渗透胁迫的诱导表达[24]。Liao等[25]在研究银杏GbWRKY2 启动子的5 侧翼序列时,发现存在许多非生物应激响应相关的基序,如含有 1 个低温反应相关基序 CRTDREHVCBF2,2 个干旱胁迫反应和老化反应相关基序 ACGTATERD1和 4 个疾病防御相关基序 BIHD1OS,2 个 ABA 反应顺式元件 ABRE 等。上述研究表明:WRKY基因启动子序列上存在一类潜在的能够广泛响应不同逆境胁迫信号的顺式作用元件,表明WRKY基因启动子是一类潜在的逆境诱导型启动子。本研究首先克隆得到番茄SlWRKY31 基因的启动子,对其序列进行分析发现,该启动子序列中除含有大多数高等植物启动子具有的保守元件外,还包含 14 个光响应元件、4 个激素响应元件、8 个非生物胁迫响应元件和 4 个组织特异与发育相关的响应元件,而非生物胁迫响应元件是除光响应元件外数量最多的一类元件,表明克隆得到的序列符合真核基因启动子的基本结构特征,可能受光、非生物胁迫等的诱导进而调控基因表达。
为验证SlWRKY31 基因的启动子活性和它的组织表达模式,将SlWRKY31 启动子和GUS基因进行融合构建成植物表达载体,并通过农杆菌介导法将其转化野生型番茄,对获得的转基因番茄进行 GUS 组织化学染色分析。结果显示,在番茄的根、茎、叶、花和果实中都能够观察到明显的蓝色,这说明SlWRKY31 启动子并没有明显的组织特异性,是一个组成型的启动子,这也与SlWRKY31 基因的组织表达模式分析结果一致。为了进一步验证SlWRKY31 启动子在不同逆境胁迫和激素处理下的活性和表达模式,对不同胁迫处理下的转基因番茄幼苗进行了 GUS 组织化学染色和 GUS 酶活的测定,结果显示非生物逆境盐、干旱和高温以及植物激素 SA 和 ABA 都能够显著诱导SlWRKY31 启动子活性增加,但 GUS 活性的定量结果表明该启动子对盐、干旱和高温的响应比植物激素的响应更加强烈,这可能与它们对应的响应元件在SlWRKY31启动子中存在的数量和调控的强弱有关。有趣的是,在SA 的处理组中番茄的根和茎中均没有显示蓝色,而对照组和其他处理组番茄的根和茎均能被观察到蓝色,表明SA的处理能够抑制SlWRKY31启动子在番茄根和茎中的活性,却可以提高其在叶片中的活性。我们推测,在SlWRKY31 启动子中激活与抑制调节元件并存,而这些元件除具有激活或抑制作用外,很可能还具有组织或器官特异的响应功能。此外,水杨酸(SA)被认为是一种十分重要的病源信号分子,与植物的先天免疫应答和系统获得抗性的建立密切相关[26],植物叶片是病原菌最容易侵染的器官,而SlWRKY31 启动子在病源信号分子(SA)的作用下其在叶片中的活性增加有利于植物快速启动先天的免疫应答,这可能是植物经过长期进化而保留下来的一种有利的响应机制。而这一机制是如何发挥作用的、是通过哪些元件进行调控的等具体调控模式有待进一步研究。

