Trim59调控膀胱癌细胞侵袭及迁移能力的研究
赵 凯,陈 伟,苗陈岿,张 成,秦 超,贾瑞鹏,王增军
(1.南京医科大学附属南京医院泌尿外科,江苏南京 210006;2.南京医科大学第一附属医院泌尿外科,江苏南京 210029;3.高邮市中医医院,江苏扬州 225600)
目前,膀胱癌的高复发率和死亡率给患者带来了较差的预后[1-2]。因此需要我们进一步寻找有效的分子标记物并应用于膀胱癌的早期诊治。三基序蛋白Trim (tripartite motif containing)家族是一个进化上保守的基因家族,与免疫调节、细胞增殖、转录调控、神经发育、细胞分化和肿瘤发生等密切相关[3-5]。Trim59 蛋白属于Trim三基序家族的一员,具有一个ring finger domain、一个B-box domain、两个卷曲螺旋和一个跨膜结构域。研究表明:Trim59 在上皮肿瘤细胞内呈现高表达状态,可作为上皮性肿瘤的标志物用于临床早期诊断[6];不仅可以促进各种基质的泛素化相关修饰,而且能在转录水平沉默特定的靶基因[7]。已有文献报道Trim59可促进前列腺癌、肺癌、胃癌、宫颈癌和骨肉瘤等肿瘤的发生发展[4,8-10]。然而Trim59在膀胱癌中表达情况的研究还较少,我们通过实验观察Trim59调控膀胱癌细胞侵袭及迁移的能力。
1 材料与方法
1.1 组织和细胞 本研究收集了15对膀胱癌组织标本,所有标本均来自南京医科大学第一附属医院泌尿外科行膀胱癌根治术的患者,标本取好后立即保存于-80 ℃冰箱中。人膀胱癌细胞T24、5637和TCCSUP均购自中科院上海细胞库。T24和TCCSUP细胞使用DMEM培养基,5637细胞使用RPMI 1640的培养基,在培养基中加入10% FBS以及双抗100 U/mL配成完全培养基,置于5% CO2、37 ℃细胞培养箱中培养。
1.2 细胞SiRNA转染 待细胞生长状况良好并且融合度达到70%左右时,可以进行细胞铺板并准备转染。转染前将培养皿中细胞消化铺在6孔板中(细胞密度在70%左右),在24 h内进行转染。在进行转染前1 h更换无抗体培养基。按照说明书上操作步骤利用Lipofectamine2000对细胞进行转染。干扰RNA购买于上海吉玛公司,序列(5′~3′):Si-Trim59(CCCUGAACAUUACAGGCAATT); Negative(UUGCCUGUAAUGUUCAGGGTT)。细胞SiRNA转染后,我们使用PCR技术检测了Trim59敲低前后的mRNA表达量,对其敲低效率进行了验证。
1.3 总RNA提取和RT-PCR 组织的标本处理:天平称取100 mg样本,转移至装有1 mL Trizol的1.5 mL EP管中,剪刀剪碎样本,电动组织研磨设备充分匀浆。RNA提取全部过程均于冰上进行,避免RNA降解。后续步骤与细胞标本的RNA提取步骤相同。细胞标本处理:6孔板中的每个孔弃去培养液,PBS洗涤2遍后分别滴入500 μL Trizol,置于冰上操作,静置5 min后,使用移液器均匀充分吹打、抽吸贴壁细胞,将裂解液移入1.5 mL EP管中。后续以Trizol法提取总RNA。先取 1 μg RNA逆转为cDNA,之后在取2 μL cDNA进行 PCR扩增,扩增条件如下:95 ℃,30 s;95 ℃,5 s,40个循环;60 ℃,1 min。引物序列如下(5′~3′):Trim59,Forward:5′-TGACTGACACACACTGGACA-3′;Reverse:5′-CTGCTGCTCTCGTATTTCCT-3′;β-actin:Forward:5′-ACTGGAACGGTGAAGGTGAC-3′;Reverse:5′-AGAGAAGTGGGGTGGCTTTT-3′。RT-PCR反应和分析在ABl7900(Applied Biosystems,Carlsbad,USA) 系统上进行。利用两组△Ct差值来计算Trim59mRNA的相对表达量,即:△Ct Trim59=Ct Trim59-Ctβ-actin,△Ct normal=CTnormal-CTβ-actin,△△Ct=△Ct Trim59-△Ct normal,采用2-△△Ct法计算出膀胱癌组Trim59 mRNA相对表达量。
1.4 Transwell迁移和侵袭实验 先消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用含0.2%BSA的无血清培养基重悬。调整细胞密度至5×105/mL。Transwell小室制备用50 mg/L Matrigel 1∶4稀释液,取50 μL包被Transwell小室底部膜的上室面,37 ℃ 4 h,使Matrigel聚合成凝胶。然后取细胞悬液200 μL加入Transwell小室;下室加入600 μL含10% FBS 培养基,在37 ℃的CO2培养箱培养48 h。之后取出Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30 min,将小室适当风干。0.1 %结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。在400倍显微镜下随机选取5个视野观察细胞,计数。
1.5 蛋白印迹分析 人类膀胱癌细胞系T24和5637用含磷酸酶抑制剂的蛋白裂解液(RIPA∶PMSF=100∶1)(凯基生物技术,北京)处理提取总蛋白。蛋白样品经10%SDS-PAGE进行电泳,300 mA电流转膜2 h,将蛋白转移到PVDF膜上,5%脱脂牛奶于摇床上室温封闭2 h。含有蛋白的PVDF膜孵育GAPDH,Vimentin,N-cadherin,matrix metalloprotein-9(MMP-9)抗体(CST,美国),4 ℃过夜。之后TBST洗膜3次,每次10 min,孵育含辣根过氧化物酶二抗(中杉金桥,北京)2 h,TBST洗膜3次,化学发光仪(Bio-Rad公司,美国)曝光显影。采用Image-Pro Plus软件进行分析的蛋白IOD值,目的蛋白的灰度值等于目的蛋白IOD/内参蛋白IOD。

2 结 果
2.1 Trim59在膀胱癌组织及细胞系中高表达 15对膀胱癌组织验证的PCR结果显示,与相对应的癌旁组织相比,Trim59在膀胱癌组织中表现为高表达。另外,在3株膀胱癌细胞系中,T24和5637的Trim59mRNA表达水平较高于TCCSUP细胞,因此选取T24和5637细胞进行后续的研究。见图1。
2.2 siRNA干扰对膀胱癌细胞Trim59表达水平的影响 因为Trim59在膀胱癌细胞中高表达,通过使用特异性的siRNA敲低Trim59后,PCR结果显示si-Trim59组的Trim59的表达量显著小于阴性对照组NC,从而证明针对Trim59设计的siRNA能够有效沉默膀胱癌细胞中Trim59的表达。见图2。
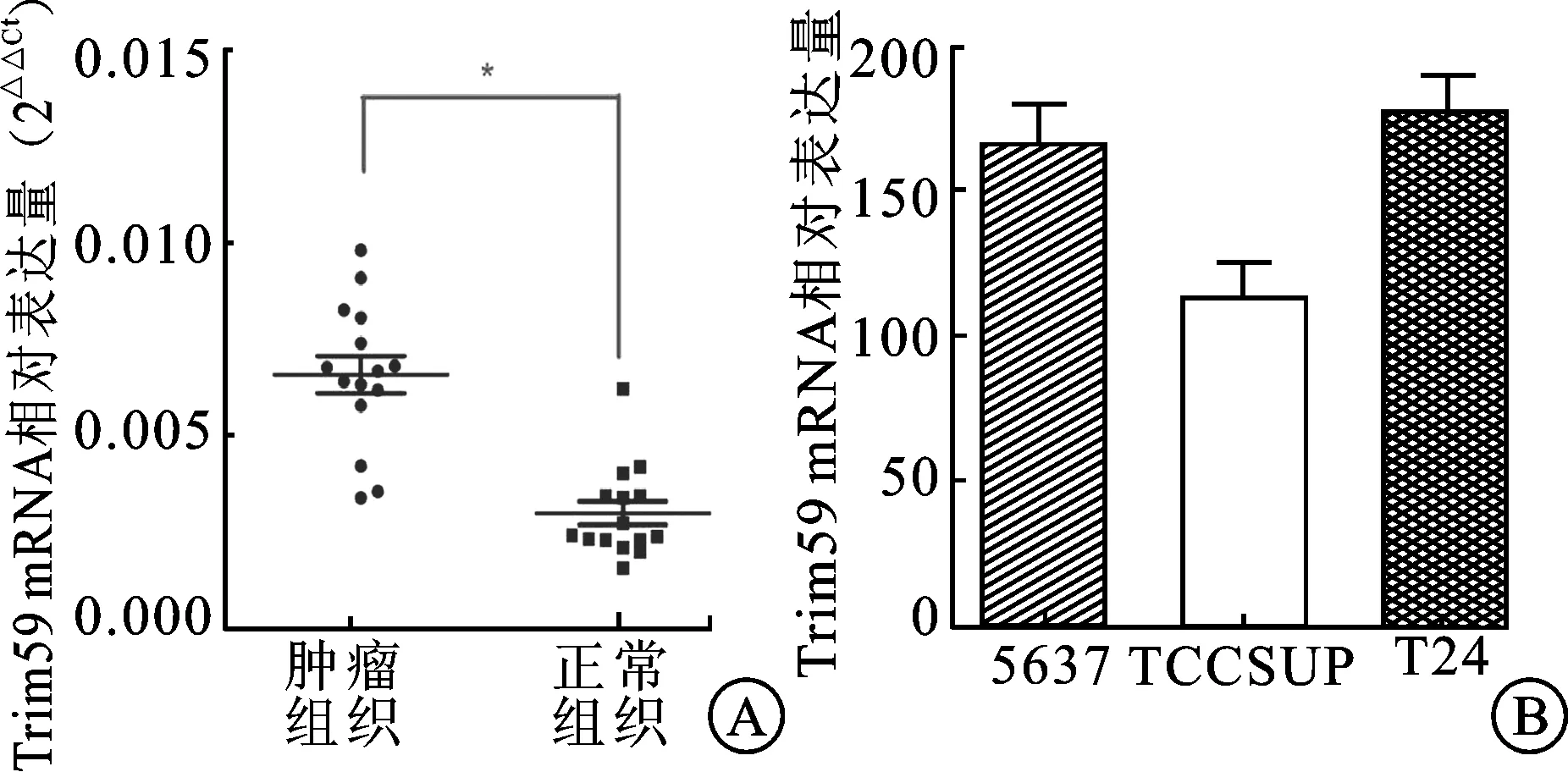
图1 Trim59 mRNA在膀胱癌组织及细胞系中高表达
A:与正常组织相比,肿瘤组织中Trim59 mRNA表达量明显较高,差异有统计学意义(*P<0.05,n=15);B:3株细胞系中Trim59 mRNA的相对表达量。
2.3 沉默Trim59可抑制膀胱癌细胞的迁移能力 Transwell迁移实验显示:与阴性对照组相比,在T24和5637细胞系中,si-Trim59组穿过室内膜的膀胱癌细胞的数量明显减少,差异有统计学意义(P<0.05,图3)。结果表明沉默Trim59可抑制膀胱癌细胞的迁移能力。
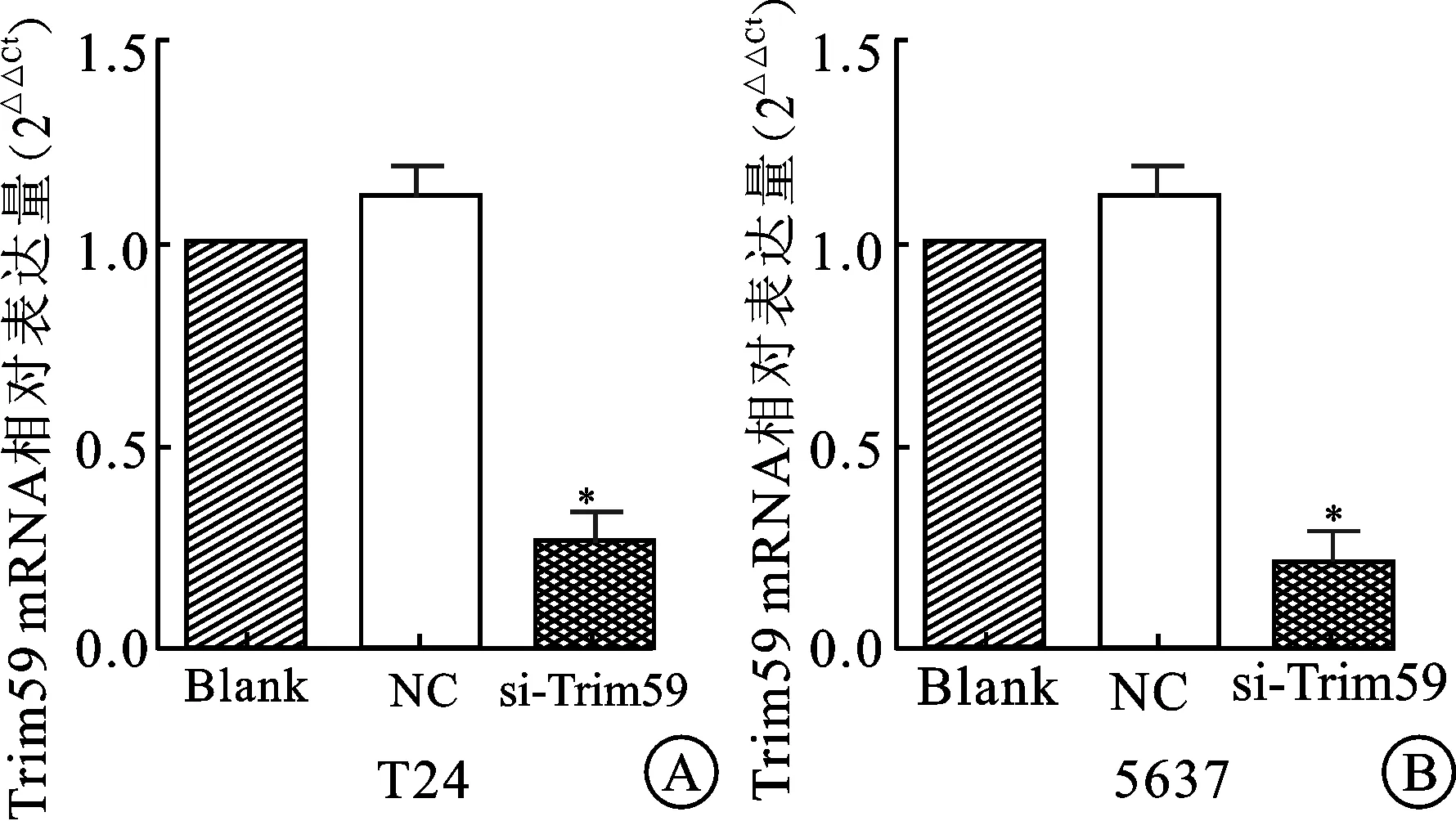
图2 沉默Trim59对T24和5647细胞系中
A:T24细胞中,与阴性对照组或空白组相比,si-Trim59组Trim59 mRNA水平明显降低,差异有统计学意义(*P<0.05);B:5637细胞中,与阴性对照组或空白组相比,si-Trim59组Trim59 mRNA水平明显降低,差异有统计学意义(*P<0.05)。

图3 沉默Trim59对膀胱癌细胞迁移能力的影响
A:T24和5637细胞迁移;B:T24和5637迁移分析柱状图。两组比较:*P<0.05(n=3)。
2.4 沉默Trim59可抑制膀胱癌细胞的侵袭能力 Transwell侵袭实验显示:与阴性对照组相比,在T24和5637细胞系中,si-Trim59组穿过室内膜的膀胱癌细胞的数量明显减少,差异有统计学意义(P<0.05,图4)。结果表明沉默Trim59可抑制膀胱癌细胞的侵袭能力。

图4 沉默Trim59对膀胱癌细胞侵袭能力的影响
A:T24和5637细胞侵袭;B:T24和5637细胞侵袭分析柱状图。两组比较:*P<0.05(n=3)。
2.5 沉默Trim59对epithelial-mesenchymal transition(EMT)相关蛋白表达的影响 Western bolt检测结果显示:与阴性对照组相比,在T24和5637细胞系中,沉默Trim59能够显著下调间质表型蛋白Vimentin和N-cadherin表达水平,差异具有统计学意义(P<0.05)。结果表明沉默Trim59能够抑制膀胱癌细胞EMT过程。另外,我们发现在T24和5637细胞中,沉默Trim59后MMP-9蛋白水平明显下调,差异具有统计学意义(P<0.05)。

图5 转染si-Trim59后T24和5637细胞系中Vimentin、N-cadherin和MMP-9蛋白的表达
A:Western blot检测;B:T24细胞中3种蛋白表达灰度分析柱状图;C:5637细胞中3种蛋白表达灰度分析柱状图。
3 讨 论
作为超家族蛋白的一员,有文献报道称Trim59涉及到许多生物学过程并充当了重要的调节作用,包括肿瘤的发生、细胞增殖、细胞凋亡等[11]。据报道Trim59在许多恶性肿瘤内高度表达,比如前列腺癌、胃癌等[4,8]。Trim59的高表达可促进肿瘤的进展和转移,并且与肿瘤的临床分期紧密相关[4,9]。然而Trim59在膀胱癌中的表达情况及生物学功能尚鲜见报道,机制还不明确。
本研究中,我们已经证明人膀胱癌组织中Trim59的mRNA是高表达的。在培养的3种细胞器中,结果发现T24和5637细胞系中Trim59的mRNA相对表达量较TCCSUP细胞系中的表达量要高。因而我们选取了T24和5637这两个细胞系进行后续的功能学研究。通过使用特定的siRNA转染细胞,结果发现Trim59敲低后,膀胱癌细胞的生物学行为受到影响。通过沉默Trim59,发现T24和5637细胞的迁移和侵袭能力发生明显下降。为了进一步研究Trim59对膀胱癌细胞迁移和侵袭能力影响的具体的分子机制,我们检测了多个相关蛋白的表达情况。结果发现在沉默T24和5637细胞中Trim59的表达后,N-cadherin、Vimentin和MMP-9蛋白的表达下降。N-cadherin和Vimentin属于上皮间质转化过程中的间质标志物。沉默Trim59后,间质标志物N-cadherin和Vimentin发生下调,表明上皮向间质转化的过程受到了抑制。在肿瘤的发生发展过程中,EMT过程能够使得上皮肿瘤细胞逐渐失去其极性,细胞与细胞间的紧密连接结构逐步降解,与此同时,肿瘤细胞骨架发生重组并且获得了间质细胞的特性,这一特性导致肿瘤细胞能够穿过组织的基底膜并转移播散至远处器官组织,从而促进肿瘤的进展转移[12]。此前,EMT过程已经被证明是可以引起一系列的肿瘤学行为,例如增强侵袭、迁移和转移[13]。MMP-9属于基质金属蛋白酶家族,可以降解细胞外基质和基底膜,从而诱导细胞的转移[14]。除此之外,在多个肿瘤中上调MMP-9的表达能够增强肿瘤细胞的侵袭和迁移的能力[15-16]。沉默Trim59后,由于MMP-9的表达量下降了,从而削弱了MMP-9在促进细胞侵袭及迁移的过程中可能发挥的作用。上述结果表明沉默Trim59可通过调控EMT过程抑制膀胱癌细胞的迁移及侵袭。这些结果揭示了如下分子机制:在膀胱癌细胞中,沉默Trim59通过调控EMT过程抑制膀胱癌细胞的迁移及侵袭。
综上所述,我们的研究明确了Trim59在膀胱癌中的生物学作用。通过siRNA敲低Trim59并通过调控EMT过程抑制膀胱癌细胞的迁移和侵袭能力。本研究的结果加深了我们对于膀胱肿瘤发展转移的认识,同时也可将Trim59作为膀胱癌治疗的一个潜在靶点。
[1] SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics for Hispanics/Latinos,2012[J].CA Cancer J Clin,2012,62(5):283-298.
[2] TORRE L A,BRAY F,SIEGEL RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3] TOCCHINI C,KEUSCH JJ,MILLER SB,et al.The TRIM-NHL protein LIN-41 controls the onset of developmental plasticity in Caenorhabditis elegans[J].PLoS Genet,2014,10(8):e1004533.
[4] ZHOU Z,JI Z,WANG Y,et al.TRIM59 is up-regulated in gastric tumors,promoting ubiquitination and degradation of p53[J].Gastroenterology,2014,147(5):1043-1054.
[5] CHEN L,CHEN D T,KURTYKA C,et al.Tripartite motif containing 28 (Trim28) can regulate cell proliferation by bridging HDAC1/E2F interactions[J].J Biol Chem,2012,287(48):40106-40118.
[6] MERONI G,DIEZ-ROUX G.TRIM/RBCC,a novel class of“single protein RING finger” E3 ubiquitin ligases[J].Bioessays,2005,27(11):1147-1157.
[7] LIN W Y,WANG H,SONG X,et al.Knockdown of tripartite motif 59 (TRIM59) inhibits tumor growth in prostate cancer[J].Eur Rev Med Pharmacol Sci,2016,20(23):4864-4873.
[8] LIANG J,XING D,LI Z,et al.TRIM59 is upregulated and promotes cell proliferation and migration in human osteosarcoma[J].Mol Med Rep,2016,13(6):5200-5206.
[9] ZHAN W,HAN T,ZHANG C,et al.TRIM59 promotes the proliferation and migration of non-small cell lung cancer cells by upregulating cell cycle related proteins[J].PLoS One,2015,10(11):e142596.
[10] 李佳玄.TRIM59的研究进展[C].北京:全国免疫学学术大会,2015:56-57.
[11] KHATAMIANFAR V,VALIYEVA F,RENNIE PS,et al.TRIM59,a novel multiple cancer biomarker for immunohistochemical detection of tumorigenesis[J].BMJ Open,2012,2(5).
[12] 张可华,宋建国.EMT与肿瘤[J].生命的化学,2008,5(5):523-526.
[13] DE CRAENE B,BERX G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat Rev Cancer,2013,13(2):97-110.
[14] 韩溟,许丽艳.恶性肿瘤中MMP-9表达调控机制研究进展[J].国外医学·分子生物学分册,2003,20(1):24-26.
[15] WANG Q,YU W,HUANG T,et al.RUNX2 promotes hepatocellular carcinoma cell migration and invasion by upregulating MMP9 expression[J].Oncol Rep,2016,36(5):2777-2784.
[16] VAN KEMPEN LC,COUSSENS LM.MMP9 potentiates pulmonary metastasis formation[J].Cancer Cell,2002,2(4):251-252.

