不同工艺处理对野生猕猴桃酒品质的影响
陈红梅,王沙沙,尹何南,董 喆,袁春龙,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨陵 712100;2.陕西省葡萄与葡萄酒工程研究中心,陕西 杨陵 712100)
野生猕猴桃,又称羊桃,鬼桃[1-2],猕猴桃科(Antinidiaceae)猕猴桃属(Antinidia)果实。营养丰富,利用价值高[3],近年来猕猴桃果汁、果脯、果醋、果酒等产品层出不穷。猕猴桃酒清亮透明,具有浓郁果香和醇厚酒香[4],深受人们喜爱。目前,猕猴桃酒主要采用清汁发酵,果实利用率低,成本高,但对于种质资源丰富、产量大、果胶含量高、果实小的野生猕猴桃而言相对较难。Fattouch等[5]研究发现猕猴桃皮不仅可以食用,还具有淡淡的青草味,酯、醇、萜、酚醛树脂类香气含量较高[6],氨基酸、钾、钙等对人体健康有益的物质含量也较高[7-8]。带皮发酵是红葡萄酒酿造的基本工艺,可将果皮、果籽中的多酚类物质尽可能多的转移到酒中[9]。猕猴桃带皮发酵同样可将皮中的营养物质转移到酒中,Yong[10]、杜昌陈[11]等研究发现将果皮添加到发酵液中可提高酒的香气质量及抗氧化能力,酚类物质及酚醛类物质的溶出还可改变酒体外观[12],增强酒体结构[13],影响酒的品质。长期饮用可达到预防动脉硬化和冠心病的发生[14]。目前,关于野生猕猴桃酒的研究多集中在发酵参数优化及香气[15]、果酒澄清、降酸[16]、稳定、酵母筛选等方面,而利用全果浆发酵的研究多以发酵条件[17]、多酚类物质变化及其抗氧化活性为主[18],关于不同发酵工艺对野生猕猴桃酒香气及感官分析的研究较少。酒的香气是评价酒品质好坏的重要标准,直接影响消费者对酒的整体评价[19],而感官评价是鉴别酒品质的最直观、快速、有效的方法。本实验通过对比分析清汁发酵、混汁发酵及带皮发酵不同酿造工艺野生猕猴桃酒的理化指标、香气及感官评价,旨在优化野生猕猴桃酒的酿造工艺,为其深加工提供理论参考和实践指导。
1 材料与方法
1.1 材料与试剂
野生猕猴桃(糖度10%,pH 3.13,可滴定酸18.30 g/L),于2015年12月采自陕西秦岭,样品采回后立即放入冷库贮存(4 ℃),在糖度12%~14%时进行野生猕猴桃的加工酿造处理。
白砂糖 市售;商业酿酒酵母OFD 德国Erbsloh集团;果胶酶 上海鼎唐国际贸易有限公司;2-辛醇(纯度99.5%) 美国Sigma公司。
1.2 仪器与设备
HH-S6恒温水浴锅 上海森信试验仪器有限公司;WZS 80手持折光仪 上海仪电物理光学仪器有限公司;PHS-3S雷磁pH计 上海精密科学仪器有限公司;TW323电子天平、6890 GC和5975 MS气相色谱-质谱联用仪美国Agilent公司;UV-2450紫外分光光度计 日本岛津公司;DB-Wax色谱柱(30 m×0.25 mm,0.25 μm)美国Thermo公司;PC-420D萃取磁力加热仪、搅拌棒(20 mm×0.5 mm) 美国Corning公司。
1.3 方法
1.3.1 野生猕猴桃酒的酿造工艺流程
依据小容器酿造法[20]进行酿酒。工艺流程及操作要点如下:
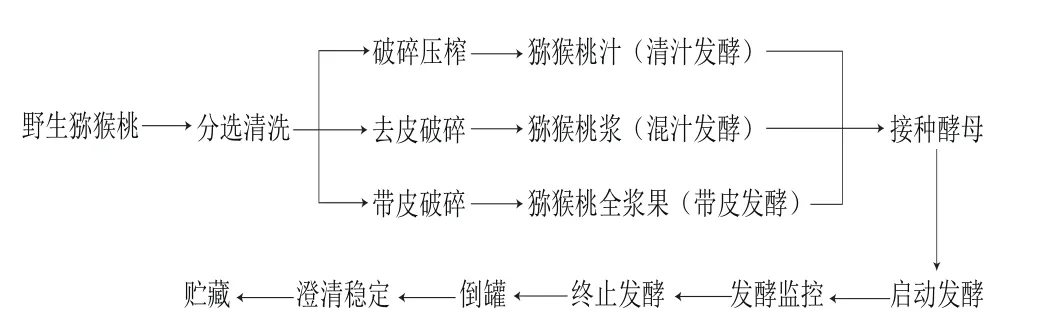
选择成熟度较为一致,无腐烂变质的野生猕猴桃3 组;分别破碎入罐(清汁发酵需在果胶酶酶解后进行压榨取汁并澄清,混汁发酵去皮后进行破碎入罐,带皮发酵直接将蒸馏水清洗过的野生猕猴桃破碎入罐),添加60 mg/L(6% H2SO3)的SO2防止氧化;分别加入40 mg/L的果胶酶(1440 PE/g)以提高果实出汁率,室温酶解12 h;蒸馏水和野生猕猴桃汁以体积比1∶1加入三角瓶中,置于37 ℃恒温水浴锅内活化20 min,接种酵母200 mg/L,启动发酵,温度控制在(18±2)℃;在发酵旺盛期,根据目标乙醇体积分数(12%)添加白砂糖。整个过程中进行发酵监控(测定温度和比重)。发酵结束(残糖<4 g/L)后置于4 ℃冷库中进行自然冷却澄清,最后将冷稳定猕猴桃酒的游离SO2调节至30 mg/L左右,装瓶于冷库中用于香气测定和感官品尝。除不同酿造工艺外,其他条件基本一致。
1.3.2 常规指标的测定
还原糖(葡萄糖计)、总酸(酒石酸计)、可溶性固形物、pH值、游离SO2、挥发酸(醋酸计)、乙醇体积分数等常规指标的测定参照王华[21]的方法。2,6-二氯靛酚法测定VC含量,参照GB/T 15038—2006《葡萄酒、果酒通用实验方法》。所有指标均重复测定3 次。
1.3.3 香气成分搅拌棒萃取-气相色谱-质谱测定
1.3.3.1 香气物质的提取
采用搅拌棒吸附萃取法,按照Delgado[22]与Song Jiangqiang[23]等方法稍作改动。20 mL酒样置于50 mL样品瓶中,加入60 µL内标2-辛醇,放入搅拌棒后用瓶塞密封,置于磁力搅拌器上,室温条件下萃取60 min,转子转速1 100 r/min。萃取结束后,用镊子将搅拌棒小心取出,经色谱级蒸馏水反复冲洗后,用吸水纸吸干水分,放入热解玻璃管中,待测。
1.3.3.2 香气成分的GC-MS分析
色谱条件:DB-Wax色谱柱(30 m×0.25 mm,0.25 μm);以He为载气;流速1 mL/min;升温程序:40 ℃保持3 min,随后4 ℃/min升至160 ℃,7 ℃/min升至230 ℃,保持8 min;连接杆温度230 ℃;脱附流速45 mL/min;加热阀温度245 ℃,脱附温度270 ℃;脱附15 min;传输线温度25.5 ℃;冷阱捕集温度-30 ℃,以40 ℃/min升至255 ℃(二级解析冷阱温度);分流比3∶1。
质谱条件:电子电离源;离子源温度230 ℃;电子能量70 eV;灯丝流量0.2 mA;检测器电压350 V;全扫描,质量扫描范围45~450 u,每秒扫描1 次。
1.3.4 不同酿造方式野生猕猴桃酒感官分析
参照葡萄酒感官评价方法[24]。由10 名接受过专业感官培训的学生组成感官品尝小组(男性5 人,女性5 人)。将需品尝酒样进行随机编号,小组成员分别从外观(15 分,颜色10 分、澄清度5 分)、香气(30 分,纯正度6 分、浓郁度8 分、质量16 分)、口感(44 分,纯正度6 分、浓郁度8 分、持久性8 分、质量22 分)及整体平衡性(11 分)4 个方面对不同工艺野生猕猴桃酒进行比较品尝,打分并描述(香气描述根据已给出的词汇进行选择)。最后对品尝评分表的品尝结果进行整理与统计分析。
1.3.5 香气成分定性定量
通过对色谱峰对应的质谱图进行解析,并在质谱图中进行计算机检索,确定化合物结构等基本信息,进行香气的定性分析。采用内标法(2-辛醇)进行半定量分析,通过比较待测组分与内标物峰面积的比值,校正后计算出待测组分的质量浓度。按下式计算:

1.3.6 特征香气成分的确定
特征香气有气味活性值(odor activity value,OAV)确定,当OAV不小于1时即被确定为特征香气物质,计算公式为:OAV=某香气物质浓度/该物质感觉阈值。
1.3.7 感官评价定量描述分析
感官评价定量描述分析(quantitative descriptive analysis,QDA)是利用统计方法对感官测得的数据进行分析,为一种定性定量相结合的描述分析检验方法。经过统一培训的品评员,对不同工艺的野生猕猴桃酒根据品评表进行打分描述,通过对评价得分及香气特征描述词进行均一化处理,处理结果采用雷达图表示。
1.4 数据处理
采用SPSS 17.0软件和Excel 2010软件进行数据处理,结果表示为s;用Origin 9软件进行作图。
2 结果与分析
2.1 不同方式发酵酒的基本理化指标
由表1可知,3 种工艺制备的野生猕猴桃酒乙醇体积分数在10.27%~10.53%之间,与清汁发酵相比,带皮渣发酵与混汁发酵酒的乙醇体积分数较低、残糖含量相对较高,这可能是因为皮渣在果胶酶作用下释放出了酵母菌难以利用的多糖,同时,带皮发酵过程中将产生更多的柠檬酸,柠檬酸可螯合酒中的二价金属离子从而抑制微生物的生长[25],即通过螯合酒中的钙离子和镁离子来抑制酿酒酵母菌的生长[26-27]。此外,果皮浸渍会将更多的酚类物质转移到酒中,而酚类物质含量也会影响酵母菌的活性,且酚类物质含量越高,抑菌效果越强[28]。

表1 不同酿造工艺猕猴桃酒基本理化指标Table1 Physicochemical properties of kiwifruit wines fermented from clear and cloudy juice and whole fruits
混汁发酵VC质量浓度为988.35 mg/L,显著高于清汁发酵发酵(845.47 mg/L),低于带皮发酵(1 082.32 mg/L),带皮渣发酵采用破碎后直接入罐,节约工艺时间,简化工艺操作;此外,浸渍作用将果皮、果籽中大量的酚类物质溶出至酒中[29],增强抗氧化能力[30-31],减少VC损失。
带皮发酵(0.39 g/L)和清汁发酵(0.55 g/L)野生猕猴桃酒的挥发酸质量浓度均高于混汁发酵(0.23 g/L),虽然挥发酸质量浓度在不同工艺发酵酒中有显著性差异(P<0.05),但都在国家标准范围内且质量浓度相对较低。清汁发酵酒中的总酸质量浓度(18.97 g/L)显著高于混汁发酵(18.16 g/L)、带皮发酵(17.75 g/L)猕猴桃酒(P<0.05),由于混汁发酵和带皮发酵的浸渍作用,果皮、果肉及果籽中的金属离子转移到猕猴桃果汁中,钾离子、钙离子与酒石酸反应生成酒石酸钾络合物,使得总酸含量降低,对于酸含量高的野生猕猴桃酒有一定的降酸作用。
2.2 不同酿造工艺对野生猕猴桃酒香气成分的影响
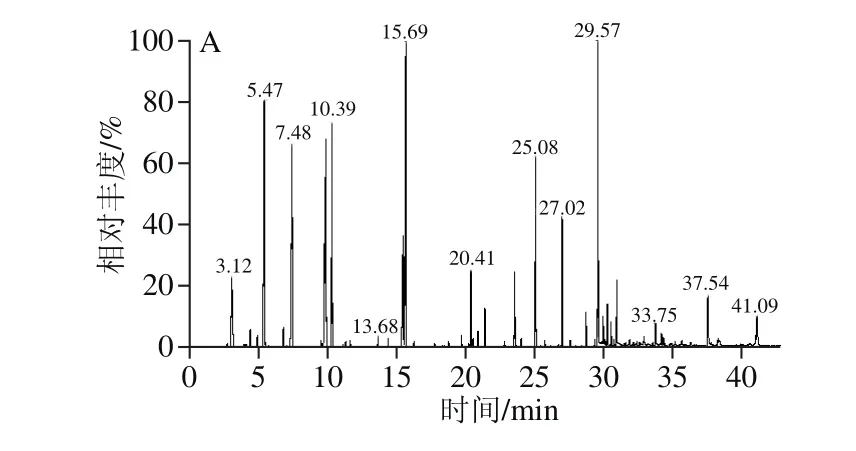
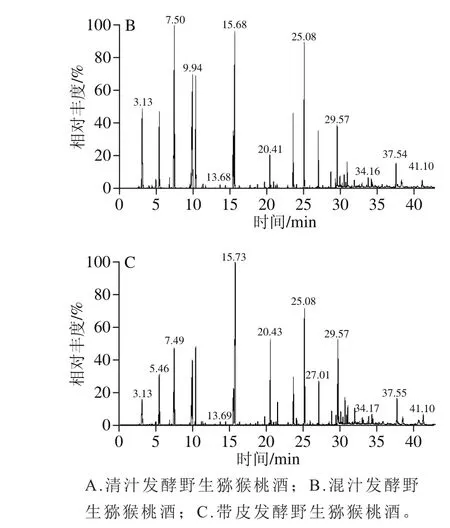
图1 不同酿造猕猴桃酒香气成分GC-MS总离子流图Fig. 1 GC-MS total ion current of kiwifruit wines
根据图1与标准质谱库进行检索对照,根据匹配度及化合物在质谱柱上保留指数,查阅文献将香气化合物进行定性,再根据内标法进行定量分析。具体结果见表2。

表2 不同发酵方式野生猕猴桃酒的香气成分变化GC-MS分析结果Table2 GC-MS analysis results of aroma components of kiwifruit wines

续表2
续表2
由表2可知,采用气相色谱-质谱在3 种酒样中共鉴定出74 种香气成分,包括酯类35 种、醇类9 种、酸类11 种、酮类3 种、萜烯类11 种、烷类2 种、挥发性酚类物质2 种及呋喃类1 种,其中共有物质32 种。
清汁发酵野生猕猴桃酒中,共检测出51 种香气成分,占总峰面积的90.73%。其中,酯类54.96%、醇类21.98%、酸类15.18%、酮类1.09%、烷类0.35%、萜烯类4.66%以及其他。其主要香气成分为丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、异戊醇、苯乙醇、癸酸,相对含量分别为11.12%、9.93%、8.07%、13.54%、15.38%、5.74%、8.05%。
在混汁发酵野生猕猴桃酒中,共检测出50 种香气成分,占总峰面积的88.65%。其中酯类58.76%、醇类23.21%、酸类10.82%、酮类1.99%、萜烯类3.63%及其他。主要香气成分为乙酸乙酯、丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、异戊醇、苯乙醇,相对含量分别为8.42%、5.94%、15.70%、6.60%、11.92%、15.27%、7.19%。
在带皮发酵野生猕猴桃酒中,共检测出56 种香气成分,占总峰面积的96.73%。酯类63.39%、醇类18.84%、酸类8.65%、酮类0.99%、烷类2.05%、萜烯类4.61%及其他。主要香气成分为丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、癸酸乙酯、异戊醇、苯乙醇,相对含量分别为5.27%、9.21%、6.41%、23.48%、5.98%、10.25%、7.44%。
综上所述,混汁发酵的香气总量(32 894.23 μg/L)高于清汁发酵(26 956.18 μg/L),低于带皮发酵(37 652.93 μg/L),三者之间存在显著性差异(P<0.05)。且带皮发酵中有香气物质56 种,清汁发酵中有51 种,混汁发酵中仅有50 种。通过对香气物质总量及种类的分析初步发现,带皮发酵可能赋予野生猕猴桃酒更丰富浓郁的香气。Selli等[32]研究发现,阿比洛果皮添加可以提高该葡萄酒的香气。
2.3 不同酿造方式野生猕猴桃酒香气成分的比较
2.3.1 酯类组分比较
酯类物质通常是在酒精发酵中形成,常赋予果酒以果类香气,是酒中香气组成的重要物质,影响着酒的香型及风格,并且在不同酒中酯类物质的组成及含量差异较大。本实验检测出在带皮发酵酒中的酯类物质质量浓度最高(23 979.90 μg/L),其次是混汁发酵(19 329.10 μg/L),清汁发酵的最低(14 813.79 μg/L),且差异显著(P<0.05)。不同酿造工艺的猕猴桃酒中共检测到35 种酯类化合物,3 种酒中共存的香气物质15 种,辛酸乙酯占主导。己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸苯乙酯在带皮发酵中的质量浓度显著高于清汁发酵和混汁发酵,赋予带皮发酵猕猴桃酒更浓郁的青苹果、脂肪味、茴香及花香;乙酸乙酯、乙酸异戊酯在混汁发酵中的质量浓度高于清汁发酵和带皮发酵,2 种高质量浓度的乙酸酯类香气带给混汁发酵酒更多果香;丁酸乙酯在清汁发酵中质量浓度最高,使得清汁发酵酒中的酸果类香气更浓郁。
2.3.2 醇类组分比较
适量的醇类物质可赋予酒特殊的气味,并有衬托酯香的作用,使香气更加完美,同酯类物质一样既是芳香物质又是呈味物质。醇类物质的含量及各种醇之间的比例,对酒的风味有重要的影响。本研究中,混汁发酵(7 635.11 μg/L)醇类物质质量浓度高于带皮发酵(7 093.82 μg/L)及清汁发酵(5 924.38 μg/L)。不同酿造方式野生猕猴桃酒中共检出醇类物质9 种,3 种酒中共存的物质有2 种分别是异戊醇、苯乙醇,且异戊醇在混汁发酵酒中质量浓度较高,而苯乙醇在带皮发酵酒中质量浓度较高。通常醇类物质有强烈的化学味、辛辣味以及草本气味,给果酒酒香带来负面影响,但也赋予酒以迷人的花香、果香及蜂蜜类香气。如异戊醇有尖刺气息及讨厌的味道,含量相当时具有明显的青草、植物香气,且香气持久怡人;苯乙醇也不同于其他醇类物质,具有迷人的玫瑰花香、紫罗兰花香气、茉莉花香等多样风味,还具有一定的杀菌作用。
2.3.3 酸类组分比较
酒中的挥发酸和脂肪酸通常是源于果实及酒精发酵。不同酿造工艺野生猕猴桃酒中共检测出酸类物质11 种,共同含有的物质有5 种,果酒中的酸类物质能与其他香味物质共同组成果酒固有的芳香。此外,酸类化合物对香味成分起缓冲作用,酸过少会使酒味寡淡后味短;酸过量时酸味露头酒味粗糙,使酒的品质严重下降。清汁发酵酒中的酸类物质质量浓度最高(4 092.70 μg/L),混汁发酵次之(3 559.57 μg/L),带皮发酵中的最低(3 256.49 μg/L),这也可能是清汁发酵酒中可滴定酸含量较高的原因之一。辛酸、9-癸烯酸、癸酸在清汁发酵酒中的质量浓度较高,Z-11-十六烯酸、己酸、肉豆蔻酸在带皮发酵酒中的质量浓度最高,这些香气化合物将赋予野生猕猴桃酒更为丰富浓郁的奶酪、乳香及稍有不适的脂肪味。
2.3.4 萜烯类组分比较
不同酿造工艺猕猴桃酒中共检测出11 种萜烯类物质,共同含有的物质有6 种,角鲨烯的质量浓度在萜烯类总量中所占比例最高。带皮发酵酒中萜烯类物质含量最高(1 736.25 μg/L),其次是清汁发酵(1 256.47 μg/L),混汁发酵中的最低(1 192.83 μg/L)。桉油精、橙花叔醇、金合欢醇、薄荷脑及角鲨烯等物质均在带皮发酵中质量浓度相对较高。萜烯类物质的感觉阈值一般较低,因此其香气OAV较高[33],对猕猴桃酒芳香风格具有重要的影响,如本实验测出的橙花叔醇、金合欢醇、薄荷脑等可赋予野生猕猴桃果酒迷人的树脂、迷迭、玫瑰及薰衣草等香气。
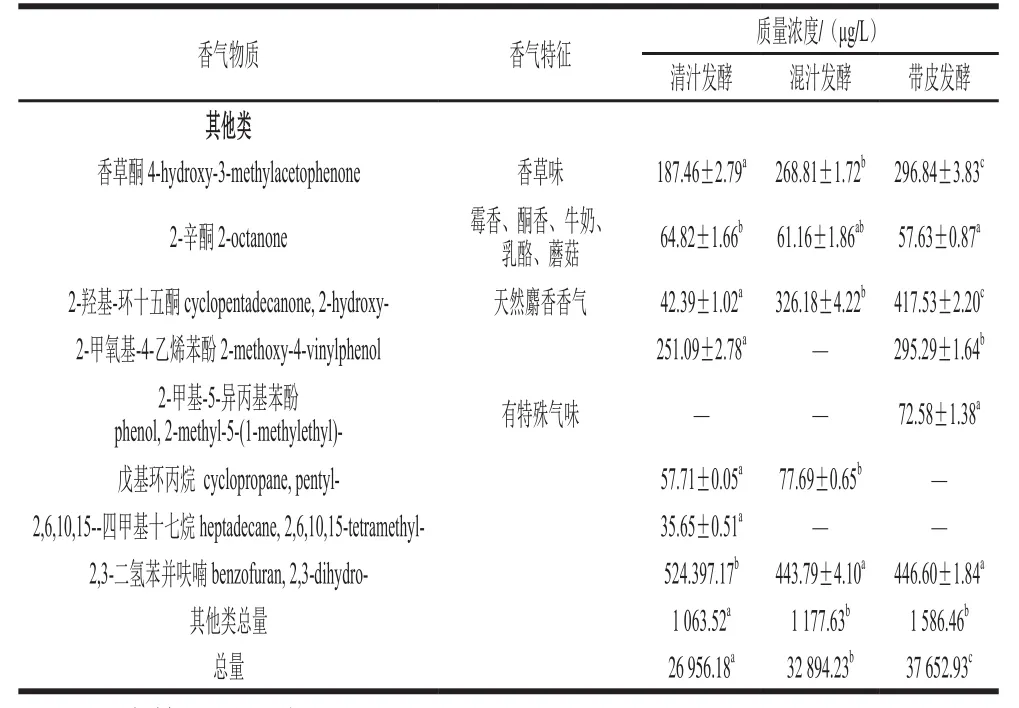
2.3.5 其他类组分香气比较
在3 种不同工艺发酵酒中还检测到了烷类物质2 种,酮类物质3 种、挥发性酚类物质2 种及呋喃1 种。这些挥发性香气物质种类较少且相对含量较低,感觉阈值低,香气OAV较高,如2-辛酮、香草酮等可赋予野生猕猴桃酒香草、牛奶、乳酪、蘑菇等香气,且不同物质之间的相互作用也将对猕猴桃酒的香气产生积极或负面的影响作用。
此外,野生猕猴桃酒的香气特征受外界条件和酒的基本理化的影响,如乙醇体积分数的升高会抑制挥发性香气成分的挥发[34],本实验中清汁发酵野生猕猴桃酒乙醇体积分数略高于混汁及带皮发酵,但是这不能完全说明乙醇体积分数是造成清汁发酵酒中香气成分总量降低的根本原因,只能说明乙醇体积分数会对香气的释放产生一定作用。
2.4 不同酿造工艺的野生猕猴桃酒特征香气比较分析
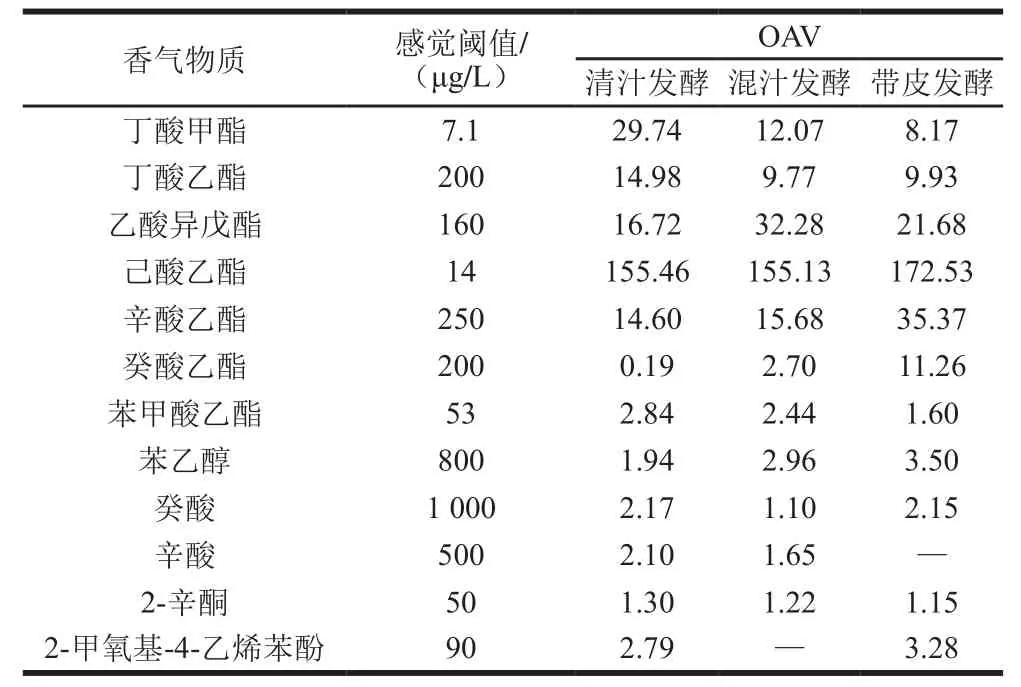
表3 不同工艺发酵野生猕猴桃酒特征香气成分OAV分析Table3 OAV analysis of aroma characteristics of kiwifruit wines
挥发性物质含量及种类直接影响到酒的香气特征,OAV是评价挥发性物质对酒的香气感官贡献率的常用方法[37],即当香气物质浓度大于感觉阈值(OAV>1)时,该挥发性物质才能被人类感觉出来。尽管如此,OAV小于1的挥发性物质也会对整体香气起一定的促进作用[38]。本实验根据已报道的香气物质的感觉阈值及其特征描述,结合实验结果得到12 种特征香气物质。由表3可知,不同工艺发酵野生猕猴桃酒的共有理论特征香气物质分别为:丁酸甲酯、丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、苯甲酸乙酯、苯乙醇、癸酸、2-辛酮。说明这些物质是野生猕猴桃酒的特征香气物质,不因发酵工艺不同而产生变化。癸酸乙酯在混汁及带皮发酵酒中的OAV大于1,且在带皮发酵酒中达11.26;辛酸在清汁及带皮发酵酒中的OAV大于1,在混汁发酵酒中未检测到;2-甲氧基-4-乙烯苯酚在清汁及混汁发酵酒中的OAV大于1,在带皮发酵酒中未检测到,说明不同酿造工艺特征香气种类有差别。己酸乙酯、辛酸乙酯、癸酸乙酯、苯乙醇、2-甲氧基-4-乙烯苯酚的OAV在带皮发酵酒中相对较高,赋予野生猕猴桃酒浓郁的果香、柑橘及植物类香气;丁酸甲酯、丁酸乙酯、苯甲酸乙酯、癸酸及2-辛酮在清汁发酵酒中的OAV相对较高,且赋予该野生猕猴桃酒浓郁的果香、脂肪香及奶香等香酯类香气;乙酸异戊酯在混汁发酵酒中的OAV相对较高,赋予该野生猕猴桃酒更为浓郁的香蕉味。不同工艺发酵野生猕猴桃酒的感官香气特征有一定差异,且各物质间相互作用及饮用环境都会对酒的感官特性产生较大的影响[39]。
2.5 不同酿造工艺的野生猕猴桃酒的感官QDA
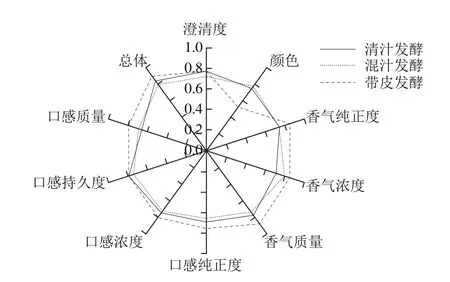
图2 不同酿造工艺的野生猕猴桃酒的感官QDAFig. 2 QDA analysis of sensory quality of kiwifruit wines
由图2可知,带皮发酵的野生猕猴桃酒在口感质量、口感浓度、口感纯正度、香气质量、香气浓度以及香气纯正度方面均高于清汁发酵和混汁发酵;清汁发酵在澄清度上高于带皮发酵,清汁发酵和混汁发酵在颜色上高于带皮发酵。综合来看,不同工艺处理对野生猕猴桃酒的感官质量影响较大,且带皮发酵有利于提高野生猕猴桃酒的口感及香气质量。
2.6 不同酿造工艺的野生猕猴桃酒香气QDA
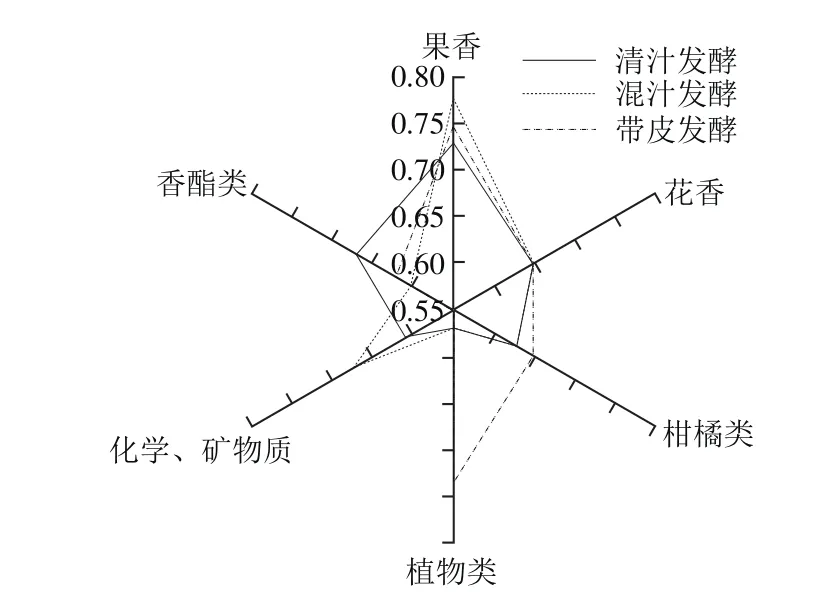
图3 不同酿造方式野生猕猴桃酒香气QDAFig. 3 QDA analysis of arom characteristics of kiwifruit wines
由图3可知,清汁发酵、混汁发酵和带皮发酵中酒的果香及花香相当;清汁发酒中的香酯类香气较为突出;混汁发酵酒中,化学与矿物质较为突出;带皮发酵酒中柑橘类、植物类香气特征均高于其他2 组,与香气分析结果较一致,可见带皮发酵可将皮中的香气物质得以保留,使野生猕猴桃酒更典型性。
3 结 论
本实验是比较清汁、带皮及混汁发酵野生猕猴桃酒品质的研究。对果实小、果胶含量高且产量大的野生猕猴桃的工业化生产有一定的应用价值和指导意义。结果表明:不同处理对野生猕猴桃酒的基本理化指标有一定的影响,带皮渣发酵野生猕猴桃酒VC质量浓度较高,而挥发酸质量浓度及乙醇体积分数较低。
不同酿造工艺野生猕猴桃酒的香气成分中,酯类和醇类物质占主导。带皮发酵使酒中的香气物质种类及质量浓度(37 652.93 μg/L)显著高于混汁发酵(32 894.23 μg/L)、清汁发酵(26 956.18 μg/L),酯类、萜烯类总量显著增大(P<0.05),酸类物质总量明显下降(P<0.05)。
不同酿造工艺野生猕猴桃酒的感观分析显示:带皮发酵的野生猕猴桃酒在口感质量、口感浓度、口感纯正度、香气质量、香气浓度、香气纯正度及整体平衡性均高于清汁发酵和混汁发酵;此外,带皮发酵以果香、花香、柑橘类及植物类香气为主,柑橘类及植物类较为突出,很好的保留了果皮、果肉中的香气物质。因此,带皮发酵在提高生产效益的同时,也在一定程度上提高了野生猕猴桃酒的香气及口感质量,突出了野生猕猴桃的典型性特征,此工艺的最佳条件及适用性还有待研究。
[1] 徐小彪, 张秋明. 中国猕猴桃种质资源的研究和利用[J]. 植物学通报, 2003, 20(6): 648-655. DOI:10.3969/j.issn.1674-3466.2003.06.002.
[2] HASSALL A K, PRINGLE G J, MACRAE E. A. Development,maturation, and postharvest responses of Actinidia arguta (Sieb. et Zucc.) Planch, ex Miq. fruit[J]. New Zealand Journal of Crop and Horticultural Science, 1998, 26(2): 95-108. DOI:10.1080/01140671.19 98.9514046.
[3] CASSANO A, DONATO L, CONIDI C, et al. Recovery of bioactive compounds in kiwifruit juice by ultrafiltration[J]. Innovative Food Science and Emerging Technologie, 2008, 9(4): 556-562.DOI:10.1016/j.ifset.2008.03.004.
[4] ZHAO Z S, WEI N, FU W N, et al. Study on fermentation technology of kiwi wine[J]. 中国食品科学(英文版), 2012(1): 1-3.
[5] FATTOUCH S, CABONI P, CORONEO V, et al. Comparative analysis of polyphenolic profiles and antioxidant and antimicrobial activities of Tunisian pome fruit pulp and peel aqueous acetone extracts[J].Journal of Agricultural & Food Chemistry, 2008, 56(3): 1084-1090.DOI:10.1021/jf072409e.
[6] GARCIA C V, QUEK S Y, STEVENSON R J, et al. Characterisation of bound volatile compounds of a low flavour kiwifruit species: Actinidia eriantha[J]. Food Chemistry, 2012, 134(2): 655-661. DOI:10.1016/j.foodchem.2012.02.148.
[7] HEO B G, PARK Y S, IM M H, et al. Physical and chemical composition,anti-microbial activity and cytotoxicity of kiwifruit skin[J]. The Korean Journal of Community Living Science, 2009, 20(1): 61-69.
[8] JIN G K, BEPPU K, KATAOKA I. Varietal differences in phenolic content and astringency in skin and flesh of hardy kiwifruit resources in Japan[J]. Scientia Horticulturae, 2009, 120(4): 551-554.DOI:10.1016/j.scienta.2008.11.032.
[9] KATALINIC V, MILOS M, MODUN D, et al. Antioxidant effectiveness of selected wines in comparison with (+)-catechin[J]. Food Chemistry,2004, 86(4): 593-600. DOI:10.1016/j.foodchem.2003.10.007.
[10] YONG S P, SUWANMANON S, TOWANTAKAVANIT K, et al. Quality change of ‘Hayward’ (Actinidia deliciosa) kiwifruit wine influenced by skin addition[J]. 한국원예학회 학술발표요지, 2011, 10: 118.
[11] 杜昌陈, 余元善, 肖更生, 等. 添加柚果皮对沙田柚蒸馏酒风味品质的影响[J]. 广东农业科学, 2015, 42(17): 90-95. DOI:10.16768/j.issn.1004-874x.2015.17.009.
[12] PÉREZMAGARIÑO S, GONZÁLEZSAN J M L. Evolution of flavanols, anthocyanins, and their derivatives during the aging of red wines elaborated from grapes harvested at different stages of ripening[J]. Journal of Agricultural & Food Chemistry, 2004, 52: 1181-1189. DOI:10.1021/jf035099.
[13] AMOS R L. Sensory properties of fruit skins[J]. Postharvest Biology & Technology, 2007, 44(3): 307-311. DOI:10.1016/j.postharvbio.2006.12.007.
[14] SELLI S, CABAROGLU T, CANBAS A, et al. Effect of skin contact on the aroma composition of the musts of Vitis vinifera L. cv. Muscat of Bornova and Narince grown in Turkey[J]. Food Chemistry, 2003,81(3): 341-347. DOI:10.1016/j.foodchem.2004.11.019.
[15] 王励治. 野生猕猴桃干酒酿造工艺及其香气成分研究[D]. 重庆: 西南大学, 2011.
[16] 张占洋. 酒酒球菌在野生猕猴桃酒中降酸作用的初步研究[D]. 洛阳: 河南科技大学, 2013.
[17] 张超, 徐洲, 游玲, 等. 野生猕猴桃果酒带渣发酵的研究[J]. 食品研究与开发, 2012, 33(8): 23-27.
[18] 周丽萍, 王化, 李梦莎, 等. 野生软枣猕猴桃的多酚含量及抗氧化能力研究[J]. 黑龙江科学, 2016, 7(12): 14-15.
[19] HIROYUKI K, HEATHER L, JANUSZ P. Applications of solid-phase microextraction in food analysis[J]. Journal of Chromatography A,2000, 880(1/2): 35-36. DOI:10.1016/S0021-9673(00)00309-5.
[20] 李华. 小容器酿造葡萄酒[J]. 酿酒科技, 2002(4): 70-71.DOI:10.3969/j.issn.1001-9286.2002.04.023.
[21] 王华. 葡萄酒分析检验[M]. 北京: 中国农业出版社, 2004.
[22] DELGADO R. Development of a stir bar sorptive extraction method coupled to gas chromatography-mass spectrometry for the analysisof volatile compounds in Sherry brandy[J]. Analytica Chimica Acta,2010, 672(1/2): 130-136. DOI:10.1016/j.aca.2010.05.015.
[23] SONG J Q, KRISTA C S, WANG H, et al. Influence of deficit irrigation and kaolin particle film on grape composition and volatile compounds in Merlot grape (Vitis vinifera L.)[J]. Food Chemistry,2012, 134(2): 841-850. DOI:10.1016/j.foodchem.2012.02.193.
[24] 苏鹏飞. 宁夏青铜峡产区主栽红色酿酒葡萄成熟度控制指标的研究[D]. 杨陵: 西北农林科技大学, 2016.
[25] BRUL S, COOTE P. Preservative agents in foods. Mode of action and microbial resistance mechanisms[J]. International Journal of Food Microbiology, 1999, 50(1/2): 1-17. DOI:10.1016/S0168-1605(99)00072-0.
[26] LAWRENCE C L, BOTTING C H, ANTROBUS R, et al. Evidence of a new role for the high-osmolarity glycerol mitogen-activated protein kinase pathway in yeast: regulating adaptation to citric acid stress[J].Molecular & Cellular Biology, 2004, 24(8): 3307-3323. DOI:10.1128/MCB.24.8.3307-3323.2004.
[27] NIELSEN M K, ARNEBORG N. The effect of citric acid and pH on growth and metabolism of anaerobic Saccharomyces cerevisiae and Zygosaccharomyces bailii cultures[J]. Food Microbiology, 2007,24(1): 101-105. DOI:10.1016/j.fm.2006.03.005.
[28] 毕慧敏. 三种含笑叶片提取物的抑菌作用研究[D]. 南京: 南京林业大学, 2008.
[29] FIORENTINO A, D’ABROSCA B, PACIFICO S, et al. Identification and assessment of antioxidant capacity of phytochemicals from kiwi fruits[J]. Journal of Agricultural & Food Chemistry, 2009, 57(10):4148-4155. DOI:10.1021/jf900210z.
[30] 成宇峰, 岳泰新, 张振文. 不同工艺酿造猕猴桃新酒抗氧化性的研究[J]. 酿酒科技, 2015(6): 20-22. DOI:10.13746/j.njkj.2014492.
[31] PALOMO E S, GONZÁLEZ-VIÑAS M A, DÍAZ-MAROTO M C,et al. Aroma potential of Albillo wines and effect of skin-contact treatment[J]. Food Chemistry, 2007, 103(2): 631-640. DOI:10.1016/j.foodchem.2006.08.033.
[32] SELLI S, CANBAS A, CABAROGLU T, et al. Aroma components of cv.Muscat of Bornova wines and influence of skin contact treatment[J]. Food Chemistry, 2006, 94(3): 319-326. DOI:10.1016/j.foodchem.2004.11.019.
[33] 丁吉星, 何玉云, 梁艳英, 等. 新型嘉宝果起泡酒香气成分及特征香气分析[J]. 食品科学, 2014, 35(24): 145-150. DOI:10.7506/spkx1002-6630-201424028.
[34] ROBINSON A L, EBELER S E, HEYMANN H, et al. Interactions between wine volatile compounds and grape and wine matrix components influence aroma compound headspace partitioning[J].Journal of Agricultural & Food Chemistry, 2009, 57(21): 10313-10322. DOI:10.1021/jf902586n.
[35] TAO Y, ZHANG L. Intensity prediction of typical aroma characters of cabernet sauvignon wine in Changli County (China)[J]. LWT-Food Science and Technology, 2010, 43(10): 1550-1556. DOI:10.1016/j.lwt.2010.06.003.
[36] ANTALICK G, PERELLO M C, REVEL G D. Development,validation and application of a specific method for the quantitative determination of wine esters by headspace-solidphase microextraction-gas chromatography-mass spectrometry[J].Food Chemistry, 2010, 121(4): 1236-1245. DOI:10.1016/j.foodchem.2010.01.011.
[37] MOYANO L, ZEA L, MORENO J, et al. Analytical study of aromatic series in sherry wines subjected to biological aging[J].Journal of Agricultural & Food Chemistry, 2002, 50(25): 7356-7361.DOI:10.1021/jf020645d.
[38] 陶永胜, 彭传涛. 中国霞多丽干白葡萄酒香气特征与成分关联分析[J]. 农业机械学报, 2012, 43(3): 130-139. DOI:10.6041/j.issn.1000-1298.2012.03.025.
[39] SOUFLEROS E H, PISSA I, PETRIDIS D, et al. Instrumental analysis of volatile and other compounds of Greek kiwi wine; sensory evaluation and optimisation of its composition[J]. Food Chemistry,2002, 75(4): 487-500. DOI:10.1016/S0308-8146(01)00207-2.

