纳米αFe2O3对牙髓干细胞增殖及骨向分化和矿化能力的影响
夏 阳 陈慧敏 胡姝颖 孙剑飞 章非敏,3 顾 宁,3
(1东南大学江苏省生物材料与器件重点实验室, 南京 210009)(2南京医科大学口腔疾病研究江苏省重点实验室, 南京 210029)(3苏州纳米科技协同创新中心, 苏州 215123)
赤铁矿型氧化铁(αFe2O3)是最简单的铁氧化物,广泛存在于自然界中.它是室温下最稳定的铁氧化物,不易腐蚀,不会被氧化或还原,具有无毒、价格低廉、耐候性良好、抗腐蚀能力强等特点,在气体传感、催化、医药等领域应用广泛.此外,它还是一种重要的半导体材料,在光催化降解环境污染物、光解水制氢以及锂离子电池领域有广泛的应用.
近年来,随着对αFe2O3纳米材料应用研究的深入,其相关的生物学性质研究也引起了广泛关注.例如,Zhang等[1]研究了不同粒径纳米αFe2O3对Caco-2细胞的吸附和毒性效应,发现粒径对纳米颗粒与细胞之间的吸附行为具有显著影响.Bhattacharya等[2]研究了纳米级和微米级αFe2O3颗粒对人肺细胞的毒性.目前,笔者尚未查阅到关于纳米αFe2O3对多潜能分化干细胞增殖和成骨分化影响的研究报道.相关研究大都围绕着氧化铁的另一种晶型——磁赤铁矿(γFe2O3)展开.γFe2O3因其独特的磁学性能在磁共振成像检测、生物医学、组织工程等领域应用广泛.文献[3-4]指出,一定浓度的纳米γFe2O3对骨髓基质干细胞和牙髓干细胞无毒性,不影响其存活、增殖及成骨分化能力.因此,需要研究纳米αFe2O3对多潜能分化干细胞的作用,以比较不同晶型和磁学性质的纳米铁对细胞的作用效果,探索其对细胞的作用机制,以更好地开发纳米铁在生物医学和组织工程领域内的应用.
本文制备了二巯基丁二酸(DMSA)包裹的纳米αFe2O3,采用透视电镜(TEM)观察其形貌,利用振动样品磁强计(VSM)检测其磁学性质,并研究了纳米αFe2O3对人牙髓干细胞活力、增殖和成骨分化的影响.
1 材料与方法
1.1 主要试剂和仪器
人牙髓间充质干细胞(humane dental pulp stem cells hDPSCs)由美国马里兰牙学院Pro Xu Hockin惠赠;αFe2O3和二巯基丁二酸(DMSA)购自中国阿拉丁公司;DMEM培养基、胎牛血清以及质量分数为0.25%的胰酶购自美国GBICO公司;CCK-8购自美国恩佐生化公司;碱性磷酸酶(ALP)试剂盒购自日本和光纯药工业株式会社;蛋白定量试剂盒Pierce BCA Protein Assay Kit购自美国赛默飞世尔公司;细胞荧光染料购自美国英杰生命技术有限公司;青/链霉素、二甲基亚砜(DMSO)、β-甘油磷酸钠、胰蛋白酶、地塞米松、抗坏血酸、茜素红购自美国Sigma公司.使用仪器包括日本电子株式会社的JSM-840型扫描电镜、美国MolecularDevices公司的SpectraMax M5型酶标仪、日本电子株式会社的JEOL-7100型透射电子显微镜以及美国Lake Shore Cryotronics公司的Lakeshore 7470型振动样品磁强计.
1.2 αFe2O3的表面处理和形貌表征
将纳米αFe2O3稀释至约1 g/L,调节pH值为2.7,加入反应瓶中.称取铁质量1/4的DMSA,超声溶解于DMSO溶液中,然后加入Fe2O3溶液中搅拌反应5 h.反应结束后离心洗涤样品,将溶液装入透析袋中,用透析夹夹住袋口,放入装有双蒸水的烧杯中,搅拌24 h.透析后即可得到稳定的DMSA/αFe2O3胶体水溶液.利用TEM观察其形貌,采用振动样品磁强计测量其磁性.
1.3 实验分组
细胞培养采用完全培养基和骨向诱导培养基.细胞形貌和增殖实验中采用完全培养基,配方为DMEM培养基+体积分数10%的血清+体积分数1%的青霉素/链霉素;细胞分化实验中采用骨向诱导培养基,即在完全培养基中添加地塞米松、抗坏血酸、维生素D、β-甘油磷酸钠.细胞培养时将培养基作为对照组,αFe2O3培养基作为实验组,其中αFe2O3在培养基中的浓度为10 μg/mL.
1.4 细胞增殖测定
细胞以每孔5 000个接种于96孔板中,于37 ℃,包含体积分数为5% CO2的孵育箱内培养.在接种后的第1,4,7,14 d,每孔加入包含体积分数10% CCK-8的培养基孵育.培养箱内孵育2 h后,从各孔中吸取液体滴入96孔板中,于酶标仪上波长450 nm处检测其吸光度值.
1.5 细胞形态检测
细胞接种4 d后,将细胞浸没于荧光染料中后,在37 ℃孵箱中孵育15 min,然后用荧光显微镜检测死活细胞情况和细胞铺展状况.
1.6 碱性磷酸酶活性检测
在2种培养基中细胞培养14 d后,进行ALP检测.从孵箱中取出96孔板,采用PBS漂洗3遍,每孔加入50 μL体积分数为0.25%的TritonX-100,置于37 ℃孵箱中2 h.然后加入100 μL反应底物,再置于37 ℃孵箱中2 h,利用酶标仪于波长405 nm处测量吸光度.将测得的吸光度值除以蛋白定量检测值后进行统计分析,以排除不同细胞数对ALP值的影响.
1.7 茜素红染色
细胞培养21 d后,进行钙结节茜素红染色和定量检测.hDPSC经成骨诱导21 d,PBS清洗后,采用体积分数为1%的福尔马林固定30 min,质量分数为2%的茜素红染色30 min,PBS清洗后拍照.然后,采用质量分数为10%的氯化十六烷基吡啶溶液溶解矿化物,利用酶标仪于550 nm波长下检测吸光度.
1.8 统计学分析
所有定量数据均采用统计分析软件SPSS13.0进行独立样本t检验.每种细胞实验重复4次,结果以“均数±标准差”的形式表示,以p<0.05表示存在统计学差异.
2 结果与分析
透射电子显微镜结果显示,制备的αFe2O3呈棒状,尺寸约10 nm×90 nm,颗粒之间单分散(见图1).αFe2O3的形貌有纳米棒、颗粒、多面体以及由多面体组装的立方体,不同的制备方法和制备条件会产生不同形貌的αFe2O3[5].由此,可实现对纳米αFe2O3尺寸和形貌的可控合成[6-7].材料的尺寸、结构、组成、孔隙度和形貌对其性能产生不同的影响.在对细胞的作用上,材料尺寸、表面电荷和组成成分都会影响纳米粒子的细胞摄取[8-9].

图1 TEM照片
室温下通过VSM测得样品的磁滞回线,结果见图2.由图可知,制备的αFe2O3没有磁性,因此,可以排除磁性作用导致其产生的细胞效应.来自于磁性材料的剩磁作用可影响细胞的增殖和分化[10].
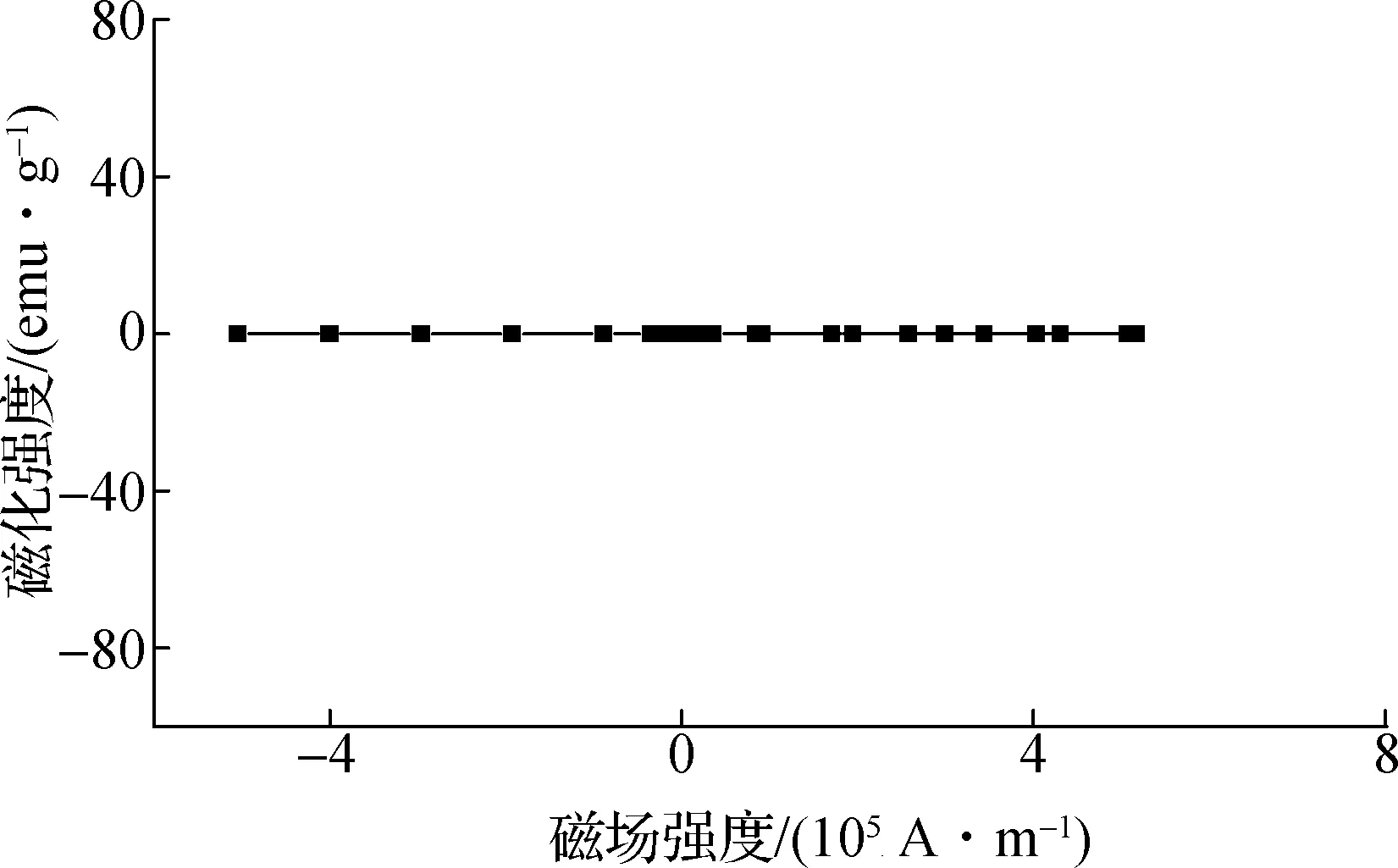
图2 αFe2O3颗粒的VSM检测结果
选用含纳米αFe2O3的完全培养基与牙髓干细胞共培养,纳米αFe2O3的浓度为10和100 μg/mL.细胞在αFe2O3培养基中培养4 d后,没有检测到表示死细胞的红色荧光影像.表示活细胞的绿色荧光图片显示,在10 μg/mL αFe2O3培养基和正常培养基对照组中,大量活细胞都已经完全铺展,呈现出典型的长梭状,细胞形貌与细胞密度无显著差异(见图3(a)和(b)).但是在100 μg/mL纳米αFe2O3的培养基中,培养的细胞形态发生了显著变化(见图3(c)).如图4所示,在4个检测时间点处,10 μg/mL αFe2O3培养基组与正常培养基对照组的细胞增殖结果之间均没有显著差异(p>0.05).但当纳米αFe2O3在培养基中的浓度达到100 μg/mL时,细胞增殖受到显著抑制,这与图3(c)显示的该浓度αFe2O3培养基对细胞形态的影响一致.当浓度为5,10,50 μg/mL时,则没有检测到这种不良作用.究其原因在于,高浓度下暴露出的铁颗粒内核可以催化产生ROS,激活氧化还原敏感性JNK信号通路[11],从而促进细胞凋亡[12].因此,选用质量浓度为10 μg/mL的纳米αFe2O3培养基进行后续的细胞成骨分化检测.

(a) 正常培养基

(b) 10 μg/mL纳米αFe2O3 培养基
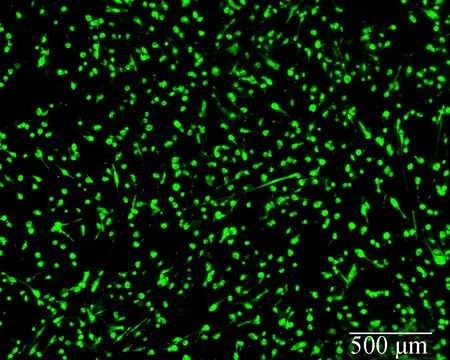
(c) 100 μg/mL纳米αFe2O3 培养基

图4 CCK-8检测细胞增殖结果
本研究中主要检测了ALP活性和矿化物形成量这2个细胞成骨分化指标.骨向诱导10 d后,2组细胞的ALP 活性分别为(0.89±0.15)和(1.68±0.20) mU/mg 蛋白.由结果可知,第2组细胞的ALP活性较对照组明显提高(p<0.01).骨向诱导21 d后,检测2组中细胞的矿化物形成量,结果见图5.由图可知,第2组细胞染色更深,矿化结节更厚.定量检测结果显示,2组细胞的矿化物相对形成量分别为1.0±0.11和3.45±0.29,即第2组细胞的矿化物形成量较对照组明显提高(p<0.01).

(a) 培养基

(b) 10 μg/mL纳米αFe2O3培养基
纳米材料对干细胞成骨分化的作用受纳米材料种类和浓度影响.文献[13-15]指出,不同种类和浓度的超顺磁性氧化铁纳米材料与骨髓间充质干细胞共培养,所得结果各不相同.关于αFe2O3对牙髓干细胞这种多潜能分化干细胞成骨分化影响的研究较少.文献[13]指出,纳米γFe2O3对骨髓干细胞成骨分化的促进作用与MAPK通路有关.本研究中的体外成骨分化实验结果表明,10 μg/mL的纳米αFe2O3对牙髓干细胞成骨分化有促进作用.
3 结论
1) 一定浓度的纳米αFe2O3对牙髓干细胞的形态和增殖没有影响.
2) 纳米αFe2O3可以对牙髓干细胞的成骨方向分化起到促进作用.
3) 本研究结果将为纳米αFe2O3在生物医学、骨组织工程等领域内的应用提供理论依据并奠定基础.
4) 下一步工作是使用普鲁士蓝染色,同时利用TEM检测细胞对纳米αFe2O3的摄入及纳米αFe2O3在细胞内的分布情况,并在基因和蛋白水平进一步验证纳米αFe2O3对牙髓干细胞成骨分化的影响.
)
[1] Zhang W, Kalive M, Capco D G, et al. Adsorption of hematite nanoparticles onto Caco-2 cells and the cellular impairments: Effect of particle size[J].Nanotechnology, 2010,21(35): 355103. DOI:10.1088/0957-4484/21/35/355103.
[2] Bhattacharya K, Hoffmann E, Schins R F, et al. Comparison of micro- and nanoscale Fe+3-containing (Hematite) particles for their toxicological properties in human lung cells in vitro[J].ToxicolSci, 2012,126(1): 173-182. DOI:10.1093/toxsci/kfs014.
[3] 陈小伍,方驰华,刘胜军,等.超顺磁性纳米铁粒子标记骨髓基质干细胞及对其分化能力的影响[J].中华神经医学杂志,2006,5(3):253-257.DOI:10.3760/cma.j.issn.1671-8925.2006.03.009.
Chen Xiaowu, Fang Chihua, Liu Shengjun, et al. Effect of superparamagnetic iron nanoparticle labeling on bone marrow stem cells’ abilities to survive, proliferate and differentiate into hepatocytes [J].ChinJNeuromed, 2006,5(3): 253-257. DOI:10.3760/cma.j.issn.1671-8925.2006.03.009.(in Chinese)
[4] 马亮,白玉,李明伟,等.超顺磁氧化铁纳米颗粒对人牙髓干细胞生物学影响的体内外研究[J].牙体牙髓牙周病学杂志,2016,26(7):387-395.DOI:10.15956/j.cnki.chin.j.conserv.dent.2016.07.001.
Ma Liang, Bai Yu, Li Mingwei, et al. The effects of superparamagnetic iron oxide nanoparticles on the biological activity of human dental pulp stem cells in vitro and in vivo [J].ChinaJConservDent, 2016,26(7): 387-395. DOI:10.15956/j.cnki.chin.j.conserv.dent.2016.07.001. (in Chinese)
[5] Supattarasakda K, Petcharoen K, Permpool T, et al. Control of hematite nanoparticle size and shape by the chemical precipitation method[J].PowderTechnology, 2013,249(11): 353-359.
[6] Lü B, Liu Z, Tian H, et al. Single-crystalline dodecahedral and octodecahedral α-Fe2O3particles synthesized by a fluoride anion-assisted hydrothermal method[J].AdvancedFunctionalMaterials, 2010,20(22): 3987-3996. DOI:10.1002/adfm.201001021.
[7] Yang S, Xu Y, Sun Y, et al. Size-controlled synthesis, magnetic property, and photocatalytic property of uniform α-Fe2O3nanoparticles via a facile additive-free hydrothermal route[J].CrystEngComm, 2012,14(23): 7915-7921. DOI:10.1039/c2ce25929j.
[8] Agarwal R, Singh V, Jurney P, et al. Mammalian cells preferentially internalize hydrogel nanodiscs over nanorods and use shape-specific uptake mechanisms[J].ProcNatlAcadSciUSA, 2013,110(43): 17247-17252. DOI:10.1073/pnas.1305000110.
[9] Li Y, Kröger M, Liu W K. Shape effect in cellular uptake of PEGylated nanoparticles: Comparison between sphere, rod, cube and disk[J].Nanoscale, 2015,7(40): 16631-16646. DOI:10.1039/c5nr02970h.
[10] Liu X, Zhang J, Tang S, et al. Growth enhancing effect of LBL-assembled magnetic nanoparticles on primary bone marrow cells[J].ScienceChinaMaterials, 2016,59(11): 901-910. DOI:10.1007/s40843-016-5104-9.
[11] Temkin V, Karin M. From death receptor to reactive oxygen species and c-Jun N-terminal protein kinase: The receptor-interacting protein 1 odyssey[J].ImmunolRev, 2007,220: 8-21. DOI:10.1111/j.1600-065X.2007.00560.x.
[12] Lin A. Activation of the JNK signaling pathway: Breaking the brake on apoptosis[J].BioEssays, 2002,25(1): 17-24. DOI:10.1002/bies.10204.
[13] Wang Q, Chen B, Cao M, et al. Response of MAPK pathway to iron oxide nanoparticles in vitro treatment promotes osteogenic differentiation of hBMSCs[J].Biomaterials, 2016,86: 11-20. DOI:10.1016/j.biomaterials.2016.02.004.
[14] Chen Y C, Hsiao J K, Liu H M, et al. The inhibitory effect of superparamagnetic iron oxide nanoparticle (Ferucarbotran) on osteogenic differentiation and its signaling mechanism in human mesenchymal stem cells[J].ToxicolApplPharmacol, 2010,245(2): 272-279. DOI:10.1016/j.taap.2010.03.011.
[15] Kostura L, Kraitchman D L, Mackay A M, et al. Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis[J].NMRBiomed, 2004,17(7): 513-517. DOI:10.1002/nbm.925.

