多个品种微型月季快速繁殖体系的建立
张小雪,薛岩晟,姚振
(长江大学园艺园林学院,湖北 荆州 434025)
微型月季(Rosahybrida)是由中国小月季、多花月季以及小姐妹型月季杂交育成的,较其他五类群现代月季而言,微型月季具有株型矮小、花形紧凑、耐寒能力强、开花时间长等特点,是一类具有很大发展潜力的室内家居装饰花卉。作为一种微型花卉资源,微型月季的市场开发前景广阔,它可以用于地被绿化、花坛花篱的构建,还可陈设于花架、布置于假山之上等。目前在国外,盆栽微型月季已经进入工厂化生产阶段,但我国在这方面的工作刚刚起步。目前月季的繁殖技术依旧沿袭了传统的扦插、嫁接等方法,这些方法限制了月季的繁殖量,不能满足月季工厂化大生产发展的需要。组织培养技术具有繁殖系数高、速度快、成本低等特点,可以在短时间内获得大量的商品苗,对于推广新品种、迅速占领市场具有重要的意义。早在1980年,Hasegawa[1]以攀援月季“Improved fire”的茎尖或休眠芽为材料,在MS培养基上建立了试管苗无性系,开辟了月季组培的先河。近年来,微型月季的组织培养研究越来越多。沈国正等[2]以6个盆栽微型月季品种为试验材料进行离体培养,以诱导腋芽增殖为繁殖途径获得了微型月季的再生植株。于冰沁[3]和刘义存[4]利用带芽(腋芽)茎段为外植体直接进行离体培养,建立了微型月季的快速繁殖体系。本研究以22个微型月季品种为试材,探讨微型月季品种间在腋芽萌动、丛生芽增殖、生根培养等方面的差异,旨在建立微型月季组培快繁体系,为微型月季的组培工厂化生产打下基础。
1 材料与方法
1.1 试验材料
22个不同品种微型月季取自长江大学园艺园林学院花卉基地,编号为R1~R22;花色有蓝、橙、粉、白、黄、红、橘红、桃红、玫红、复色等。
1.2 无菌体系的建立及丛生芽诱导
从健康的植株上剪取发育良好的枝条为外植体,用自来水冲洗干净,表面灭菌条件为 75%乙醇浸泡45s,0.1% HgCl2溶液表面消毒8~10min,无菌水冲洗5次后用滤纸吸干。灭菌后将茎段置于诱导培养基:MS+ 6-BA 3.0mg/L+NAA 0.3mg/L,添加蔗糖30g/L、琼脂 8g/L,pH调至5.8。30d后记录丛生芽诱导情况、污染情况。
1.3 丛生芽增殖培养
选取R4、R5、R8、R15、R17、R18、R19的无菌芽,接种于丛生芽诱导培养基中,每个品种设3个重复,每个重复20个无菌芽(长势、大小基本一致),6-BA浓度设计4个水平,培养基分别为:①MS+ 6- BA 0mg/L+NAA 0.3mg/L;②MS+ 6- BA 1.0mg/L+NAA 0.3mg/L;③MS+6- BA 3.0mg/L+NAA 0.3mg/L;④MS+6- BA 5.0mg/L+NAA 0.3mg/L。培养30d后统计苗高、增殖倍数、生长状况等指标。
1.4 生根培养
选用5个品种(R4、R5、R8、R15、R17)进行生根培养,4种激素组合如下:①1/ 2 MS+ NAA 0.1mg/L;②1/ 2 MS+NAA 0.5mg/L;③1/2 MS+IAA 0.1mg/L;④1/2 MS+IAA 0.5mg/L。每处理植株20棵,重复3次。
1.5 移栽与成苗
当组培苗根系长达1~3cm时,取出幼苗移栽到泥炭土基质中,浇水使基质保持湿润,覆盖塑料薄膜保持湿度,7d后逐渐揭膜通风透气。
2 结果与分析
2.1 微型月季品种间丛生芽诱导的差异
不同的品种在诱导培养基下的丛生芽诱导效率表现出很大的差异(表1)。有9个品种良好,丛生芽的增殖速度快,生长势较强,植株健康,占供试品种总数的41%;有7个品种表现一般,生长势也一般,植株健康,但丛生芽的增殖速度缓慢,不能达到生产上的需求,占供试品种总数的32% ;有6个品种表现较差,生长势较弱,植株呈浅黄色,丛生芽的获得极为困难,占供试品种总数的27%。

表1 微型月季不同品种的丛生芽诱导难易程度和诱导状态
2.2 不同浓度6-BA对微型月季丛生芽增殖效果的影响
从图1可以看出,当NAA浓度为0.3mg/L、不添加6-BA时,植株表现为茎节伸长,叶片增大,基部容易产生大量愈伤组织,平均株高为1.8cm,增殖倍数为0.6。添加6-BA后,当其浓度为1.0mg/L时,植株表现为茎节粗壮而直立,叶色浓绿,平均株高为1.6cm,增殖倍数为2.0,诱导率可达100%。随着6-BA浓度的继续增加,分化率不断降低。当6-BA浓度为5.0mg/L 时,植株表现为茎细长而瘦弱,平均株高为1.9cm,增殖倍数为0.7,诱导率仅达到20%。

图1 不同6-BA浓度下微型月季品种R4丛生芽的增殖状态
2.3 不同品种微型月季试管苗的生根能力比较
试管苗接种到生根培养基上,5~7d开始长出新根,经45d培养后,生根状态基本稳定。添加了0.1mg/L IAA和0.5mg/L NAA培养基的生根情况最好,生根率分别达到42%和43%,根长平均分别为1.7cm和1.1cm(表2)。在所有的生根培养基中,生根率均没有超过50%。
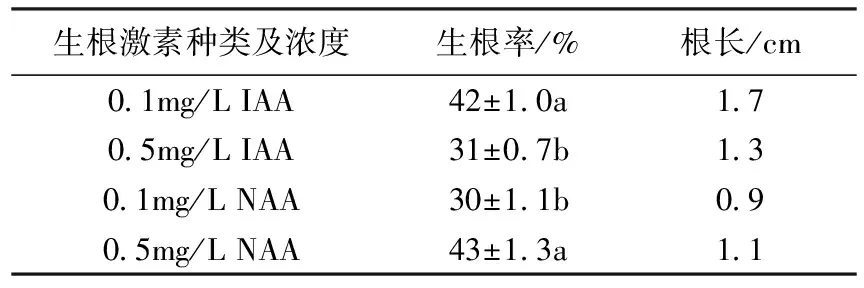
表2 生根激素对微型月季生根的影响
微型月季各品种的生根率差异显著(表3)。品种R5虽然苗的生长状态差,但其生根率以及每个丛生芽的生根条数达到最高,分别为75%和2.1条;品种R4苗的生长状态最好,但其生根率以及每个丛生芽的生根条数达到最低,分别为31%和0.6条;品种R8和R15苗的生长状态一般,生根率以及每个丛生芽的生根条数分别为32%、0.6条和41%、1.8条。品种R17在4种生根培养基上的生长势均较差,组培苗几乎全部死亡。

表3 不同品种微型月季组培苗的生根率
3 讨论与结论
1)据报道,丛生芽的增殖主要依靠细胞分裂素和生长素的配合诱导,随着6-BA浓度的提高(1~3mg/L),丛生芽的增殖系数也相应提高,6-BA和NAA 的组合基本可以满足诱导丛生芽的要求[5~9]。本研究中,近一半的供试品种可以完成无菌体系的建立和丛生芽诱导。微型月季除了品种间丛生芽诱导效率的差异,无菌体系建立和丛生芽诱导体系初步建立过程中遇到的问题还表现在内生菌和黄化2个方面。内生菌表现为前期丛生芽的生长状态良好,植株健壮,叶色浓绿,随着继代次数的增加,丛生芽的根部位置会出现奶白色的不规则菌落,从而导致丛生芽的生长速度减慢和叶片变黄。张作梅[10]的研究表明,有些植物种类的内生菌污染发生频率较高,成为组培试验失败的一个重要原因。内生菌是指生活在植物组织内的微生物,用于区分那些生活在植物表面的表生菌。由于植物导管直径大于细菌100倍以上,细菌完全能够通过外植体导管进入到外植体内部,成为外植体的内生菌,引起接种后的组培苗污染。可采用抑制措施主要有:①外植体材料预处理;②接种后勤检查,及时检出污染的和转移未污染的外植体;③可在培养基中加入防腐剂和抗生素以及医用杀菌剂混合物等措施进行抑制[11,12]。黄化表现为丛生芽对培养基的极度不适,健壮的丛生芽接种于培养基后,会出现植株瘦弱、下部叶片发黄和顶端发褐等现象,直至最后枯死。目前黄化的根本原因尚无定论,可能与材料的切割、激素的逐渐积累等原因有关。克服植物组织培养中丛生芽黄化现象发生,主要是及时地切割丛生芽,切割时应尽可能减小伤口面积,并缩短切口暴露在空气中的时间。切口过大易使细胞受损,酚类化合物外溢,因酚类化合物很不稳定,在酶的催化下迅速氧化而形成褐色醌类物质,进一步与组织中的蛋白质发生聚合,导致整个组织代谢紊乱甚至死亡。
2)激素浓度配比是月季丛生芽增殖的关键。孙坚红等[13]报道,6个不同的微型月季供试品种适宜的培养基有所不同。闫海霞等[14]研究表明,低浓度的6-BA有利于芽的增殖,高浓度对芽增殖有抑制作用,适宜的NAA浓度有利于芽和叶生长,偏高则会产生大量愈伤组织,不利于侧芽的直接分化和生长。冯欢等[6]的研究表明,6-BA浓度的增大使所形成的愈伤组织致密且含水量低,不利于再分化。沈国正等[15]报道微型月季的腋芽在单独使用6-BA的培养基上均能诱导芽的萌发,低浓度(0.25~0.5mg/L)有利于提高芽的萌发率,较高浓度有利于诱导丛芽,并且以1.0~1.5mg/L为最佳。冷肖荀等[16]的研究表明,6-BA的最适浓度为 2.0~2.5mg/L,低于2mg/L时,分化能力差,分化时间长;当6-BA为3mg/L时,一部分苗呈水浸状。本研究中,6-BA在微型月季丛生芽增殖中也起着关键的作用。
3)微型月季组培苗的生根不同于其他组培苗的生根,幼嫩的丛生芽不易生根,与田间扦插的插穗相似,组织太嫩不易生根,而半木质化的插穗更易生根[17]。因此壮芽培养是必须的,经过壮芽培养来提高丛生芽的木质化程度,再进行生根培养才能达到较高的生根率。此外,生根培养上的表现差异,可能与不同品种的遗传背景不同有关。生根后的组培苗经过炼苗移栽,生长状态与扦插苗无明显的区别。
4)引进的微型月季品种,在花色、花形及适应性等方面有差异,离体培养中在无菌体系建立时间长短、试管苗成活率、丛生芽增殖及生根能力等方面均有不同。研究各种基因型微型月季的无菌体系建立和丛生芽诱导频率的差别,以提高微型月季组织培养效率,节约组培成本,对于早日实现微型月季种苗工厂化生产具有重要意义。
[1]Hasegawa P M.Factors Affecting Shoot and Root Initiation from Cultured Rose Shoot Tips[J].J Amer Soc Hort Sci,1980,105:216~220.
[2]沈国正,钱丽华,赵杭苹.盆栽微型月季离体培养繁殖技术探讨[J].浙江农业科学,2006,(4):398~400.
[3]于冰沁.微型月季组织培养的研究[J].辽宁农业科学,2005,(4):53~54.
[4]刘义存.微型月季的离体培养与试管开花研究[D].重庆:西南大学,2007.
[5]叶贻勋,黄青峰,黄瑞方,等.月季的离体快速繁殖技术[J].福建农业大学学报,2000,29(2):172~175.
[6]熊芳,吴安湘.月季快速繁殖技术研究[J].中南林学院学报,2006,26(4):121~124.
[7]徐秋燕,杨平,张边江.不同激素对月季茎段扦插和组织培养的影响[J].湖北农业科学,2012,51(9):1904~1906.
[8]陈育青.月季的离体培养及快速繁殖研究[J].江西农业学报,2006,18(3):104~105.
[9]李海燕,胡国富,胡宝忠.月季组培快繁技术的研究[J].东北农业大学学报,2014,35(1):84~88.
[10]张作梅.微型月季组培快繁技术体系的研究[D].合肥:安徽农业大学,2009.
[11]马翠萍.植物组培污染防治的研究[D].泰安:山东农业大学,2002.
[12]周俊辉,周厚高.植物组织培养中内生菌污染问题[J].广西植物,2003,23(1):41~47.
[13]孙坚红,钱丽华.微型月季离体培养繁殖技术的探讨[J].杭州农业科技,2004,(1):10~11.
[14]闫海霞,蒋月喜,黄昌艳,等.月季“卡罗拉”的组培快繁技术[J].热带作物学报,2016,37(9):1741~1746.
[15]沈国正,钱丽华,赵杭苹.盆栽微型月季离体培养繁殖技术探讨[J].浙江农业科学,2006,1(4):398~400.
[16]冷肖荀.月季的组织培养[J].河北林业科技,2001,(6):6~7.
[17]李晓亮,张军云,张钟,等.滇红食用玫瑰茎段增殖培养基的试验筛选研究[J].中国农学通报,2015,31(25):145~150.
[编辑] 余文斌

