糖尿病合并脑梗死患者血清HMGB1水平及其意义
王守章,饶容丽,陈荣
(浙江新安国际医院 神经内科,浙江 嘉兴 314031)
随着生活水平的提高,糖尿病的发病率不断升高,糖尿病可引起体内多种代谢紊乱,严重影响患者的生活质量。糖尿病可并发肾脏、神经、眼、血管等多种脏器的慢性损害,其中脑梗死是糖尿病慢性并发症之一,是糖尿病患者的死亡原因之一[1]。糖尿病为非特异性炎症性疾病,动脉粥样硬化和斑块形成是脑梗死的病理基础,动脉粥样硬化也是一种炎症反应,高迁移率族蛋白B1(high mobility group box protein B1,HMGB1)是一种迟发型炎症因子,参与各种急性和慢性炎症反应过程,HMGB1还增加胰岛素抵抗,引起糖耐量异常[2-4]。本文对糖尿病合并脑梗死患者的血清HMGB1及其他血清指标水平进行研究,探讨血清HMGB1在糖尿病合并脑梗死发病中的作用,以及与其他血清指标的关系。
1 资料与方法
1.1 临床资料
选择2013年1月-2015年12月浙江新安国际医院神经内科和内分泌科住院的2型糖尿病合并脑梗死患者60例作为糖尿病合并脑梗死组,2型糖尿病患者60例作为糖尿病组,健康体检者60例作为对照组。本研究经本院伦理委员会审批,患者签署知情同意书。排除标准:糖尿病合并脑梗死和糖尿病患者排除妊娠期糖尿病、1型糖尿病及特殊类型糖尿病;所有患者排除恶性肿瘤、近期有病毒感染和细菌感染者、结缔组织病、心脑肝肾功能严重异常者、哺乳期及妊娠期女性、近1个月内服用促排尿酸药物及他汀类等药物、拒绝参与研究者。
1.2 方法
收集患者的性别、年龄、病程、身高、体重、收缩压、舒张压等临床资料。
1.3 血清指标测定
血清HMGB1采用酶联免疫吸附测定法测定,血清高敏C反应蛋白(highly sensitive C-reactive protein,hs-CRP)采用速率散射比浊法测定,空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(glycated hemoglobin,HbA1c)、空腹胰岛素(fasting insulin,FINS)、三酰甘油(Triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)等血糖、血脂指标采用全自动生化分析仪测定。计算稳态胰岛素评价指数(homeostasis model assessment-insulin resistance,HOMA-IR),HOMA-IR=FBG×空腹胰岛素/22.5。
1.4 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,用t检验或方差分析,两两比较用LSD-t检验;计数资料以率(%)表示,用χ2检验;相关分析用Pearson法;影响因素的分析用多元线性逐步回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
3组患者性别、年龄、体重指数、收缩压、舒张压比较,差异无统计学意义(P>0.05),糖尿病合并脑梗死组和糖尿病组病程比较,差异无统计学意义(P>0.05),具有可比性。见表 1。
2.2 3组患者血清HMGB1及其他血清指标比较
3组患者血清HMGB1、hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、HDL-C、LDL-C水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,糖尿病合并脑梗死组和糖尿病组患者血清HMGB1、hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平高于对照组(P<0.05),血清 HDL-C水平低于对照组(P<0.05);糖尿病合并脑梗死组患者血清HMGB1、hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平高于糖尿病组(P<0.05),血清HDL-C水平低于糖尿病组(P<0.05)。见表 2。
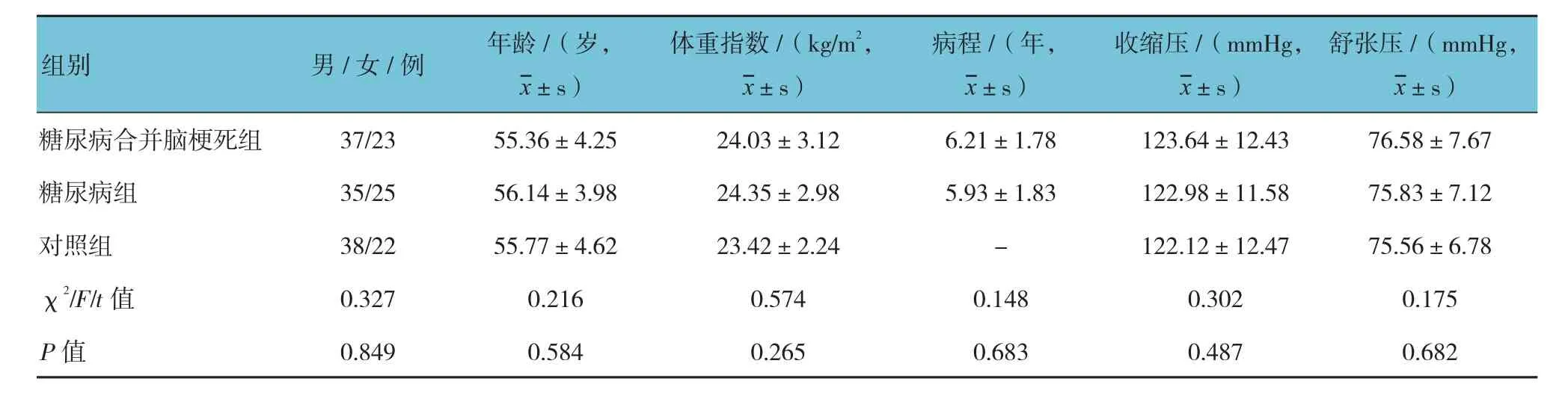
表1 3组患者一般资料比较 (n =60)
表2 3组患者血清HMGB1及其他血清指标比较 (n =60,±s)

表2 3组患者血清HMGB1及其他血清指标比较 (n =60,±s)
糖尿病合并脑梗死组 6.68±0.31 6.12±0.38 9.31±2.14 8.74±1.25 20.32±3.27糖尿病组 3.54±0.17 4.24±0.33 7.83±1.84 7.67±1.12 14.37±2.76对照组 2.12±0.09 1.97±0.26 5.43±1.26 5.15±0.69 8.78±2.14 F值 24.354 31.254 17.684 16.326 27.316糖尿病合并脑梗死组 5.93±0.47 3.02±0.23 6.65±0.53 0.71±0.12 4.12±0.38糖尿病组 4.56±0.27 2.21±0.78 5.23±0.24 1.07±0.17 2.91±0.42对照组 2.67±0.58 1.46±0.58 4.21±0.45 2.32±0.31 2.17±0.35 F值 24.361 19.046 11.423 35.462 23.517
2.3 糖尿病合并脑梗死患者血清HMGB1与其他血清指标的相关性分析
糖尿病合并脑梗死患者血清HMGB1与血清hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平呈正相关(P<0.05),与血清HDL-C水平呈负相关(P<0.05)。见表 3。
2.4 糖尿病合并脑梗死患者危险因素的多因素分析
以糖尿病合并脑梗死为因变量,血清hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、HDL-C、LDL-C为自变量,采用Logistic逐步回归分析,结果显 示,FINS、HOMA-IR、TG、TC、LDL-C是 血 清HMGB1的影响因素(P<0.05)。见表4。

表3 糖尿病合并脑梗死患者血清HMGB1与其他血清指标的相关性分析
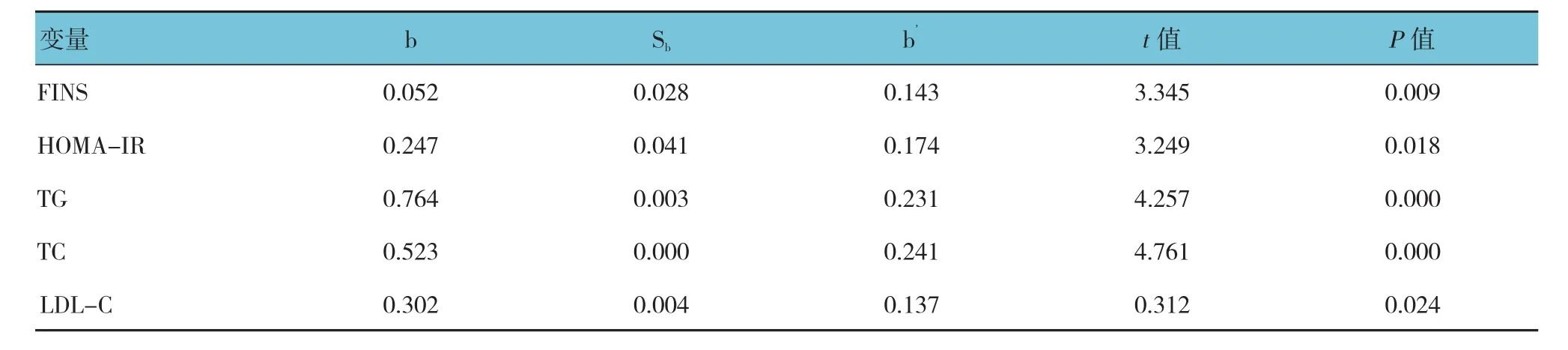
表4 糖尿病合并脑梗死患者危险因素的多因素分析
3 讨论
脑梗死指各种原因引起的脑组织缺血、 缺氧,从而出现脑组织坏死或软化的慢性脑血管疾病。糖尿病是脑梗死的重要病因之一,糖尿病是以高血糖为主要临床特征的慢性内分泌代谢性疾病,胰岛素抵抗及胰岛素相对不足是糖尿病的主要发病机制,糖尿病患者存在血脂代谢异常,脂质在血管内皮上沉积,引起炎症和免疫反应,使血管内形成粥样斑块,从而引起脑梗死的发生[5]。糖尿病的胰岛素抵抗导致的高胰岛素血症,损害血管内皮细胞,使脂质在细胞内沉积,造成血液高凝状态,促进血管内粥样斑块的形成,引起脑梗死的发生[6]。由此可见,脑梗死和糖尿病的关系密切,脑梗死是糖尿病的常见并发症之一。本研究结果发现,糖尿病合并脑梗死组和糖尿病组患者血清FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平高于对照组,血清HDL-C水平低于对照组,糖尿病合并脑梗死组患者血清FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平高于糖尿病组,血清HDL-C水平低于糖尿病组。由此可见,糖尿病患者存在胰岛素抵抗和糖脂代谢异常,糖尿病合并脑梗死患者胰岛素抵抗和糖脂代谢紊乱情况更加严重。
2型糖尿病为一种由多种炎症因子共同参与的非特异性炎症反应性疾病[7]。动脉粥样硬化斑块形成也是由多种炎症因子共同参与的复杂的炎症反应过程[8]。CRP作为重要的炎症因子,在机体多种炎症反应中发挥重要作用。2型糖尿病和动脉粥样硬化及斑块形成均为炎症反应性疾病,CRP在其发生、发展中也发挥重要作用[9-10]。HMGB1为HMG家族成员,在哺乳动脉组织细胞内广泛分布,为一种炎症因子,糖尿病患者受损的胰岛β细胞发生炎症反应,刺激HMGB1的分泌和释放,糖尿病高血糖状态也促进HMGB1的生成,HMGB1介导炎症反应,加重胰岛β细胞的损害,因此,HMGB1在糖尿病的发生、发展中发挥重要作用[11-14]。近几年来,HMGB1在脑梗死中的作用也受到大家重视。祁玲等[15]对急性脑梗死患者外周血HMGB1表达进行研究,发现急性脑梗死患者外周血单个核细胞HMGB1表达增加,HMGB1可能通过下游配体增加炎症因子的分泌,介导脑梗死免疫炎症损伤。WANG等[16]研究发现,糖尿病脑缺血性卒中小鼠血清HMGB1水平及炎症因子水平升高,通过向小鼠腹膜内注射HMGB1抗体阻断HMGB1的功能,可以逆转炎症反应和脑损伤程度。本研究结果发现,糖尿病合并脑梗死组和糖尿病组患者血清HMGB1、hs-CRP水平高于对照组,糖尿病合并脑梗死组患者血清HMGB1、hs-CRP水平高于糖尿病组。由此可见,2型型糖尿病患者血清HMGB1、hs-CRP水平升高,2型糖尿病患者存在炎症反应,2型糖尿病合并脑梗死患者血清HMGB1、hs-CRP更高,2型糖尿病合并脑梗死炎症反应更严重。本研究结果发现,糖尿病合并脑梗死患者血清HMGB1与血清hs-CRP、FBG、HbA1c、FINS、HOMA-IR、TG、TC、LDL-C水平呈正相关,与血清HDL-C水平呈负相关。多因素分析结果显示,FINS、HOMA-IR、TG、TC、LDL-C是血清HMGB1的影响因素。因此可以推测,HMGB1参与脑梗死的发生、发展可能与其影响糖尿病患者的血糖血脂代谢有关,HMGB1可能通过NF-κB信号通路造成脑缺血损伤,通过激活TLR4和TLR2受体通路参与动脉粥样硬化,通过刺激CRP等炎症因子的释放,参与动脉粥样硬化,从而参与脑梗死的发生、发展,阻断HMGB1有利于逆转炎症反应和保护脑梗死后脑损伤程度[17-18]。
[1]KUMAR D, AGARWAL S, KAROLI R, et al. Relationship between carotid intima thickness and silent cerebral infarction in patients with type 2diabetic nephropathy[J]. J Assoc Physicians India, 2014, 62(4): 316-322.
[2]WANG C, JIANG J, ZHANG X, et al. Inhibiting HMGB1 reduces cerebral ischemia reperfusion injury in diabetic mice[J].In fl ammation, 2016, 39(6): 1862-1870.
[3]臧贵明, 曹毅, 王杰, 等. 糖尿病合并冠心病患者血清HMGB1、ET-1、MIF含量变化及其与炎症因子的相关性[J]. 心血管康复医学杂志, 2016, 25(2): 129-132.
[4]MONTANINI L, CIRILLO F, SMERIERI A, et al. HMGB1 is increased by CFTR loss of function, is lowered by insulin, and increases in vivo at onset of CFRD[J]. J Clin Endocrinol Metab,2016, 101(3): 1274-1281.
[5]JIANG D, WANG Y, ZANG Y, et al. Neuroprotective effects of rhGLP-1 in diabetic rats with cerebral ischemia/reperfusion injury[J]. Drug Dev Res, 2016, 77(3): 124-133.
[6]WANG J, WEN C Y, CUI C C, et al. Effect of activation of the Ca (2+) -permeable acid-sensing ion channel 1a on focal cerebral ischemia in diabetic rats[J]. Int J Clin Exp Pathol, 2015, 8(10):13255-13260.
[7]ZHENG J, WU Y, LI Z, et al. Low serum total bilirubin concentration was associated with increased high sensitive C reactive protein level in patients with impaired glucose tolerance and type 2 diabetes mellitus subjects[J]. Clin Lab, 2016, 62(5): 901-907.
[8]STANCEL N, CHEN C C, KE L Y, et al. Interplay between CRP, atherogenic LDL, and LOX-1 and its potential role in the pathogenesis of atherosclerosis[J]. Clin Chem, 2016, 62(2): 320-327.
[9]LACHINE N A, ELNEKIEDY A A, MEGALLAA M H, et al.Serum chemerin and high-sensitivity C reactive protein as markers of subclinical atherosclerosis in egyptian patients with type 2 diabetes[J]. Ther Adv Endocrinol Metab, 2016, 7(2): 47-56.
[10]LIN G M, LIU K, COLANGELO L A, et al. Study of atherosclerosis[J]. Am J Epidemiol,2016,183(1):46-52.
[11]侯园花, 任建功, 罗晖, 等. 糖尿病周围神经病变患者血清脑源性神经营养因子与高迁移率族蛋白B1水平相关性的研究[J]. 中国糖尿病杂志, 2014, 22(12): 1064-1067.
[12]CHEN Y, QIAO F, ZHAO Y, et al. HMGB1 is activated in type 2 diabetes mellitus patients and in mesangial cells in response to high glucose[J]. Int J Clin Exp Pathol, 2015, 8(6): 6683-6691.
[13]ZHAO D, WANG Y, TANG K, et al. Increased serum HMGB1 related with HbA1c in coronary artery disease with type 2 diabetes mellitus[J]. Int J Cardiol, 2013, 168(2): 1559-1560.
[14]孙恺, 张秀萍, 宋林杰, 等. 拮抗高迁移率族蛋白B1对糖尿病合并脑缺血再灌注损伤的保护作用研究[J]. 中华神经医学杂志, 2016, 15(9): 901-907.
[15]祁玲, 刘强. HMGB1在急性脑梗死患者外周血中的表达及其免疫学作用[J]. 中国免疫学杂志, 2013, 29(11): 1186-1189.
[16]WANG C, JIANG J, ZHANG X, et al. Inhibiting HMGB1 reduces cerebral ischemia reperfusion injury in diabetic mice[J].In fl ammation, 2016, 39(6): 1862-1870.
[17]XIAO H, LIU H, HOU C, et al. Effects of ethyl pyruvate in preventing the development of diet-induced atherosclerosis by blocking the HMGB1 expression in ApoE-deficient mice[J]. J Cardiovasc Pharmacol, 2016, 67(4): 299-304.
[18]SU Z, LU H, JIANG H, et al. IFN-γ-producing Th17 cells bias by HMGB1-T-bet/RUNX3 axis might contribute to progression of coronary artery atherosclerosis[J]. Atherosclerosis, 2015, 243(2):421-428.

