H2O2对白及多糖脱色工艺研究
车向前,常明泉,陈 芳,江蓉敬
0 引言
白及是兰科植物白及属[Bletilla striata(thhunb.)reicheb.f.]多年生草本植物的地下干燥块茎,味苦甘涩,性微寒,富含白及多糖,已证实具有药理作用的成分有联苯类、菲类、萜类[1-4]。白及中的活性成分对葡萄球菌及链球菌有抑菌作用,可在局部形成保护膜,能控制及防止胃部感染;白及多糖能显著缩短凝血时间,加速红细胞的沉降率,使红细胞凝集,形成人工血栓,从而修复血管缺损,达到止血的作用;白及具有收敛止血、消肿生肌的作用,可治疗生疮出血、咳血,收敛肺气。目前,研究白及提取工艺的报道较多,而其脱色工艺的研究目前未见报道,脱色后的白及多糖产品市场上也未见供应。传统的白及多糖提取方法为水提醇沉法,对其纯化常见的有丙酮-乙醇交替洗脱法,该法由于耗时、耗费大量试剂,成本高,且会有一些试剂残留,对治疗或食用带来安全隐患。由于白及提取过程中有大量植物色素存在,难以获得较纯的白及多糖,且影响后续成分研究,对于将白及提取物用于化妆品、食品而言,其色素的存在影响制成品的品质[5]。笔者探讨使用H2O2脱除白及多糖中的植物色素,获得较纯的白及多糖原料,以拓展白及的应用领域,提升后续开发产品的质量。
1 仪器与材料
TU1901型双光束紫外/可见分光光度计(北京普析通仪器有限责任公司);DHG-9023A型鼓风干燥烘箱(天津市顺诺仪器科技有限公司,300×300×270);FA 2004分析天平(天津天才精密仪器厂,精度:0.000 1 g);WGA-UNI-10型超纯水器(功率:300 W,北京普析通仪器有限责任公司);无水葡糖糖对照品(中国食品药品检定研究院提供,批号:17-03134-01,纯度:99.941%);白及(湖北神农本草公司,经湖北医药学院附属医院叶立红教授鉴定为兰科植物白及);30% H2O2(黑龙江惠美佳制药有限公司,批号:20151130);蒽酮(上海叶缘生物有限公司,批号:20150222);SSW型电热恒温水浴槽(上海博讯实业有限公司医疗器械厂,700 W);纯化水(湖北医药学院附属太和医院新鲜制备),盐酸、氢氧化钠为分析纯。
2 方法与结果
2.1 白及多糖提取液的制备 取白及饮片置60 ℃烘箱中烘干,粉碎,过10目筛,取该粉末50 g加纯化水(药液比1∶15) 750 mL浸泡60 min,煎煮提取60 min,过滤,收集滤液,药渣加纯化水(药液比1∶10)500 mL,煎煮提取90 min,过滤,集中滤液,药渣加纯化水(药液比1∶5)250 min,煎煮提取90 min,过滤,集中滤液,加纯化水稀释至2 000 mL,用蒽酮-硫酸法测定多糖含量使成2.00%(mg/mL),备用。
2.2 脱色率的测定[6]用紫外分光光度计在473 nm波长处测定脱色前后提取液的吸光度值,计算脱色率。脱色率(%)=(A前-A后)/A前×100%。A前为脱色前提取液的吸光度值,A后为脱色后提取液的吸光度值。
2.3 多糖保留率的测定[7-8]精密称取在105 ℃干燥至恒重的无水葡萄糖对照品适量,加纯化水溶解制备成0.051 5 mg/mL的对照品溶液,取脱色后的提取液稀释至一定浓度,用蒽酮-硫酸法在620 nm处测定吸收度,计算多糖的含量,多糖保留率(%)=M后/M前×100%。M前为脱色前提取液中多糖的含量,M后为脱色后提取液中多糖的含量。
2.4 H2O2脱色影响因素的考察 分别考察H2O2体积分数、脱色温度、脱色时间,以及pH值对脱色率、多糖保留率的影响,每个因素设置5个水平。
2.4.1 H2O2体积分数 取白及多糖提取液50 mL于100 mL三角烧瓶中,共15份,每3份1组,1~5组依次按2%、4%、6%、8%、10%体积分数加入H2O2,混合均匀,调pH值至8,脱色90 min后移至50 ℃水浴中继续搅拌脱色30 min,取出,过滤,取续滤液测定脱色率和多糖保留率,结果见图1、表1。
2.4.2 温度 取白及多糖提取液50 mL于100 mL三角烧瓶中,共15份,每3份1组,各组分别按体积分数6%加入H2O2,混匀,调pH值至8,1~5组分别在30、40、50、60、70 ℃中脱色120 min,取出,过滤,取续滤液测定脱色率和多糖保留率,结果见图2、表1。

图1 H2O2体积分数影响因素

水平因素体积分数(A,%)温度(B,℃)时间(C,h)pH值(D)1430606264090738501208

图2 温度影响因素
2.4.3 时间 取白及多糖提取液50 mL于100 mL三角烧瓶中,共15份,每3份1组,每份均按体积分数6%加入H2O2,混匀,调pH值至8,1~5组样品分别于50 ℃水浴中脱色30、60、90、120、180 min,取出,过滤,取续滤液测定脱色率和多糖保留率,结果见图3、表1。
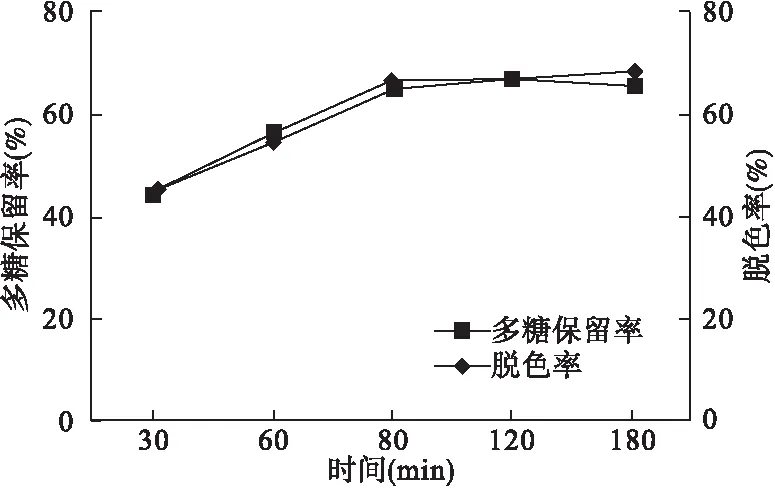
图3 时间影响因素
2.4.4 pH值 取白及多糖提取液50 mL于100 mL三角烧瓶中,共15份,每组3份,每份分别按体积分数6%加入H2O2,混匀,1~5组分别调pH值为5、6、7、8、9,然后于50 ℃水浴温度中脱色120 min,取出,过滤,取续滤液测定脱色率和多糖保留率,结果见图4、表1。

图4 pH值影响因素
2.4.5 工艺优选 根据以上单因素试验结果,应用L9(34)进行四因素三水平的正交设计实验,确定H2O2对白及多糖的最佳脱色工艺,见表2。以脱色率、多糖保留率为考察指标,实验数据采用加权平均法,实验所得各项指标除以该列最大值,乘以100,为该项得分,对于白及多糖的脱色,首先考虑脱色率,其次是多糖保留率,因而设定脱色率(X)和多糖保留率(Y)的权重系数均为0.5,对2项指标进行加权求和,即H=0.5 X+0.5 Y,得到综合评分,见表3。从表3看出,综合色素脱除率和多糖保留率两个因素,H2O2用于白及多糖脱色影响因素大小依次为A>B>D>C,其中A因素及B因素中各水平间差异有统计学意义。确定最佳脱色条件为A2B3D2C2。
2.4.6 验证试验 根据上述试验结果,为了验证工艺的可靠性,取同一批次白及多糖提取液,加入体积分数为6%的H2O2,将pH值调至7,在50 ℃下脱色90 min,取出,过滤,测定脱色率和多糖保留率,结果脱色率为66.80%,预测试验脱色率为68.53%,对验证试验与预测试验的脱色率进行比较,结果RSD为1.81%;验证试验多糖保留率为68.60%,预测试验多糖保留率为67.11%,对验证试验与预测试验的多糖保留率进行比较,结果RSD为1.55%。
3 讨论
白及多糖中如果存在结合性色素则难以脱除,白及多糖提取液是弱酸性的,将提取液pH值调至弱碱性,可促使植物色素细胞破壁,破坏与多糖的结合形态,有利于多糖与色素的分离,从而增强脱色效果。H2O2是一种氧化剂,通过氧化色素使白及多糖脱色[9-11],H2O2的体积分数是影响脱色效果的重要因素,在本实验中,当体积分数在6%~10%区间时,脱色率趋于稳定,而多糖保留率则随着体积分数的增加出现降低趋势,这是因为H2O2在氧化色素的同时也氧化多糖,使糖的结构发生改变、分解,使多糖损失率增多甚至部分失去活性[12]。在最佳脱色效果、最少多糖损失中探索平衡点,合理掌握H2O2用量。实验结果显示,用H2O2脱色速度快,处理样品量大,所加入的H2O2在适宜的温度和时间下可去除,其残留量远低于相关规定的限量[13]。活性炭是传统的脱色剂,脱色效果良好,但脱色后活性炭残留难以完全去除,影响成品外观。该结果低于文献报道的应用活性炭对荔枝多糖的脱色率(93.46%)[14],与其多糖保留率68.61%的结果基本吻合,与秦亚东等[15]报道的用粉末活性炭对白芍多糖脱色率65.00%、多糖保留率69.86%接近。实际生产中,脱色率和多糖保留率指标需根据应用目的选择,对于本实验结果而言,脱色率达到60%以上即符合生产需要,在此前提下需尽量多地保留多糖。对于来源于植物的多糖,常含有酚类、羟基蒽醌衍生物等,这类色素大多呈负性离子,用活性炭脱色的效果不好,而与糖形成结合型色素用H2O2脱色效果可能优于活性炭。

表2 L9(34)H2O2脱色正交实验结果
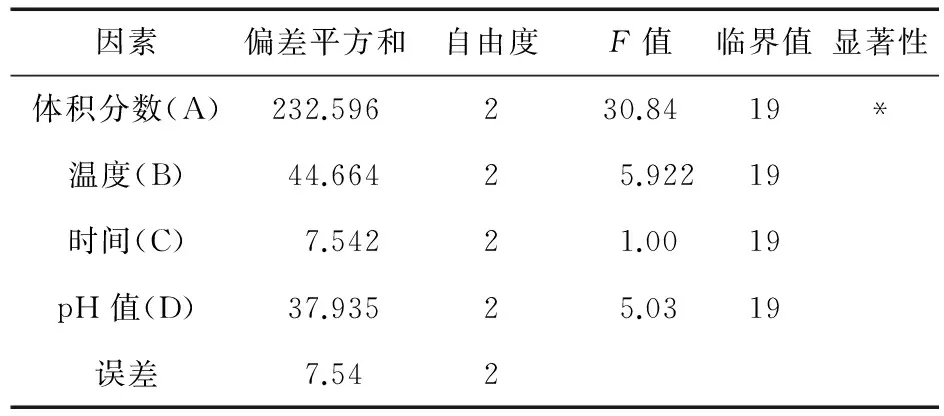
表3 脱色效果方差分析表
在水浴适当温度(50 ℃)下有利于多糖的溶解,降低黏性,增加与色素的分离,在适宜温度中脱色有助于残留H2O2的挥尽,避免影响多糖的含量测定。本实验结果表明,时间对脱色率与多糖保留率在30~60 min之间有明显变化,60 min是脱色的临界时间,在90~180 min之间两者都趋于稳定。本实验中,体积分数、pH值是影响脱色效果的主要因素,温度和时间因素次之。用H2O2对白及多糖脱色的最佳工艺为:体积分数6%,pH 7,温度50 ℃,脱色时间90 min。应用该工艺能使白及多糖获得最佳的脱色效果。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:103.
[2] 刘福强,王艳萍,韩丹,等.白及多糖的提取及其相对分子质量测定和结构研究[J].中成药,2013,35(10):2291-2293.
[3] 何秀丽,陈林,常明泉,等.复方白及乳膏治疗手足皲裂的疗效观察[J].药学与临床研究,2013,21(6):648-650.
[4] 李旭颖.黄精多糖的提取工艺及提取液树脂法脱色的研究[J].化工管理,2015,(26):225.
[5] 左霞,常明泉,陶平德,等.白及在肿瘤治疗中的应用[J].中南药学,2015,13(1):58-60.
[6] 于雷,王保奇,张华锋,等.首乌藤多糖脱色脱蛋白纯化工艺研究[J].中药新药与临床药理,2012,23(2):215-219.
[7] 李志浩,陈银华,李鹏,等.大孔吸附树脂对金银花多糖脱色工艺研究[J].国际中医中药杂志,2015,37(4):345-348.
[8] 孙晓燕,蔡昌利,徐丽莉,等.多糖含量测定方法的比较[J].现代中药研究与实践,2015,29(3):58-62.
[9] 李向东,慧和平,封士兰,等.红芪多糖的脱蛋白及色素工艺[J].中国当代医药,2010,17(3):40-41.
[10]陆毅,任爱农.用过氧化氢对野菊花碱性多糖进行脱色的工艺研究[J].中南药学,2012,10(3):185-188.
[11]贾淑珍,王成忠,于功明.香菇多糖脱蛋白工艺的研究[J].中国酿造,2008,27(5):24-26.
[12]毕元才.大孔吸附树脂分离提纯冬虫夏草多糖的研究[J].食品研究与开发,2015,36(24):62-65.
[13]谢莉,窦燕峰,郭会灿,等.食品中过氧化氢残留快速检测试纸的研制[J].现代食品科技,2011,27(9):1160-1162,1165.
[14]孔凡利,张名位,于淑娟,等.荔枝多糖活性炭脱色方法研究[J].食品科技,2008,33(6):115-117.
[15]秦亚东,汪荣斌,周娟娟.白芍多糖脱色工艺研究[J].中成药,2015,37(12):2783-2787.

