钇-90微球的剂量计算
——钇-90微球放射栓塞系列回顾(四)
贾中芝, 谢双双, 郑丽丽, 王斯妮, 王维平
钇-90(90Y)微球放射性剂量直接影响到患者的疗效,剂量不足,就达不到治疗效果,反之会增加不良反应和并发症发生率[1]。在放射性剂量计算过程中,需要综合考虑诸多因素。首先,微球产品的类型,因为同一患者使用2种不同90Y微球产品时的剂量计算方法有所不同;其次,90Y微球的治疗剂量还受到多种因素的影响,包括肺分流百分数(lung shunt fraction,LSF)、肿瘤负荷、靶肝体积、体表面积和肺脏受到的辐射剂量等[2-5]。因此,每例患者所需的90Y微球剂量应个体化衡量,根据具体情况进行计算。为了帮助大家理解并进行剂量的实际计算,本文将对90Y微球剂量的计算方法和影响因素进行详细介绍。
1 90Y微球剂量的计算方法
目前市场上2种90Y微球产品的计算方法是建立在各自灌注后在肝脏的分布状态而设计的。计算玻璃微球(TheraSpheres)的剂量是假设微球能够均匀分布于整个肝脏,然后以每公斤肝脏重量给予150 Gy(150 Gy/kg)算出总的治疗剂量;而计算树脂微球(SIR-Spheres)的剂量则假设微球非均匀分布于整个肝脏,这种非均匀分布的程度取决于正常肝脏被肿瘤组织取代的程度,可以通过2种方法进行计算,即体表面积法和经验法。
在介绍90Y微球剂量计算之前,有必要简单复习相关定义及单位。放射性活度(activity)用A表示,是指处于某一特定能态的放射性核素在单位时间内的衰变数,其国际单位为贝克勒(Bq),常用单位为居里(Ci),1 Ci=3.7×1010Bq,由于 Bq 是个相当微小的单位,因此常用吉贝克勒(GBq)来表示,1 GBq=1×109Bq,1 Ci=37 GBq; 辐射剂量(radiation dose)通常简称为剂量(dose),用 D表示,是指组织细胞接受的辐射剂量,其国际单位为戈瑞(Gy);处方剂量(prescribed dose)是指医嘱剂量,即计划要注射到肝脏的放射性活度。靶肝体积(target liver volume,TLV)是指计划进行90Y微球放射栓塞治疗时预计所涉及的肝脏体积。体表面积(body surface area,BSA),即人体表面积,单位为平方米,计算公式为:BSA=0.20 247×0.725 h×0.425 w(h 为身高,单位为米;w为体重,单位为千克)。
1.1 TheraSpheres(玻璃微球)的剂量计算方法
TheraSpheres(玻璃微球)的剂量是按单位肝脏的重量进行计算的,即每公斤150 Gy。实际使用剂量(actual dose)需要按照接受治疗肝叶或肝段的实际大小进行调整,即按靶肝体积进行计算,计算公式为:A(glass)=(D×M)/(50 Gy×kg×GBq-1)。A(glass)为靶肝接受玻璃微球治疗的90Y放射性活度,单位为GBq;D为假设靶肝的剂量,单位为Gy;M为靶肝质量,单位为kg,靶肝质量=靶肝体积×密度(1.03mg/cm3)。靶肝体积可以通过计算机软件计算获得(下文将进行详细介绍)。TheraSpheres的制造商推荐放射性玻璃微球的靶肝辐射剂量为80~150 Gy,其中,有严重肝硬化患者需要适当降低剂量(80~100 Gy),而无肝硬化患者可以使用较高的剂量(100~150 Gy)。最终使用的靶肝辐射剂量应由手术医师根据患者的获益风险比进行个体化调整。
为了方便计算,玻璃微球的厂商开发了计算放射性活度的软件。此软件已经得到美国食品药品监督管理局的批准,用户可以通过购买获得使用权。该软件使用方便,只需输入相关的数值(假设靶肝的剂量、靶肝体积、LSF、剂量瓶中微球残留百分比、既往肺脏受到的辐射剂量)即可获取所需的个体化放射性活度(图1)。此软件还考虑到了肺脏单次最大辐射剂量(30 Gy)或多次累积辐射剂量(50 Gy),为用户提供参考性安全剂量。
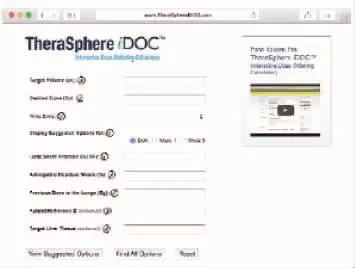
图1 玻璃微球放射性活动度的计算界面
1.2 SIR-Spheres(树脂微球)的剂量计算方法
SIR-Spheres,剂量计算方法有2种,即体表面积法和经验法。目前文献报道大多采用体表面积法,而最新的指南也只推荐使用体表面积法[6]。
体表面积法是同时考虑到体表面积和肿瘤负荷2个主要因素来计算树脂微球的剂量。其计算方法为:A(resin)=(BSA*0.2)+(TI/100)。 A 为靶肝接受树脂微球治疗中90Y的放射性活度,单位为GBq,BSA为体表面积,TI为肿瘤所占肝脏体积的百分数(TI=(TV×100)/(TV+LV),TV(tumor volume)为肿瘤体积,LV(liver volume)为肝脏体积。为了方便计算,树脂微球的厂商开发了计算放射性活度的软件(图2),用户只要输入相关参数(身高、体重、肝脏体积、靶肿瘤体积、LSF及肺质量),软件就可以自动计算出所需SIR-Spheres的放射性活度。同样,此软件也考虑到了肺脏单次或多次累积辐射剂量,为用户提供参考性安全剂量。

图2 SIR-Spheres采用体表面积法计算放射性活度的软件界面
SIR-Spheres的经验法剂量计算是先将患者的肿瘤负荷分为<25%,25%~50%和>50%3个组,然后每组的剂量分别为2.0GBq,2.5 GBq和3.0 GBq(表 1)。

表1 经验法根据肿瘤负荷计算SIR-Spheres的放射性活度
上述2种SIR-Spheres的剂量计算方法各有特点,体表面积法较为繁琐,但获得的放射性活度较为精确。经验法简单方便,根据肿瘤的负荷可以立即计算出所需的剂量,但不够精确。
2 90Y微球剂量计算的影响因素
上述是2种微球产品剂量的基本计算方法,实际应用时还需要考虑多个影响因素,并需要对治疗剂量进行调整。最重要的影响因素包括:LSF、肿瘤负荷、靶肝体积、体表面积,以及肺脏的辐射剂量。另外,即便是同一种因素,在使用不同的微球时,其计算方法和要求也有所不同,如使用SIR-Spheres时不需要考虑靶肝体积,使用玻璃微球时不需要计算体表面积和肿瘤负荷。此外,不同产品的LSF上限也是不同的(表2)。

表2 2种微球使用剂量的影响因素
2.1 LSF
LSF是指从肝动脉注入的90Y微球经肝内存在的动静脉短路进入肺循环的相对值。由于90Y微球栓塞肺动脉可以造成放射性肺损伤,故在进行90Y微球灌注之前需要测定LSF,以减少放射性肺损伤的发生。玻璃微球的使用说明规定,LSF>10%即为禁忌,而树脂微球的厂家允许LSF<20%的患者使用,但需要根据分流情况对剂量进行调整(表3),即存在10%~15%分流时需要降低20%,15%~20%分流时只允许给予60%剂量。

表3 根据LSF调整SIR-Spheres的使用剂量
LSF可以利用99mTc大颗粒白蛋白(99mTc-MAA)核素显像来进行模拟计算,其基本原理已经在本系列的第2部分做了介绍。由于99mTc-MAA需要直接注入肝动脉才能反映从肝内短路进入肺脏的真实情况,所以这是创伤性的检查。这一检查通常是在选择性肝动脉造影和预防性栓塞结束后,直接经导管向计划进行90Y微球注射的肝动脉内注射99mTc-MAA,常用的放射性强度为4~5mCi。随后将患者转送到核医学科进行胸部和腹部联合闪烁扫描,并对99mTc-MAA在肺部和肝脏的分布按下列公式进行计算:LSF=肺总量/(肺+肝)总量2(图 3)。 在成像过程中,为了减少误差,应进行前位和后位两个体位的扫描,然后取平均值。另外,在观察扫描图像时,需注意胃肠道有无99mTc-MAA分布,以确定在血管造影时未能发现的胃肠道分流。在进行LSF测定时还需要注意以下两个因素会直接影响到LSF结果。首先,注射99mTc-MAA时的导管头端的位置与实际灌注放射性微球时的位置要高度一致,否则获得的LSF值可能不准确。其次,注射99mTc-MAA后应尽快进行γ闪烁扫描,因为随着时间的延长,99mTc-MAA会裂解成更小的颗粒,这些小颗粒通过正常的肝毛细血管床后可进入肺脏,使得LSF值假性升高[2]。
2.2 肿瘤负荷(tumor burden,TB)
肿瘤负荷是指肿瘤体积(tumor volume,TV)占整个肝脏体积(liver volume,LV)的百分比,计算公式为:TB=TV/LV,体积单位可以使用ml或cm3(1 ml=1 cm3)。 肿瘤负荷是进行SIR-Spheres剂量计算时的一个重要影响因素(见表1)。肿瘤负荷可以通过以下两种途径获得:①经验评估法;②计算机计算法。经验评估法是指临床医生根据肝脏的CT或MRI图像,大概估计肿瘤与肝脏体积的比值,此方法简单快捷,但主观性强,准确性差。计算机计算法是指根据计算机软件分别定量分析肝脏和肿瘤的体积,从而计算获得肿瘤负荷(具体计算方法需参照不同厂家提供的软件使用说明)。此方法需要配置专用的计算机软件。
2.3 TLV
TLV的计算方法有:①根据Couinaud肝脏分段法,通过常规CT扫描图像,使用计算机软件计算(具体计算方法需参照不同厂家提供的软件使用说明)。值得注意的是,该计算方法是根据标准的动脉解剖获得的,即单个的肝左、右动脉解剖结构。如果CT血管造影发现有肝动脉变异(如存在副肝右动脉),则必须根据常规选择性动脉造影来校正CT血管造影上的计算误差,以确保精确计算TLV;②通过选择性动脉插管法,进行增强C臂CT扫描。根据选择性动脉造影所显示的动脉供血区,之后算出该供血区的大小,即TLV。

图3 ①和②为同一患者,经肝右动脉注入99m Tc-MAA后行γ闪烁扫描,①为前位,②为后位。图像显示肝脏右叶呈高密度分布区,两肺轮廓清晰,为部分99m Tc-MAA通过动静脉短路进入肺循环
2.4 BSA
在计算SIR-Spheres剂量时需要考虑到患者的BSA。其定义、计算方法以及对SIR-Spheres剂量的影响已在本文相关部分做了介绍。
2.5 肺脏的辐射剂量
测定LSF的目的是为了限制肺脏所能承受的安全辐射剂量,即首次不超过30 Gy,累积不超过50 Gy[7]。对于肺功能受损的患者,如存在慢性阻塞性肺疾病或有肺切除病史,累积剂量极其重要,否则可能出现呼吸功能衰竭。尽管个体化评估可以适当提高使用剂量,但为了安全起见,通常将单次治疗15 Gy或累积治疗30 Gy作为肺可耐受的辐射剂量上限[2]。
计算玻璃微球对肺脏的辐射剂量采用以下公式:D(Gy)=50×靶肝的预期放射性活度×(1-体外残留百分比)×LSF。例如,患者靶肝的预期放射性活度为 2.47 GBq,LSF为 5%,则肺脏辐射剂量 D(Gy)=50×2.47×(1-0.02)×0.05=6.1 Gy。 SIR-Spheres的肺脏辐射剂量计算公式为:A (GBq)=处方剂量×LSF;但GBq需要根据肺的质量(M)和相关系数转换为 Gy,其转换指数为 46 970/M(肺),M(肺)为肺的质量,以克(g)为单位;所以肺脏辐射剂量的实用计算公式为:D(Gy)=49 670/M(肺)×A(GBq)。 例如,患者的处方剂量为1.37 GBq,LSF为20%,肺的质量为1 000 g,则肺脏辐射剂量D(Gy)=49 670/1 000×1.37 GBq×20/100=13.61 Gy。
3 实例计算
3.1 TheraSpheres
患者接受TheraSpheres的标准剂量可按A(glass)=(D×M)/(50 Gy×kg×GBq-1)进行计算。 但实际靶肝接受的玻璃微球辐射剂量需要减掉部分因动静脉短路分流至肺脏的剂量,以及一部分残留在体外(如容器和导管)的剂量。所以,靶肝辐射剂量,可以按以下计算方法获得:D(Gy)=[A(GBq)×50×(1-LSF-R)]/M(kg) 或 D(Gy)=50×[输注前测量的放射性活度(GBq)×(1-LSF)×(1-R)]/M (kg),其中,D是靶肝实际接受的辐射剂量,R(Residual)是残留在体外的玻璃微球的百分比(剂量瓶为主要的残留部分,导管和其他容器或污染通常情况下可以不计),M是靶肝质量,单位为千克(kg)。例如,使用玻璃微球治疗1例肝脏恶性肿瘤患者,靶肝质量=TLV×1.03 mg/ml,该患者的 TLV 为 1 000 ml,则靶肝质量为1.03 kg;预期辐射剂量为120 Gy,LSF为5%,剂量瓶中微球残留百分比为2%;患者接受的标准计量 A=(D×M)/50=(120×1.03)/50=2.47 GBq;由于存在5%肝-肺分流及2%容器残留微球,靶肝的辐射剂量为:D(Gy)=[50×2.47×(1-0.05)×(1-0.02)]/1.03=112 Gy。由此可以看出,由于肺分流和体外残留的原因,靶肝实际上获得的辐射剂量均小于预期辐射剂量。
3.2 SIR-Spheres
BSA法:一患者的肿瘤体积为300 ml,LSF为5%,肝脏体积为1000m l,其体重、身高和BSA分为91 kg、1.83m和2.13m2。按上述数据代入公式计算结果为:A(GBq)=(2.13-0.2)+(300/1 000)=2.23GBq。因LSF为5%,该患者无需减少SIR-Spheres的放射性活度,所以实际所需放射性活度仍为2.23 GBq;如果该患者的LSF为17%,则需减量40%,实际所需放射性活度为 2.23 GB×(1~40%)=1.338 GBq。需要注意的是,此方法计算出的SIR-Spheres放射性活度是以全肝治疗为前提的,如果计划进行单个肝叶注射时,应根据靶肝叶所占全肝比例进行校正。例如,肝右叶为靶肝叶,代表70%的全肝体积,实际需要的SIR-Spheres放射性活度为计算所得的70%。
经验法:患者的肿瘤负荷为25%~50%,LSF为5%,根据表1该患者所需SIR-Spheres的放射性活度为2.5 GBq,然后根据LSF对SIR-Spheres放射性活度的影响进行计算(表3),该患者无需减少剂量,则该患者实际所需放射性活度为2.5 GBq;如果患者的肿瘤负荷为>50%,LSF为17%,按照表1计算该患者所需SIR-Spheres的放射性活度为3.0 GBq,然后根据LSF对SIR-Spheres的放射性活度的影响(表3),该患者需减量40%,则该患者实际所需剂量为1.8 GBq。
90Y微球放射性活度的计算是放射栓塞治疗的关键一环,并受微球产品类型的不同以及各种因素的影响,临床医师应充分理解并可借助现成的计算机软件进行计算。同时,根据患者的个体差异,实际剂量在确保安全的情况下可以灵活调整,使患者最大程度地受益于90Y微球放射栓塞治疗。
[1] Camacho JC,Moncayo V,Kokabi N,et al.90Y radioembolization:multimodality imaging pattern approach with angiographic correlation for optimized target therapy delivery[J].Radiographics,2015, 35:1602-1618.
[2] Salem R, Thurston KG.Radioembolization with 90 yttrium microspheres:a state-of-the-art brachytherapy treatment for primary and secondary livermalignancies.Part 1:Technical and methodologic considerations[J].J Vasc Interv Radiol, 2006,17:1251-1278.
[3] Salem R, Thurston KG.Radioembolization with 90 yttrium microspheres: a state-of-the-art brachytherapy treatment for primary and secondary livermalignancies.Part 2:Special topics[J].JVasc Interv Radiol, 2006, 17: 1425-1439.
[4] Salem R, Thurston KG.Radioembolization with yttrium-90 microspheres: a state-of-the-art brachytherapy treatment for primary and secondary livermalignancies.Part 3:Comprehensive literature review and future direction[J].JVasc Interv Radiol,2006, 17:1571-1593.
[5] Murthy R,Nunez R,Szklaruk J,et al.Yttrium-90 microsphere therapy for hepatic malignancy: devices, indications, technical considerations, and potential complications[J].Radiographics,2005, 25(Suppl 1): S41-S55.
[6] Padia SA, Lewandowski RJ, Johnson GE, et al.Radioembolization of hepatic malignancies: background, quality improvement guidelines, and future directions[J].JVasc Interv Radiol, 2017, 28: 1-15.
[7] Ho S,Lau WY,Leung TW,et al.Clinical evaluation of the partition model for estimating radiation doses from yttrium-90 microspheres in the treatment of hepatic cancer[J].Eur JNucl Med,1997,24:293-298.

