醋酸甲羟孕酮合成方法综述
李召勇,周嘉第,苏为科
(浙江工业大学药学院,浙江 杭州 310014)
0 前言
醋酸甲羟孕酮 (Medroxyprogesterone 17-acetate,1),别名安宫黄体酮、甲孕酮、甲羟孕酮醋酸酯等,化学名为6α-甲基-17α-羟基孕甾-4-烯-3,20-二酮醋酸酯,最早是由美国Upjohn有限公司研发与上市的[1-2]。2010年10月,国内上市了醋酸甲羟孕酮注射剂[2]。醋酸甲羟孕酮有较强的孕激素活性,口服或注射均有效,其孕激素活性皮下注射时为黄体酮的20~30倍,口服时为炔孕酮的10~15倍[2]。该药也有抗雌激素作用,但不拮抗雌激素对脂蛋白的良性作用,亦无明显的雄激素效应[3]。该药能增加宫颈黏液黏稠度,也可通过对下丘脑的负反馈作用抑制腺垂体促黄体生成素的释放,从而使得卵泡不能发育成熟,抑制卵巢排卵,所以具有避孕作用[4-5]。该类药物合成存在一些技术难题,比如说生产工艺路线长、反应复杂、收率低、难以分离与纯化等问题[6],所以会加大生产企业成本,通过对其生产工艺路线研究,来解决其中出现的问题,不仅使得生产企业在技术方面占优势,而且还能带来可观的经济效益,不断地推进该类药物出口。以下介绍了国内外合成酸甲羟孕酮四条路线与初步评价。
1 醋酸甲羟孕酮合成路线
1.1 合成路线一[7-8]
根据1960年Liisberg等提出利用四溴化碳方式来合成1,首先是以17-α羟基黄体酮(2)为原料,经过烯醇醚化、二溴化、乙酰化等反应,最终合成1,总产率约为16%,反应总时间约为51 h,其合成路线如图1所示:

图1
该合成路线总收率较低,其中所用到的四溴化碳毒性太大,环境污染严重,不符合当前绿色制药的理念,其中还用到Pd/SrCO3,其价格昂贵,增加成本,因此不适合工业化生产。
1.2 合成路线二[9-10]
Burn与US4544555A等利用Vilsmeier试剂来合成1,该合成路线利用17-α羟基黄体酮醋酸酯(6)为原料,经过烯醇醚化、Vils-meier反应、还原反应、氢化、构型转化,最终合成1,总收率约为40%,反应总时间约为18 h;其合成路线如图2所示:
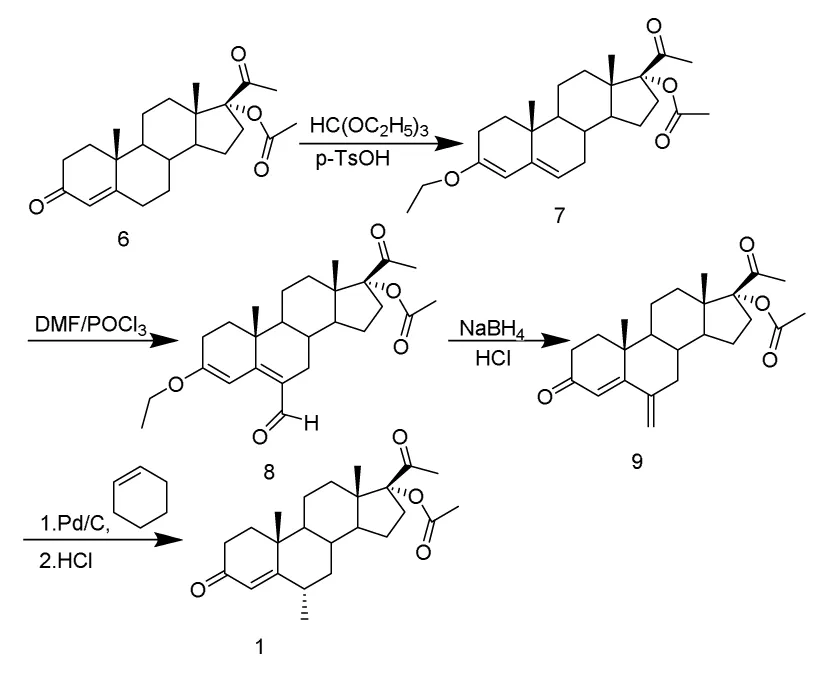
图2
该合成路线总产率低,其中所用的Vilsmeier试剂要临时合成,该过程为强放热过程,且Vilsmeier试剂在高温下很不稳定,所以必须严格控制反应温度;其中所用到的三氯氧磷,其遇水会剧烈发烟,水解成磷酸与氯化氢,不仅消耗了三氯氧磷,而且阻碍Vilsmeier反应进行,最终导致该合成路线总产率大大降低,所以必须严格要求无水操作。
1.3 合成路线三[11-12]
根据1958年Upjohn公司与CN102911233A的报道,利用格氏反应来合成1,其生产路线是以17-α羟基黄体酮(2)作为原料,经过缩酮反应、环氧反应、格氏反应、水解反应、转位反应、乙酰化反应,最终合成1,总收率约为62%,反应总时间约为30 h。其合成路线如图3所示。
该合成路线优点在于避免使用贵金属催化剂钯碳的使用,目前已投入工业化生产中。该合成路线较长、反应时间长、格氏反应条件苛刻,且还需要对初始原料中的酮基进行保护,后处理操作繁琐,因而影响总收率。
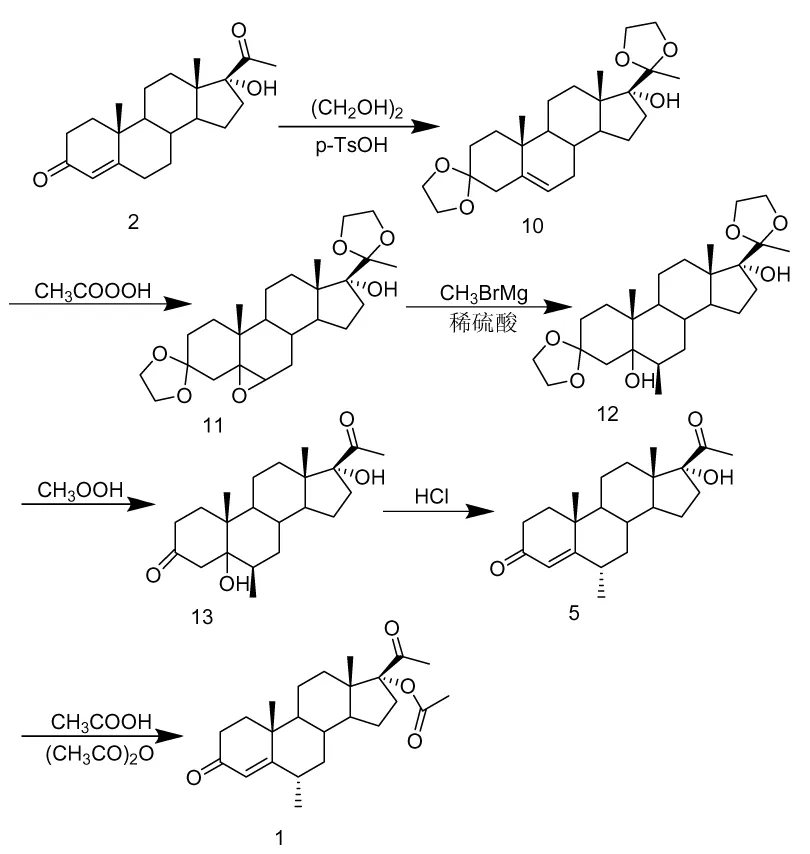
图3
1.4 合成路线四[12-13]
该合成路线是以17-α羟基黄体酮(2)为原料,经过烯醇醚化与曼尼希反应、转位反应、乙酰化反应,最终合成1;该合成路线总产率为68%,反应总时间约为10 h,其合成路线如图4所示。

图4
与前三种合成路线相比,该合成路线产率高,反应路线短,反应时间短;烯醚化反应与曼尼希反应采取一锅法,简化操作步骤,氢化反应避免使用氢气来氢化,安全性高,绿色环保,更适合工业化生产。该合成路线的缺点使用了贵金属Pd。
2 总结与展望
综上所述,醋酸甲羟孕酮的合成路线均存在缺陷,相比之下,合成路线四反应时间短、操作简单、环境污染小、反应总收率高,更值得推广;但该合成路线的收率一般,对于大型的工业化生产来说,其具有较大的提升空间,仍可开展进一步的改进与优化工作,比如在曼尼希反应中用到的甲醛溶液与N-甲基苯胺,可用多聚甲醛与仲胺来代替,进行相对应的工艺改进工作;该合成路线使用了贵金属Pd,可寻求氢化发应中Pd催化剂载体,来降低钯催化剂使用量,还可以筛选绿色的与廉价的金属催化剂与氢源等。
[1] 叶思款,季波,吴佩兹,等.醋酸甲羟孕酮的药理作用与临床应用[J].中国药业,2010,19(1):63-64.
[2] 姚韧辉.甾体类药物的研究现状与进展[J].高新科技,2016 , (18):260-261.
[3] 张小燕.新金分枝杆菌ZJUVN-08转化植物甾醇合成雄溢烯二酮的研究[D].杭州:浙江大学,2013.
[4] 向纪明.黄姜皂素在甾体激素药物合成中的应用[J].安康学院学报, 2014, 26(3):1-5.
[5]Andrea Ries Thurman M D,Natalie Hammond M D,Helen E Brown M D,et al.Peventing repeat teen pregnancy:postpartum depotmedroxyprogesterone acetate,oral contraceptive pills[J].Jouenal of Pediatric and Adolescent Gynecology, 2007, 20(2): 61-65.
[6]He L,Lu Z W,Wu S Y.AnImproved synthesis of nomegestrol acetate[J].American Chemical Society, 2014, 18:431?436.
[7] 龚万本.6α-甲基强的松龙生产工艺研发[D].杭州:浙江大学,2006.
[8] Liisberg S, Godtfredsen W O,Vangedal S.Reaction of polyhalomethanes with enolethers ofΔ4-3-ketosteroids.A new pathway to 6a-methylsteroids[J].Tetrahedron, 1960,9:149-155.
[9] 徐小芳.醋酸甲羟孕酮工艺改进与质量研究[D].华东理工大学,2006.
[10]Burn Leftwick D,Gooley G,Davies M T,et al.Modified steroid hormones-XXXIII steroidal6-formyl-3alkoxy-3,5-dienes and some of their transformations[J].Tetrahedron,1964,20:597-609.
[11]史永平.一种安宫黄体酮的合成方法:CN,20120454883.4[P].2012-11-14.
[12]刘存芳,王芹,史娟,等.6-亚甲基醋酸孕酮得晶体结构表征[J].陕西理工学院学报(自然科学版),2015,31(1): 42-48.
[13]Klaus A.Process for preparing 17alpha-acetoxy-6-methylenepregn-4-ene-3,20-dione,medroxyprogesterone acetate and megestrol acetate:US,20090012321A1[P].2009-07-08.

