人骨髓间充质干细胞复合两种填充材料体外生物相容性的比较
侯亮+张扬+孙轶峰等

[摘要]目的:对比膨体聚四氟乙烯(expanded polytetraf luoroethylene,ePTFE)与硅胶的体外生物相容性,为临床上ePTFE的广泛应用提供实验依据。方法:采用密度梯度离心法分离培养人骨髓间充质干细胞(human mesenchymal stem cells,hMSCs),取第3代细胞通过流式检测、茜素红和油红0染色进行干细胞鉴定,将hMSCs分别与ePTFE和硅胶材料直接作用或与材料浸提液复合培养,观察细胞黏附、生长及增殖情况,计算细胞黏附率,CCK-8比色法检测细胞增殖。结果:成功分离培养hMSCs,形态上呈长梭形、纺锤状、类成纤维细胞样;流式检测结果显示第3代hMSCs高表达间充质干细胞表面标志物CD44(99.5%)、CD90(95.8%),低表达造血系细胞表面标志物CD45;且茜素红和油红0染色阳性;ePTFE组细胞黏附率(92.3%)明显高于硅胶组细胞黏附率(76.8%)(P<0.05);若两种材料直接作用培养后的细胞,随时间延长ePTFE组和空白对照组细胞活性逐渐增加,仍可保持正常的分裂增殖速度(P>0.05),而硅胶组活细胞吸光值明显低于ePTFE组(P<0.05)。结论:ePTFE体外生物相容性优于假体硅胶,较适合作为支架材料应用于组织工程的构建。
[关键词]骨髓间充质干细胞;聚四氟乙烯;生物相容性;填充材料
[中图分类号]R318 [文献标志码]A [文章编号]1008-6455(2017)07-0048-05
在整形外科领域,通过移植自体组织或埋置人工材料以达到治疗或美容目的的填充类手术非常多见。填充物的理化性质、生物相容性以及体内长期稳定性等问题一直以来备受关注。自体组织最安全,组织相容性好,且不会产生排异,但其取之有限,因而并不能满足所有的手术需求。临床目前常用的填充材料主要是固体硅胶,随着材料工艺水平的发展,虽然从形态、质地和组织相容性等方面较以往有了较大的改善,但其缺点是不能与机体建立起血液循环,后期可在其周围形成一薄层纤维包膜,且偶见硅胶假体的体表透光现象,影响外观效果。
膨体聚四氟乙烯(expanded polytetrafluoroethylene,ePTFE)是一种多孔高分子聚合材料,具有不变形、不变质、不产生炎性吸收反应等特点,可容许细胞游走及组织向内生长。近年来ePTFE已普遍应用于整形美容外科,尤其是隆鼻、面部凹陷畸形修复、鼻唇沟过深美容、耳廓缺陷修复等。本实验以人骨髓间充质干细胞(human mesenchymal stem cells,hMSCs)作为组织工程细胞载体,对比ePTFE和硅胶的体外生物相容性,为临床上ePTFE的广泛应用提供实验依据。
1材料和方法
1.1实验材料:膨体聚四氟乙烯(上海索康医用材料有限公司,产品注册证号:20143461861);硅胶(广州市万和整形材料有限公司,产品注册证号:20143460494);Ficoll分离液(G&E,瑞士);DMEM低糖培养基(Hyelone,美国);胎牛血清、胰酶(Gibco,美国);小鼠抗人CD44-FITC、CD90-FITC、CD45-PE(北京中衫生物技术有限公司);人成骨和成脂诱导试剂盒(广州赛业生物技术有限公司);CCK-8细胞增殖检测试剂盒(北京天恩泽生物技术有限公司)。
1.2仪器设备:离心管、细胞培养皿、96孔细胞培养板(Corning,美国);HERAcell 240i全能型CO2细胞培养箱、Attune NxT流式细胞仪、MK3多功能酶标仪(Thermo Fisher Scientific,美国);DMIL LED倒置显微镜(Leica,德国);5810R高速冷冻离心机(Eppendorf,德国)。
1.3标本来源:成人骨髓血样本1例,取自吉林大学第二医院骨科就诊的股骨颈骨折手术患者,经血、尿分析及系统检查,无家族遗传病史及造血系统疾病,肝功能正常,术前经医院伦理委员会及患者同意,手术中于骨折断端取骨髓血5ml,吸入含0.5ml肝素的无菌针管中備用。
1.4方法
1.4.1 hMSCs分离及传代培养:采用密度梯度离心法分离hMSCs,将抽取的骨髓血置于Fieoll上层,2000rmp离心20min后,吸取中层乳白色悬浮细胞,PBS清洗2次,1500rmp离心5min,弃上清。将分离得到的单核细胞用完全培养基制备成单细胞悬液,以1×106/ml接种于培养瓶内,置于37℃、5%CO2孵育箱内培养,每间隔2d换液1次。待贴壁细胞融合至80%~90%,0.25%胰酶消化,以1:3比例传代。倒置显微镜观察细胞的生长及形态变化。
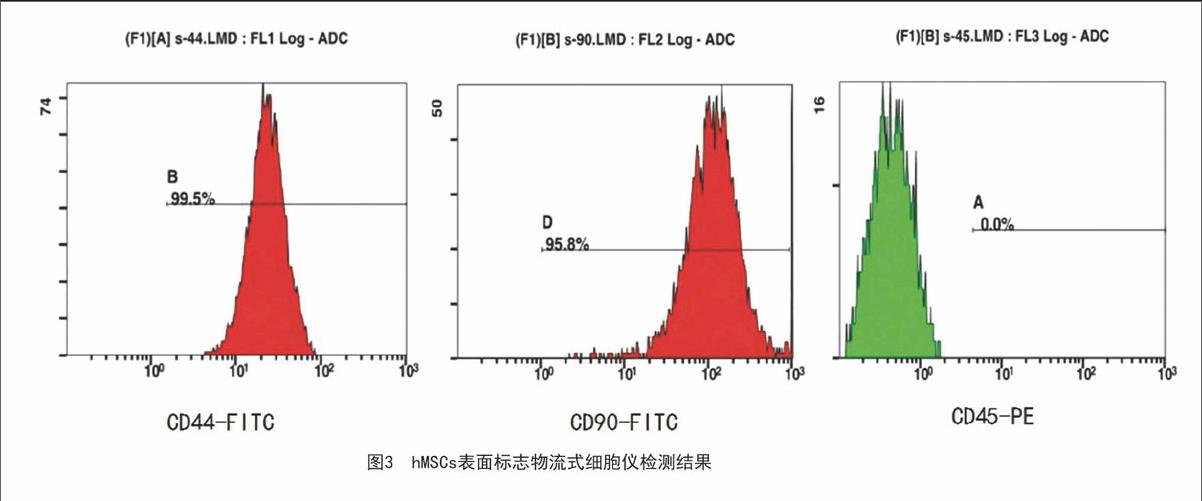
1.4.2 hMSCs表面标志物检测:取生长良好的第3代hMSCs,制成1×106/ml细胞悬液。PBS洗涤2次,弃上清,加入100 μl PBS液。每管相继加入小鼠抗人CD44-FITC、CD90-FITC、CD45-PE各20μl。室温避光孵育20min,PBS洗涤2次,1000rmp离心5min,PBS重悬定容至每管200μl,流式分析仪上样检测。
1.4.3 hMSCs成骨诱导实验:将第3代hMSCs以每孔1×104/cm2密度接种于6孔板中,待细胞生长融合至80%~90%之后,加入成骨诱导培养液(10%FBS、0.1μM地塞米松、50μM抗坏血酸、10mMβ-磷酸甘油、1%青链霉素),并设阴性对照孔(仅加入普通培养基),继续培养21d,进行茜素红染色后镜下观察。
1.4.4 hMSCs成脂诱导实验:将第3代hMSCs以每孔2×108/cm2密度接种于6孔板中,待细胞生长融合至80%~90%之后,加入成脂诱导培养液(IO%FBS、1μM地塞米松、10μM胰岛素、200μM吲哚美辛、0.5mM IBMX、1%青链霉素),并设阴性对照孔(仅加入普通培养基),继续培养至14d,进行油红0染色后镜下观察。endprint
1.4.5 ePTFE和硅胶材料处理
1.4.5.1原材料直接处理:将ePTFES和硅胶分别置于15ml离心管内,用75%乙醇浸泡24h,无菌PBS冲洗3次,放入紫外操作台中照射30min后,无菌剪刀剪成1mm×2mm×2mm小块,两种材料的处理如图1。
1.4.5.2材料浸提液制备:称取相同质量的两种无菌材料,置于15ml离心管内,依次加入5ml完全培养基,室温下分别浸泡24h、48h、96h,将获得的浸提液于4℃保存待用。
1.4.6细胞黏附率测定:在24孔板培养板内分别植入备用的ePTFE和硅胶各8块,将浓度为1×108/L的细胞悬液0.2ml滴加到材料上,静置4h后,换于另一培养板,加入完全培养基,将原培养板中细胞消化收集,细胞计数仪计数,得出流失的细胞数;细胞材料复合物培养24h后,在培养液中轻轻晃动,换于另一培养板,重复上述步骤,得出未黏附细胞数,计算黏附率。黏附率=(接种细胞数流失细胞数未黏附细胞数)/(接种细胞数流失细胞数)×100%。
1.4.7细胞增殖能力测定
1.4.7.1原材料直接作用对hMSCs增殖的影响:将两种材料分别置于96孔培养板中,并设不加材料的空白对照组,每组5个复孔。将浓度为2×103/L细胞悬液按100μl/孔接种于培养板内,置于37℃、5%C02孵育箱内培养48h、96h、144h,每孔加入CCK-8 10μl,孵育3h,酶标仪在450nm波长处测定各孔吸光度OD值。以时间为横轴,OD值为纵轴绘制生长曲线。
1.4.7.2材料浸提液对hMSCs增殖的影响:将浓度为5×103/L细胞悬液接种于96孔培养板中,加入两种材料不同时间收集的浸提液,置于37℃、5%CO2孵育箱内培养48h、96h,每孔加入CCK-8 10μl,孵育3h,酶标仪在450nm波长处测定各孔吸光度OD值。
1.5统计学分析:采用统计软件SPSS15.0进行统计分析,所得数据均以(x±s)表示,采用t检验,各组别之间的比较采用F分析,P<0.05为差异有统计学意义。
2结果
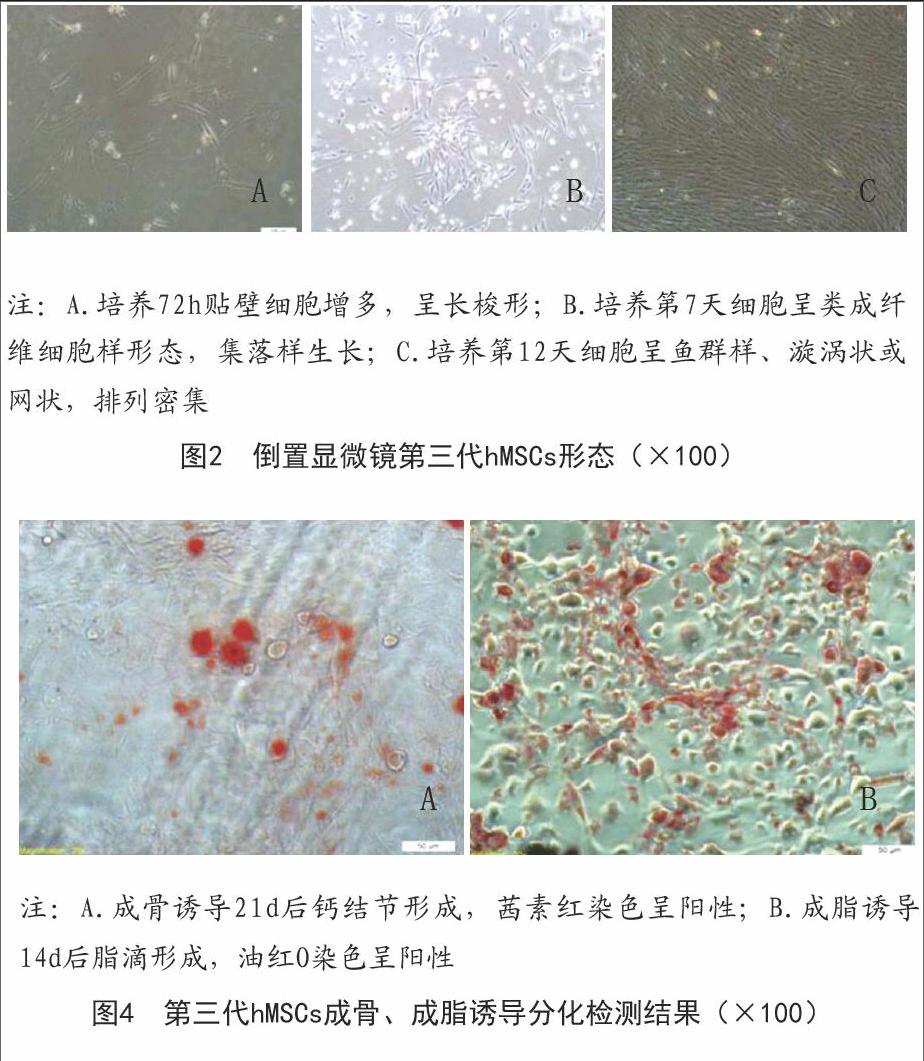
2.1 hMSCs形态观察结果:倒置显微镜观察到接种3h后少量细胞贴壁生长,但细胞体积较小,无突起;培养72h后贴壁细胞有所增多,呈长梭形;培養至第7天细胞增殖分裂加速,为类成纤维细胞样形态,呈漩涡状集落样生长,约在10~12d细胞生长融合至80%~90%;传代后的hMSCs形态更加均一,排列更加有序,呈鱼群样、漩涡状或网状排列。见图2。
2.2 hMSCs表面标志物检测:流式细胞仪分析显示间充质干细胞表面标志物CD44和CD90表达均为阳性(99.5%,95.8%),而造血干细胞表面标志物CD45表达为阴性(0.0%),证实所培养的细胞为间质来源的干细胞,见图3。
2.3 hMSCs成骨、成脂诱导分化鉴定结果:hMSCs经成骨诱导后由长梭形逐渐变成多角形或不规则形,细胞质中可见较多细小颗粒,诱导7d时细胞外出现细小矿化结节,21d时可见明显钙结节形成,茜素红染色为阳性;hMSCs经成脂诱导后胞质内可见许多大小不一的脂滴,诱导2周时细胞分化达高峰,细胞体积明显增大,油红O染色为阳性。见图4。
2.4细胞黏附率测定结果:经检测,ePTFE每块材料细胞黏附率平均达到92.3%,而硅胶材料细胞黏附率仅为76.8%,ePTFE对细胞的黏附作用优于硅胶(P<0.05)。
2.5细胞增殖测定结果:如图5所示,CCK 8法检测两种材料直接作用培养后的细胞,随时间延长ePTFE组和空白对照组细胞活性逐渐增加,仍可保持正常的分裂增殖速度,两组之间差异无显著性意义(P>0.05),而硅胶组细胞吸光值明显低于ePTFE组和空白对照组(P<0.05)。两种材料不同时间收集的浸提液分别作用hMSCs,孵育48h后检测结果显示各组OD值无显著差异(P>0.05),结果见表1。孵育96h后ePTFE浸泡48h组和硅胶浸泡各组OD值低于空白对照组(P<0.05),表明材料浸提液对细胞生长有一定的影响,结果见表2。
3讨论
软组织缺失是整形外科关注的焦点问题之一,传统的组织重建方法存在供皮区缺损、植入物吸收以及异物反应产生等缺陷,近年来干细胞被认为可能是一种新的治疗方法。骨髓间充质干细胞与脂肪干细胞是目前组织工程中研究较多的间充质干细胞。二者均能自我更新和多向分化潜能,而且具有取材方便、创伤小、细胞获取量大等优点,因而成为组织工程研究中的重要种子细胞之一。虽然这两种间充质干细胞生物学特性相似,但在成软骨诱导、血管内皮分化等方面,骨髓间充质干细胞比脂肪干细胞更具有优势。因此,本研究选取hMSCs作为填充材料生物活性检测的细胞载体。
骨髓间充质干细胞细胞支架材料的化学组成成分、表面理化特性、机械稳定性和三维空间支架结构均是此次考虑的重要因素,而且必须保证移植后细胞的渗透、足够的增殖和细胞在构建物中完全分化。目前在组织工程中用作细胞支架的生物材料主要是一些天然高分子、天然无机物和合成高分子。虽然这些支架的生物相容性较好,但仍存在一些不足,如:对缺损组织的修复不足,随时间增长材料可逐渐降解等,因此仍需进一步研究探索适用于组织工程的载体材料。
ePTFE在整形外科的应用已有30多年的历史。目前报道多为ePTFE单独或是联合自体软骨或其他生物材料应用于整形外科的临床观察,而其体内外生物相容性的基础实验研究鲜有报道。田田等制备SD大鼠背部全层皮肤至筋膜层损伤模型,观察自体移植组、异体移植组和ePTFE实验组创面愈合情况,发现ePTFE可引起较小的炎性反应及异物反应,置于受损创面上未见不良反应,提示可将其作为创面覆盖材料。尹中普等将ePTFE和Ⅰ型胶原联合制成的复合材料应用于隆鼻填充物,发现ePTFE联合Ⅰ型胶原复合材料在细胞毒性、埋植后的炎性浸润及生物相容性方面均优于单纯ePTFE。此外,杨柳等观察到ePTFE支架材料与人脂肪干细胞具有良好的体外生物相容性,可作为构建脂肪组织工程的细胞载体。
本次研究成功分离培养出hMSCs,检测了第3代细胞表面标志物CD44和CD90阳性表达,并对细胞进行多系定向诱导分化,进一步确认实验所得细胞具有干细胞特性。实验中通过倒置显微镜观察hMSCs黏附、伸展和生长情况,结果显示,细胞生长状态良好,无明显细胞毒性表现,说明该材料对细胞有着良好的亲和力。CCK-8法测定活细胞光吸收值,实验发现ePTFE直接作用hMSCs时,可增加其成活及增殖,且细胞增殖效果优于硅胶组。由此可见,ePTFE作为整形外科填充材料,在体外生物相容性方面优于硅胶假体,为临床上填充材料的改进和广泛应用提供了科学依据。但是,两种材料的浸提液与hMSCs孵育96h后检测结果显示对细胞的生长有一定的影响。作为长期植入体内的生物材料,本实验设计的作用时间远不能真实地反应材料的细胞毒性。合理的细胞毒性评价应跟踪材料降解过程中降解产物的细胞毒性。因此,在后续实验中将跟踪填充材料在不同降解时间内其降解液的细胞毒性,建立基于材料降解液的细胞毒性评价方法。
目前,评价材料生物相容性的方法主要包括体外细胞培养法和体内埋植法。体外细胞培养法是将材料的浸提液或者材料本身与某种细胞进行体外的复合培养,以检测细胞的增殖与功能表达的情况,这种方法作为材料生物相容性的初级评价方法,可以直接观察细胞与材料复合生长的情况。体内埋植法是将材料植入体内,观察宿主对材料的反应,这种方法往往作为后期评价材料生物相容性的有效方法,主要观察的是材料与周围机体组织的组织相容性。本次研究采用体外细胞培养法,直接观察了hMscs与两种填充材料复合生长的情况。对于ePTFE体内生物相容性,以及临床应用中所产生的并发症及其作用机理等,有待进一步研究探讨。endprint

