降糖消脂片对肥胖大鼠模型的影响
金 龙 葛争艳 董小霞 杨 斌 李宏坤 郭宇洁 任 烨 洪晓华 王杨慧 刘建勋
(中国中医科学院西苑医院基础医学研究所,中药药理北京市重点实验室,北京,100091)
肥胖症是一种慢性代谢性疾病,是导致高血压、心脏病、2型糖尿病及脑卒中等疾病的重要危险因素,肥胖症已经成为目前世界范围内最严重的公共卫生问题之一[1]。肥胖症与过度进食、偏食高脂肪类食物及缺乏运动等密切相关,是由遗传因素、环境因素等多种因素相互的结果,其具体发病原因尚不清楚[2]。降糖消脂片来源于临床经验方,由女贞子、黄芪、黄连、荔枝核、昆布等中药组成,具有益气养阴,行气通络之功效,是治疗糖尿病前期糖脂代谢紊乱,症见乏力、困倦、多汗、头晕、口干、多饮、易饥、尿频、大便不爽、肢体麻木,舌质黯红、苔白微腻或黄腻、舌下静脉迂曲,脉弦细或濡或滑等。前期临床研究显示,该方剂可以有效的降低糖尿病患者体质量及体质量指数(BMI),改善患者炎性反应及纤溶活性[3]。进一步的动物实验显示,降糖消脂片降糖消脂片对KK-Ay糖尿病肥胖小鼠有明显的降糖、降脂及改善胰岛素抵抗的作用[4]。本研究观察降糖消脂片对单纯性肥胖(Diet Induced Obesity,DIO)大鼠模型的影响,为临床应用提供实验依据和理论基础。
1 材料与方法
1.1 材料
1.1.1 动物 SD雄性大鼠,体质量(130.43±7.15) g,由北京华阜康生物科技股份有限公司提供,许可证编号:SCXK(京)2009-0007。参考文献方法制定高脂饲料[5]:猪油10%、蔗糖10%、胆固醇1.5%、胆盐0.5%、蛋黄粉5%、普通饲料73%,由北京华阜康生物科技股份有限公司加工。
1.1.2 药物 降糖消脂片,实验用其干粉,5.4 g生药/g粉,由中国中医科学院西苑医院基础医学研究所药化研究室提供,批号20100308;盐酸二甲双胍片,北京协和药厂产品,批号101205;辛伐他汀片,杭州默沙东制药业有限公司产品,批号09547。
1.1.3 试剂与仪器 血脂试剂盒:均为中生北控生物科技股份有限公司产品,TC批号111511,TG批号114491,HDL-C批号110531,LDL-C批号110571;FFA试剂盒:由北京尚柏生物医学技术有限公司提供,批号120210。全自动生化分析仪,日立7080型(日本产);生物组织包埋机,TB-718型,常州市中威电子仪器有限公司产品;组织切片机RM2235型,德国Leica产品;烤片机,HI1220型,德国Leica产品;全自动组织脱水机,ST5020型,德国Leica产品;显微镜,日本OLYMPUS公司BX41型。
1.2 方法
1.2.1 分组与模型制备 动物模型制备周期为18周,给药周期为8周。即大鼠分为普通饲料组和高脂饲料组进行喂养,4周、6周、8周、12周及18周时(大鼠禁食16 h),分别取对照组和高脂饲料组数只,尾尖采血进行TC、TG测定,每次抽测均选同一批动物,以便动态观察。待血脂升高至与对照组差异有统计学意义时,麻醉动物,称体质量后用皮尺测量大鼠身长(鼻尖至尾根的长度)及尾长(尾根至尾尖的长度),计算药前Lee′s指数,再进行心脏取血,分离血清测定TC、TG,高脂组大鼠体质量和血脂均升高,可进行分组。普通饲料组为对照组(12只),高脂饲料组(72只)分为模型组、二甲双胍组(0.3 g/kg)、辛伐他汀组(4 mg/kg)、降糖消脂片8、4、2 g生药/kg组。除对照组外,各组继续高脂饲料喂养。(因造模动物心脏取血后,有10余只大鼠死亡,故实验后期动物由每组12只变为每组10只)。
1.2.2 给药方法 连续灌胃给药2个月,体积为10 mL/kg;对照组和模型组灌胃等体积灭菌水。
1.2.3 检测指标与方法
1.2.3.1 造模18周大鼠体质量的变化 造模期间,隔周称体质量。
1.2.3.2 造模18周大鼠摄食量测定 造模期间,隔周称饲料(每笼定量加料,第2天称余料),计算每100 g体质量的摄食量,至造模18周。摄食量=(加料-余料)/笼总体质量×100。
1.2.3.3 造模18周大鼠Lee′s指数测定 麻醉动物,称体质量、量身长及尾长,计算造模后Lee′s指数。Lee′s指数=[体质量(g)×103/身长(cm)]1/3。
1.2.3.4 造模18周大鼠血脂测定 麻醉动物,心脏取血,分离血清,用生化仪测定TC、TG。
1.2.3.5 给药8周大鼠体质量的变化 每周称体质量。
1.2.3.6 给药8周大鼠摄食量测定 每周称体质量及摄食,计算每100 g体质量的摄食量。
1.2.3.7 给药8周大鼠Lee′s指数测定 麻醉动物,称体质量、量身长及尾长,计算给药后的Lee′s指数。
1.2.3.8 给药8周大鼠血脂测定 麻醉动物,腹主动脉取血,离心后分离血清,用生化仪进行TC、TG、HDL-C及LDL-C的测定。
1.2.3.9 给药8周大鼠FFA测定 麻醉动物,腹主动脉取血,离心后分离血清,用生化仪进行测定。
1.2.3.10 肝脏形态学观察 各组大鼠解剖取肝脏,10%甲醛固定、乙醇脱水、石蜡包埋、切片、HE染色,光镜下进行肝脏形态学观察。采用参比差值法进行肝脏脂肪变性分级(正常:无肝细胞脂肪变性;轻度:肝细胞脂肪变性累及肝组织的1/3以下的肝小叶或仅见个别肝细胞脂肪变性;中度:肝细胞脂肪变性累及肝组织的2/3至1/3的肝小叶;重度:肝细胞脂肪变性累及肝组织的2/3以上的肝小叶并且脂变程度较重)。
1.2.3.11 脂肪病理学观察 各组大鼠解剖取脂肪,10%甲醛固定、乙醇脱水、石蜡包埋、切片、HE染色,光镜下进行脂肪形态学观察。HE染色后进行脂肪细胞计数,计数每个高倍视野中脂肪细胞数,每组共计30个高倍镜视野,再取平均值。
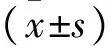
2 结果
2.1 造模18周体质量的变化 高脂饲料喂养2周时,与对照组比较,高脂组大鼠体质量明显降低(P<0.01);造模4周时,高脂组体质量与对照组持平;造模6周时,高脂组体质量超过对照组,但差异无统计学意义;造模8~18周,高脂组体质量明显高于对照组(P<0.01),说明肥胖模型非常成功。见表1~2。
2.2 造模18周摄食量的改变 高脂饲料喂养2周时,高脂组摄食量与对照组差异无统计学意义;造模4周开始,高脂组各时间点的摄食量与对照组比较明显降低(P<0.01),可能是由于饲料中脂肪含量较高,导致大鼠进食量减少,但高脂组体质量明显高于对照组。见表3~4。
2.3 造模18周Lee′s指数的变化 高脂饲料喂养18周后,高脂组大鼠的体质量和身长与对照组比较均明显增加(P<0.05~0.01),故Lee′s指数与对照组比较也明显增加(P<0.01),尾长则无明显变化。提示大鼠已明显肥胖,可取血测定药前TC、TG等指标。见表5。
2.4 造模18周血脂的变化 由于动物尚未开始给药,故检测TC、TG需心脏取血。高脂饲料喂养18周后,高脂组大鼠的TC与对照组比较明显升高(P<0.01),TG与对照组比较也有所增加(P<0.05),说明大鼠造模后血脂已明显升高,可进行分组、灌胃给药。见表6。

表1 大鼠造模后体质量的变化
注:与对照组比较,**P<0.01

表2 大鼠造模后体质量的变化
注:与对照组比较,**P<0.01

表3 大鼠造模后摄食量的变化体质量)
注:与对照组比较,**P<0.01

表4 大鼠造模后摄食量的变化体质量)
注:与对照组比较,**P<0.01
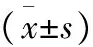
表5 造模18周大鼠Lee′s指数的变化
注:与对照组比较,**P<0.01

表6 造模18周大鼠血脂的变化
注:与对照组比较,*P<0.05,**P<0.01
2.5 降糖消脂片对肥胖大鼠体质量的影响 造模后(给药前),各组动物体质量明显高于对照组(P<0.05~0.01),大鼠已明显肥胖。灌胃给药后,与模型组比较,降糖消脂片大剂量组从药后3周开始,体质量有所下降(P<0.05);药后7周时体质量下降明显(P<0.01);药后8周时,大剂量组体质量下降极其明显(P<0.01),且中剂量组体质量也有所下降(P<0.05)。见表7~8。

表7 降糖消脂片对肥胖大鼠体质量的影响
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05

表8 降糖消脂片对肥胖大鼠体质量的影响
注:与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01

表9 降糖消脂片对肥胖大鼠摄食量的影响体质量)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05

表10 降糖消脂片对肥胖大鼠摄食量的影响体质量)
注:与对照组比较,*P<0.05,**P<0.01
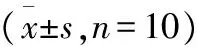
表11 降糖消脂片对肥胖大鼠Lee′s指数的影响
注:与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01

表12 降糖消脂片对肥胖大鼠血脂的影响
注:对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.6 降糖消脂片对肥胖大鼠摄食量的影响 与对照组比较,模型组各时间点的摄食量明显降低(P<0.05~0.01),灌胃给药后,降糖消脂片中剂量组药后1周时,摄食量比模型组有所下降(P<0.05),其他各剂量组药后摄食量与模型组比较差异无统计学意义。见表9~10。
2.7 降糖消脂片对肥胖大鼠Lee′s指数的影响 高脂饲料喂养18周后,与对照组比较,模型组大鼠Lee′s指数明显升高(P<0.01),说明造模成功。连续灌胃给药2个月后,与模型组比较,降糖消脂片大剂量组Lee′s指数明显降低(P<0.01),中剂量组Lee′s指数也有所降低(P<0.05)。见表11。
2.8 降糖消脂片对肥胖大鼠血脂的影响 结果显示,高脂饲料喂养18周后,与对照组比较,模型组TC、TG、LDL-C、VLDL-C及TC/HDL-C均明显升高(P<0.05~0.01),说明造模成功。连续灌胃给药2个月后,与模型组比较,降糖消脂片大、中剂量组TC和LDL-C明显降低(P<0.05);TG有下降的趋势;高剂量组HDL-C明显升高(P<0.01)、TC/HDL-C明显降低(P<0.05);低剂量组VLDL-C有所降低(P<0.05)。见表12。
2.9 降糖消脂片对肥胖大鼠FFA等指标的影响 模型组FFA明显高于对照组(P<0.01);与模型组比较,降糖消脂片各剂量组FFA明显降低,差异有统计学意义(P<0.01)。见表13。
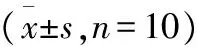
表13 降糖消脂片对肥胖大鼠FFA等指标的影响
注:与对照组比较,**P<0.01;与模型组比较,△△P<0.01
2.10 降糖消脂片对肥胖大鼠肝脏的影响
2.10.1 肉眼观察 对照组肝脏呈鲜红色,边缘锐利,表面光滑;模型组肝脏体积明显增高,边缘变钝,呈土黄色,质软,切面有油腻感,呈典型脂肪肝外观。各给药组肝脏体积增大,表面呈浅黄色,油腻感略减轻。
2.10.2 形态学观察 对照组肝细胞索围绕中央静脉呈放射状排列,肝细胞形态如常,汇管区无异常。模型组肝细胞大片脂肪变性,变性方式以胞质内小脂滴为主,肝细胞重度肿胀;肝细胞大片萎缩、坏死,不见残余的正常肝细胞索;汇管区炎性反应细胞浸润。二甲双胍组肝细胞大片脂肪变性,受累面积较模型组减少,肝细胞中度肿胀;见少量残余正常肝细胞索,汇管区炎性反应细胞浸润。辛伐他汀组肝细胞脂肪变性,受累面积明显减少,肝细胞轻度肿胀;见多量残余正常肝细胞索,汇管区少量炎性反应细胞浸润。降糖消脂片高剂量组肝细胞轻度脂肪变性,受累面积明显减少,肝细胞轻度肿胀,见多量残余正常肝细胞索,汇管区炎性反应细胞浸润。降糖消脂片中、低剂量组肝细胞中度脂肪变性,受累面积略减少,肝细胞中度肿胀,汇管区炎性反应细胞浸润。见图1。

图1 给药8周各组肥胖大鼠肝脏镜下照片 (HE染色,×100)
注:A对照组;B模型组;C二甲双胍0.3 g/kg组;D辛伐他汀4 mg/kg组;E降糖消脂片8 g/kg组;F降糖消脂片4 g/kg组;G降糖消脂片2 g/kg组
2.10.3 肝脏脂肪变性分级 Ridit分析结果显示,降糖消脂片各剂量组与模型组比较差异有统计学意义(P<0.05~0.01),肝脏脂肪变性有明显改善。见表14。
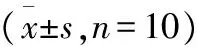
表14 降糖消脂片对肥胖大鼠肝脏脂肪 变性程度的影响
注:与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.11 降糖消脂片对肥胖大鼠脂肪的影响
2.11.1 形态学观察 对照组脂肪细胞大小均一,排列匀称,未见新生脂肪细胞及间质炎性改变。模型组脂肪囊泡大小不等,新生脂肪细胞可见,细胞较小,核圆居中,胞质内见小脂滴。脂肪间血管轻度扩张、充血,少量炎性反应细胞浸润。二甲双胍组脂肪囊泡大小不等表现减轻,少量新生脂肪细胞,间质少量炎性反应表现。辛伐他汀组脂肪囊泡大小不等表现减轻,见少量新生脂肪细胞,间质少量炎性反应表现。降糖消脂片大剂量组脂肪囊泡大小不等表现减轻,见少量新生脂肪细胞,间质轻度炎性反应表现。降糖消脂片中、小剂量组脂肪囊泡大小不等表现减轻,见不等量新生脂肪细胞,间质少量炎性反应表现。见图2。

图2 给药8周各组肥胖大鼠脂肪镜下照片 (HE染色,×400)
注:A对照组;B模型组;C二甲双胍0.3 g/kg组;D辛伐他汀4 mg/kg组;E降糖消脂片8 g/kg组;F降糖消脂片4 g/kg组;G降糖消脂片2 g/kg组
2.11.2 脂肪细胞计数 计数每个高倍视野中脂肪细胞数,每组计30个高倍镜视野,取平均值。结果表明:与模型组比较,降糖消脂片各剂量组脂肪细胞数目明显减少(P<0.05)。见表15。
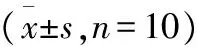
表15 降糖消脂片对肥胖大鼠脂肪细胞 数目的影响
注:与对照组比较,**P<0.01,与模型组比较,△P<0.05,△△P<0.01
3 讨论
肥胖和超重是心血管病、糖尿病、慢性肾病、多种癌症和一系列骨骼肌肉病的风险因素,这一点已经被大量流行病学研究结果证实。肥胖症在全球范围内持续增长,1980—2013年成人肥胖率增加了28%,儿童肥胖率增加达47%,目前约2.1亿人口为超重和肥胖[6]。我国肥胖症也逐年增多,研究显示我国成年男子腹型肥胖率达35.3%,女性腹型肥胖率则高达51.7%[7]。因而,如何有效防治肥胖及其并发症已成为一个严重的公共健康问题[8]。
肥胖症属于中医学“痰证”“水肿”“虚劳”等范畴,现代学者将肥胖症的常见中医证型分为痰湿内盛证、脾虚湿胜证、脾肾阳虚证和胃热滞脾证,茯苓、白术、泽泻、大黄、山楂、黄芪、甘草等为治疗肥胖症的最常用中药[9-10]。降糖消脂片是魏子孝教授基于对2型糖尿病的中医病机认识,结合个人临床体会,汲取中药药理研究的成果,拟订用于治疗2型糖尿病的中药复方。前期的临床研究结果显示,除了具有明显的降糖效果之外,还可以显著降低糖尿病患者的体质量及体质量指数[3]。肥胖与2型糖尿病常常共同发生,肥胖可引起胰岛素抵抗和慢性炎性反应状态,胰岛素抵抗会导致2型糖尿病的发生,肥胖常常是糖尿病前期的常见症状[11]。本研究观察了降糖消脂片对肥胖大鼠体质量及脂质代谢的调节作用。
世界卫生组织(WHO)对成人做出的超重和肥胖定义如下:身体质量指数等于或大于25时为超重,身体质量指数等于或大于30时为肥胖[12]。然而,WHO制定的评价肥胖的指标只适用于衡量人的肥胖程度,对大鼠不适用,故本研究采用Lee′s指数来衡量大鼠的肥胖程度。高脂饲料配方各不相同,含胆盐的高脂饲料可促进大鼠有效吸收胆固醇与脂肪。由于饲料中脂肪含量高,较油腻,导致大鼠进食量减少,但其体质量明显增加,出现明显的肥胖[13]。此时发生的代谢紊乱主要体现在脂代谢上,表现为血中FFA、TC、TG、LDL-C升高,HDL-C降低。肝脏是脂质和脂肪酸代谢的重要部位,其合成、分解和代谢在严密调控系统调节下保持相对平衡,当某些因素使调控系统受损,肝脏的脂质及脂肪酸过多,则脂肪沉积在肝脏,发生脂肪肝[14-16]。
肥胖大鼠灌胃给药2个月后,降糖消脂片高、中剂量组的体质量明显降低,肥胖症状明显减轻,Lee′s指数和TC、LDL明显降低,TG有下降的趋势;高剂量组HDL明显升高;降糖消脂片各剂量组FFA明显降低,肝脏指数有降低的趋势。病理结果显示:降糖消脂片各剂量组的肝脏及脂肪组织的病理变化与模型组比较,有不同程度的减轻;肝脏脂肪变性分级结果显示:降糖消脂片各剂量组肝脏脂肪变性有明显改善。过多的脂肪组织释放较多的FFA,并参与IR的发生。本实验中模型组FFA明显高于对照组,而降糖消脂片各剂量组FFA比模型组明显降低,差异极其显著。因此,分析降糖消脂片的降脂机制有可能是通过降低FFA,而改善脂代谢紊乱。
综上所述,降糖消脂片对肥胖大鼠有明显减重、降脂、改善肝脏脂肪变性的作用,其机制可能与降低FFA,改善脂代谢紊乱有关。该研究为后期降糖消脂片治疗肥胖症的相关研究打下基础。
[1]Seidell JC,Halberstadt J.The global burden of obesity and the challenges of prevention[J].Ann Nutr Metab,2015,66 Suppl 2:7-12.
[2]Valenza M,Steardo L,Cottone P,et al.Diet-induced obesity and diet-resistant rats:differences in the rewarding and anorectic effects of D-amphetamine[J].Psychopharmacology (Berl),2015,232(17):3215-3226.
[3]陈筑红,夏城东.降糖消脂胶囊与吡格列酮片治疗2型糖尿病气阴两虚、痰瘀互阻证的非劣效性试验[J].中国中西医结合杂志,2014,34(9):1042-1046.
[4]葛争艳,金龙,杨斌,等.降糖消脂片对KK-A~y转基因小鼠胰岛素抵抗的影响[J].中国中西医结合杂志,2017,37(3):331-337.
[5]Cluny NL,Eller LK,Keenan CM,et al.Interactive effects of oligofructose and obesity predisposition on gut hormones and microbiota in diet-induced obese rats[J].Obesity (Silver Spring),2015,23(4):769-778.
[6]Smith KB,Smith MS.Obesity Statistics[J].Prim Care,2016,43(1):121-135,ix.
[7]Du P,Wang HJ,Zhang B,et al.Prevalence of abdominal obesity among Chinese adults in 2011[J].J Epidemiol,2017,27(6):282-286.
[8]Srivastava G,Apovian CM.Current pharmacotherapy for obesity[J].Nat Rev Endocrinol,2018,14(1):12-24.
[9]江明洁,林海雄,王晓彤,等.中医治疗肥胖症综述[J].河南中医,2017,37(2):370-372.
[10]曾慧妍,肖颖馥,张锦明,等.基于中医辅助传承系统的中医药治疗单纯性肥胖方剂组方规律分析[J].广州中医药大学学报,2017,34(4):612-616.
[11]邹大进,张征.肥胖与2型糖尿病的治疗新靶点:脂肪细胞型脂肪酸结合蛋白的抑制研究方兴未艾[J].中华糖尿病杂志,2016,8(2):65-67.
[12]Afshin A,Forouzanfar MH,Reitsma MB,et al.Health Effects of Overweight and Obesity in 195 Countries over 25 Years[J].N Engl J Med,2017,377(1):13-27.
[13]Marques C,Meireles M,Norberto S,et al.High-fat diet-induced obesity Rat model:a comparison between Wistar and Sprague-Dawley Rat[J].Adipocyte,2016,5(1):11-21.
[14]Sheridan DA,Aithal G,Alazawi W,et al.Care standards for non-alcoholic fatty liver disease in the United Kingdom 2016:a cross-sectional survey[J].Frontline Gastroenterol,2017,8(4):252-259.
[15]Calzadilla BL,Adams LA.The Natural Course of Non-Alcoholic Fatty Liver Disease[J].Int J Mol Sci,2016,17(5):774.
[16]Reccia I,Kumar J,Akladios C,et al.Non-alcoholic fatty liver disease:A sign of systemic disease[J].Metabolism,2017,72:94-108.

