羊栖菜提取物的体外抗病毒作用
岳路路 高 敏 张秋红 闫 滨
(1 山东中医药大学,济南,250355; 2 济南市食品药品检验检测中心,济南,250102)
2015版《中华人民共和国药典》中规定海藻为马尾藻科植物羊栖菜Sargassum fusiforme(Harv.)Setch.或海蒿子Sargassum pallidum(Turn.)C.Ag.的干燥藻体。具有利水消肿,消痰软坚散结的功能。主治痰饮水肿,瘰疬,睾丸肿痛,瘿瘤。目前,已有许多含海藻成分的中成药,例如,消瘿丸、心通口服液、乳核散结片等等。海藻中含有大量的碳水化合物,其中最重要的是多糖,通常占海藻干物质的50%以上,具有良好的抗肿瘤、抗凝血、抗病毒、降血脂等众多生物活性[1]。羊栖菜作为中药海藻的重要组成部分,已经有文献研究证实其多糖具有抗HSV-1及CVB3的作用。本实验通过提取、分离、纯化羊栖菜,对其提取物进行了体外抗7种第3类病原体病毒的筛选,效果显著。
1 材料与方法
1.1 材料
1.1.1 细胞株 MA104(为RSV、HSV-1、CVB2敏感细胞);Hep2(为CVB3、CVB5敏感细胞);RD(为EV71、CVA16敏感细胞);均由山东省医学科学院微生物室提供。
病毒株RSV(long株,2000年10月引自中国预防医学科学院病毒所毒种室);HSV-1(F株,1996年引自山东医科大学微生物学教研室);EV71(分离自济南市传染病医院手足口病患者,经全序列测定证实为EV71);CVB3(Nancy株,2010年引自山东省防疫站流感病毒室);均由山东省医学科学院微生物室提供。
1.1.2 药物 羊栖菜采集自烟台近海,经山东中医药大学基础医学院闫滨副教授鉴定为羊栖菜。新鲜海藻低温烘干之后研磨成细粉,以海藻粉末:蒸馏水为1∶30的比例,水煎煮4.5~6 h,中间换液共提取3次。合并滤液,旋蒸浓缩为原体积的1/4后,加入5%三氯乙酸,5 000 r/min离心20 min以除去粗提溶液中的蛋白质,所得溶液装入透析袋中透析(3 d左右),将溶液冷冻过夜,加入4倍体积的95%乙醇沉淀多糖,离心取沉淀,真空干燥即可得到羊栖菜粗提粉末[2-4]。再经Smartrose CL-6B凝胶过滤色谱柱过滤进行纯化。采用蒽酮硫酸法测定海藻提取物多糖含量,以0.1 g/L的葡萄糖溶液配制系列浓度溶液,紫外分光光度计在625 nm处测定吸光度(A值),绘制标准曲线,根据回归方程计算海藻粉末的含糖量。以葡萄糖计多糖含量80.41%。
称取适量海藻粉末溶解于PBS中,用0.22 μm的滤器过滤除菌,放置于-20 ℃冰箱备用。
阳性对照药为利巴韦林注射液,50 g/L,产品批号1501166141,辰欣药业股份有限公司生产,作为广谱抗病毒药物,是本实验的阳性对照药。用PBS将其稀释到20 μg/mL的浓度,用0.22 μm的滤器过滤除菌,放置于-20 ℃冰箱备用。
1.1.3 试剂与仪器 细胞培养液(含10%胎牛血清及100 μg/mL青霉素和链霉素的GIBCO生产的1640);细胞维持液(含2%胎牛血清及100 μg/mL青霉素和链霉素的GIBCO生产的1640);细胞消化液(称取Diffico公司胰酶2.5 g溶解于1000 mL PBS制成0.25%胰酶)。细胞消化液放至-20 ℃冷冻备用,其他置于4 ℃冷藏备用。
BC-J160S型水套红外二氧化碳培养箱(上海博讯实业有限公司);荧光倒置显微镜(日本Nikon ECLIPSE Ti系列);HFsafe1200/C型生物安全柜(上海力申科学仪器有限公司)。
1.2 方法
1.2.1 分组与模型制备 细胞生物学方法:按照常规方法复苏细胞,并进行传代,待细胞形态规范、长势良好之时分别以105/mL细胞浓度接种于96孔板,在5%CO2、37 ℃条件下培养,24 h后待细胞长成单层用于下一步实验。
病毒生物学方法:病毒活化,取保存的200 μL毒种分别接种在已长成单层的相关细胞上,加入2%细胞维持液,在35 ℃、5%CO2条件下培养。显微镜下持续观察,细胞病变达到90%时收集。将收获的病毒反复冻融3次,吹打,1 000 r/min离心5 min,上清液定量分装,-40 ℃冰箱冻存备用。病毒毒力测定,用细胞维持液取病毒原液做10倍比系列稀释,纵向重复3孔,横向依次接种100 μL病毒于已长成单层细胞的96孔板上,设置正常对照,35 ℃、5%CO2培养,48 h后观察细胞出现病变情况[5-8]。用MTT法染色,测定490 nm处的A值,然后用Reed-Muench两氏法计算各病毒的半数细胞感染量TCID50。
1.2.2 给药方法 药物细胞毒性测定:将受试药物用细胞维持液进行2倍比稀释12种浓度,分别接种在长成单层RD、MA104、Hep-2细胞的96孔板上,每个浓度重复3孔,37 ℃、5%CO2条件下培养48 h,持续观察药物毒性,显微镜下观察其CPE。
体外药物抗病毒实验:用细胞维持液将药物从第1孔开始2倍比稀释12个浓度,以每50 μL的浓度加在长成单层细胞的96孔板上,设细胞对照、病毒对照以及阳性药对照,药物的每个稀释度设重复3孔。除细胞对照外,各孔加50 μL 100TCID50毒力的病毒。35 ℃、5%CO2条件下培养,显微镜下持续观察。病毒对照孔的CPE达到90%后终止培养[9-12]。
1.2.3 检测指标与方法 药物细胞毒性测定:MTT法染色,酶标仪测定A值,计算药物半数中毒浓度(toxic concentration 50%,TC50)。
体外药物抗病毒实验:正常细胞与相应发生病变细胞图见图1。MTT法染色测定A值,根据公式计算药物半数有效浓度(concentration for 50% of maximal effect,EC50)[13]。
1.3 统计学方法 根据所得检测指标结果计算药物抑毒指数(TI),TI=TC50/EC50,TI大于4者即为有效[14-16]。
2 结果
正常状态的MA104、RD以及Hep-2细胞形态,以分别感染病毒后的细胞形态见图1。正常细胞感染不同的病毒后在细胞形态结构功能等会发生各自特异性的病变,显微镜下观察到细胞形态学的变化,细胞会变圆、变小,细胞皱缩,甚至破裂,折光性变强,或者发生细胞融合,等等。但是在加入羊栖菜提取物之后细胞病变明显减弱,甚至未显现细胞病变,羊栖菜提取物保护细胞免受病毒感染的效果显著,抑毒指数极高。

图1 正常细胞以及病变细胞镜下观(×200)
本实验体外抗病毒药物羊栖菜提取物对RSV、HSV-1、EV71、CVA16、CVB2、CVB3、CVB5等7种病毒的抗病毒效应分别做96孔板实验,为排除羊栖菜提取物对病毒的抑制作用与羊栖菜提取物引起的细胞毒性无关,检测了其对RD、MA104、Hep-2细胞毒性作用,并且考虑到减小对细胞观察的影响,得出对RD细胞TC50=6.11 g/L,对MA104细胞TC50=3.15 g/L,对Hep-2细胞TC50=6.33 g/L,利巴韦林低于100.00 μg/mL的浓度对各细胞存活率无显著影响。
与病毒对照组、利巴韦林对照(EC50=20.00 μg/mL)组比较,羊栖菜提取物对各病毒的药物半数有效浓度见表1。

表1 羊栖菜提取物药物半数有效浓度
根据抑毒指数TI=TC50/EC50公式,得到羊栖菜和利巴韦林对各病毒的TI,可见羊栖菜提取物对上述7种病毒的抑制能力远远优于广谱抗病毒药物利巴韦林,羊栖菜提取物是优质高效的抗病毒药物,尤以对EV71的抑制效果最为明显。见图2。
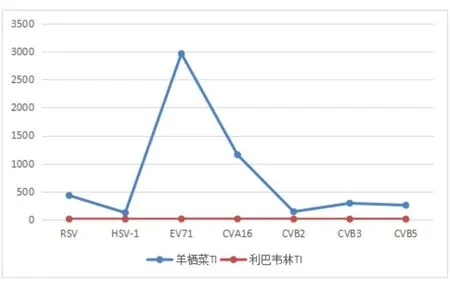
图2 羊栖菜提取物和利巴韦林对各病毒的TI折线图
3 讨论
本实验进行了羊栖菜提取物对呼吸道合胞病毒、单纯疱疹病毒、肠道病毒71型、柯萨奇病毒系列A16、B2、B3、B5等7种病毒的体外细胞水平的抑制实验,实验研究表明羊栖菜提取物具有非常显著的体外抗病毒效果。由于其抗病毒性质的普遍,而且研究所用为第三类病原体病毒,我们可以大胆推测羊栖菜对第三类危害程度病毒(国家根据病原微生物的传染性、感染后对个体或者群体的危害程度,将病原微生物分为四类。第三类病原微生物,是指能够引起人类或者动物疾病,但一般情况下对人、动物或者环境不构成严重危害的微生物)具有广谱抑制作用,此推断有待进一步抗病毒筛选研究和体外药理作用研究证实。其抗病毒作用的机理也是将要进一步研究的方向。
海藻是生长于海洋中的低等隐花植物,种类多,
分布广。在鱼、虾、贝、藻四大类海洋生物中,仅海藻是海洋中的植物,具有地球最大的生物蕴藏量,极具开发潜力。而羊栖菜作为中药用的海藻具有其中医学价值和保健价值,近年来其抗病毒作用愈来愈受到关注,对其抗病毒作用的研究也是对传统中药功能主治的拓展和延伸,对中医学和中药学的继承与发展具有重要的意义。
[1]岑颖洲,王凌云,马夏军,等.羊栖菜多糖体外抗病毒作用研究[J].中国病理生理杂志,2004,20(5):765-768.
[2]岑颖洲,马夏军,王凌云,等.羊栖菜多糖提取工艺及其单糖组成研究[J].药物生物技术,2004,11(6):373-375.
[3]杨铭,郎朗,季宇彬.海藻羊栖菜药用功能研究进展[J].医学理论与实践,2013,26(4):450-451.
[4]谢何杰,叶慧娴,沈婷,等.羊栖菜化学成分和药理活性的研究进展[J].浙江农业科学,2014(4):487-491.
[5]陈恬,贾文祥,杨发龙,等.藏药紫金标抗HSV-1的作用机理研究[J].中国中药杂志,2004,29(9):882-886.
[6]何超蔓,闻良珍.3种中药体外抗巨细胞病毒效应的比较[J].中国中药杂志,2004,29(5):452-455.
[7]方建国,胡娅,汤杰,等.大青叶抗单纯疱疹病毒Ⅰ型的活性研究[J].中国中药杂志,2005,30(17):1343-1346.
[8]田蕾,李晓艳,徐云霞,等.三白草抗单纯疱疹病毒作用及机制[J].中国中药杂志,2012,37(11):1642-1645.
[9]王志洁,杨占秋,黄铁牛.桑寄生乙醇提取物抗柯萨奇病毒B3的实验研究[J].中国中药杂志,2000,25(11):685.
[10]王意忠,崔晓兰,高英杰,等.栀子提取物抗病毒试验研究[J].中国中药杂志,2006,31(14):1176-1178.
[11]黄筱钧,张朝贵.车前草对呼吸道合胞病毒体外抑制作用的研究[J].湖北民族学院学报·医学版,2015,32(2):1-3.
[12]张莉,李园园,史梅等.虎杖苷与白藜芦醇体外抗肠道病毒71型的初步研究[J].临床检验杂志,2014,32(10):779-783.
[13]马书太,李诗标.紫萁贯众提取物体外抗病毒实验研究[J].山东中医杂志,2014,33(8):663-664.
[14]曹泽彧,谢雪,牛莹,等.热毒宁注射液组分抗CoxA16和EV71病毒活性研究[J].中国实验方剂学杂志,2015,21(14):106-110.2015,21(14):106-110.
[15]崔清华,何军,吕旭潇,等.小儿双金清热口服液体外抗病毒作用研究[J].药学研究,2015,34(11):631-633,669.
[16]艾碧琛,贺又舜,赵国荣等.甘露消毒丹及其拆方体外抗肠道病毒71型作用[J].中医杂志,2014,55(8):695-697.

