膀胱癌骨转移的相关预测及诊断因素分析
兰敏,刘家明,徐佳佳,刘明军,陈文昭,陈宣银,黄山虎,刘志礼
骨是实体肿瘤常见的转移位点,如肺癌、前列腺癌、乳腺癌、肾癌等,但膀胱癌骨转移相对少见。由于医疗水平的提高,近年来膀胱癌骨转移患者的数量也在稳定增加。骨转移常伴随骨痛、病理性骨折、脊髓压迫等并发症,是肿瘤患者重要的预后因素[1]。由于费用高、辐射危害、对微小转移病灶敏感性低等缺陷,同位素全身骨扫描作为骨转移最常用的诊断方法,其成本效益遭到了质疑[2]。普通肿瘤标志物无法准确地预测和诊断骨转移,既往有学者探索了预测及诊断恶性肿瘤骨转移的风险因素,发现血钙、血清碱性磷酸酶(alkaline phosphatase,ALP)、血红蛋白(hemoglobin,Hb)等常用的非侵入性检查与恶性肿瘤骨转移有关[3-7],但膀胱癌骨转移的研究相对较少,且目前还没有系统研究证实存在能准确诊断或预测膀胱癌骨转移的生化指标。本研究分析血钙、ALP、Hb与膀胱癌骨转移的关系,探讨其对膀胱癌骨转移的预测及诊断价值。
1 资料与方法
1.1 研究对象 纳入2002年8月-2016年9月在南昌大学第一附属医院初次诊断为膀胱癌且后期随访有骨转移的住院患者35例(骨转移组)、纳入标准为:①年龄≥18岁;②穿刺活检或术中标本经病理诊断为膀胱癌,影像学无骨转移表现的初诊患者,且后期经影像学诊断伴有骨转移;③既往无其他恶性肿瘤病史,并排除其他恶性肿瘤所致的骨转移;④无合并影响血钙、ALP、Hb水平的伴随疾病,如骨代谢紊乱、甲状旁腺功能亢进、肝脏功能障碍和其他恶性肿瘤等。按1:3比例纳入同期105例性别、年龄和随访时间匹配的膀胱癌无骨转移患者(无骨转移组)作为对照进行研究。
1.2 骨转移诊断标准 根据同位素全身骨扫描判断膀胱癌患者是否伴有骨转移,其诊断标准包括:①局部有放射性浓聚,且高于健侧或邻近组织,并排除骨骼外伤、感染、关节炎、退行性变等良性病变;②≥2处部位出现散在放射性浓聚灶;③骨显像结果为阴性,但CT、MRI检查示有骨破坏。
1.3 观察指标 包括:初次诊断为膀胱癌时患者的年龄及血钙、ALP、Hb水平,性别,随访时间,末次随访时的血钙、ALP、Hb水平。
1.4 统计学处理 应用SPSS 22.0软件进行统计分析。计量资料以±s表示,组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验。采用二项式logistic回归分析血钙、ALP、Hb水平与骨转移的关系,ROC曲线评价血钙、ALP、Hb水平预测或诊断骨转移的准确性。P<0.05为差异有统计学意义。
2 结 果
2.1 人口学统计资料分析 骨转移组患者男30例,女5例,年龄54.9±11.0岁,中位年龄63岁,随访时间15.97±9.08个月。无骨转移组男90例,女15例,年龄54.7±11.1岁,中位年龄63岁,随访时间16.02±17.37个月。两组性别、年龄、随访时间差异无统计学意义(P>0.05,表1)。
2.2 膀胱癌骨转移部位分布 膀胱癌骨转移主要集中在中轴骨,四肢骨转移相对少见,其中最常见的骨转移部位是骨盆(25例,71.4%),其次是脊柱,包括颈椎4例(11.4%)、胸椎12例(34.3%)、腰椎13例(37.1%),其他还包括肋骨7例(20.0%)、股骨6例(17.1%)、肩胛骨3例(8.6%)、颅骨3例(8.6%)、肱骨2例(5.7%)、锁骨2例(5.7%)、胸骨2例(5.7%)。
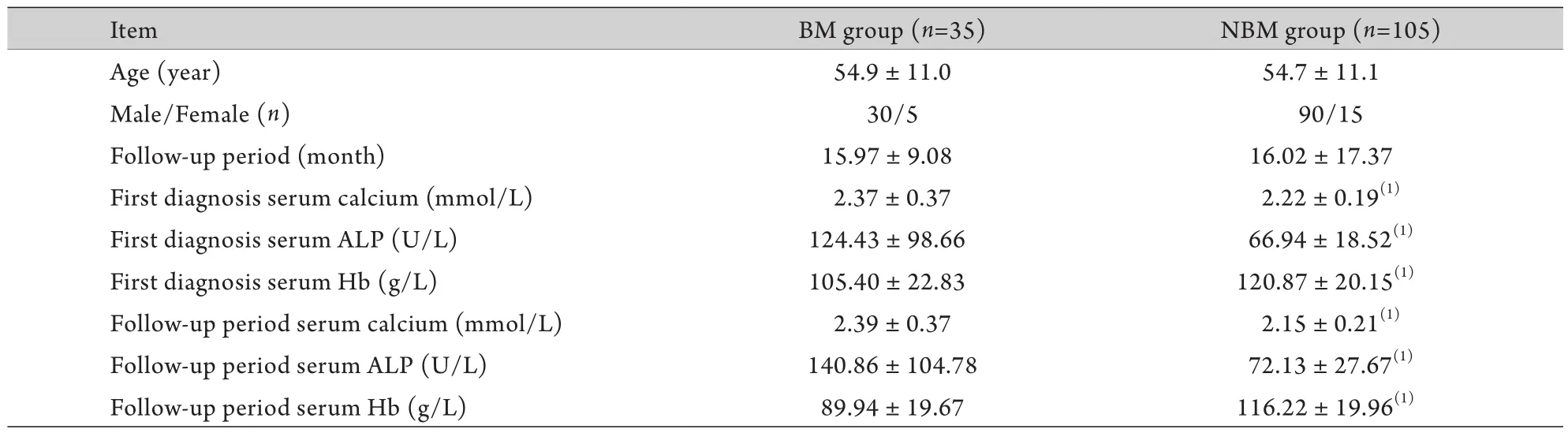
表1 膀胱癌骨转移组与无骨转移组相关因素比较Tab. 1 The differences of the risk factors between urinary bladder neoplasms patients with and without bone metastases
2.3 血钙、ALP、Hb水平预测膀胱癌骨转移的价值 骨转移组患者初次诊断膀胱癌时血钙、ALP、Hb均明显高于无骨转移组(P<0.05,表1)。二项式logistic回归分析结果显示,初诊血钙(OR=7.870,95%CI 1.050~58.975,P=0.045)、ALP(OR=1.025,95%CI 1.009~1.042,P=0.002)、Hb(OR=0.967,95%CI 0.946~0.988,P=0.003)是膀胱癌患者后期是否发生骨转移的独立危险因素(表2),对后期是否发生骨转移具有潜在的预测价值。

表2 初诊血钙、ALP、Hb水平对膀胱癌骨转移预测价值的logistic回归分析Tab. 2 Multivariate logistic regression analysis of calcium,ALP and Hb at firstly diagnosis for predicting bone metastases from urinary bladder neoplasms
2.4 血钙、ALP、Hb水平诊断膀胱癌骨转移价值 骨转移组患者发生骨转移后的血钙、ALP、Hb水平均明显高于无骨转移组(P<0.05,表1)。二项式logistic回归分析结果显示,随访时血钙(OR=15.176,95%CI 1.072~214.876,P=0.044)、ALP(OR=1.016,95%CI 1.002~1.030,P=0.022)、Hb(OR=0.947,95%CI 0.923~0.972,P<0.001)是膀胱癌合并骨转移的独立危险因素(表3),对膀胱癌合并骨转移具有潜在的诊断价值。

表3 随访时血钙、ALP、Hb水平对膀胱癌骨转移诊断价值的logistic回归分析Tab. 3 Multivariate logistic regression analysis of the followup period calcium, ALP and Hb diagnosing bone metastases from urinary bladder neoplasms
2.5 血钙、ALP、Hb水平预测膀胱癌骨转移的准确性 ROC曲线显示,初次诊断膀胱癌时患者的血钙、ALP和Hb水平对预测后期骨转移具有较高价值(曲线下面积分别为0.615、0.704、0.692,截断值分别为2.55mmol/L、97.0U/L、101.5g/L)。其中初诊血钙对预测膀胱癌患者后期骨转移的特异性(97.1%)最高,初诊Hb对预测膀胱癌患者后期骨转移的敏感性(51.4%)最高(表4,图1A-C)。
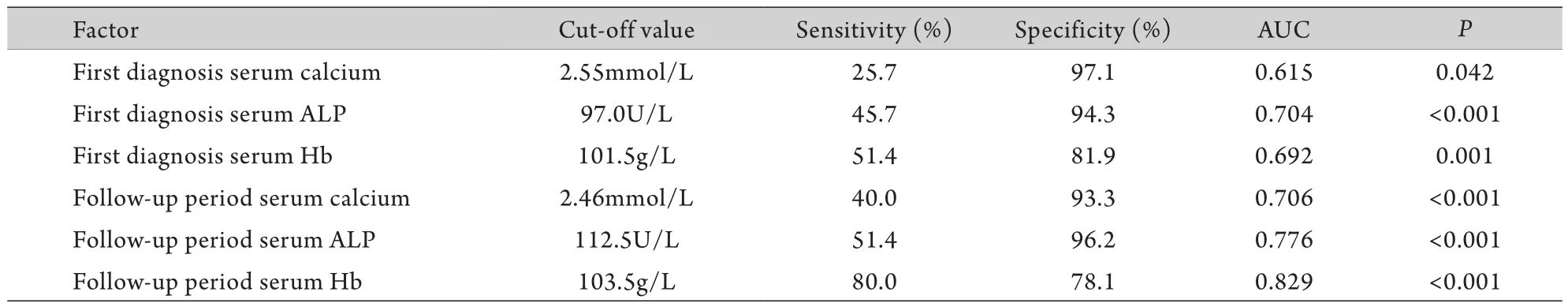
表4 相关因素对预测或诊断膀胱癌骨转移的准确性Tab. 4 The diagnostic accuracy of the factors for predicting or diagnosing bone metastasis from urinary bladder neoplasms
2.6 血钙、ALP、Hb水平诊断膀胱癌骨转移的准确性 ROC曲线显示,后期随访时的血钙、ALP和Hb水平对判断膀胱癌患者是否存在骨转移具有较高价值(曲线下面积分别为0.706、0.776、0.829,截断值分别为2.46mmol/L、112.5U/L、103.5g/L)。其中后期随访时Hb对判断膀胱癌患者是否存在骨转移的特异性(80.0%)最高,ALP对判断膀胱癌患者是否存在骨转移的敏感性(96.2%)最高(表4,图1D-F)。
3 讨 论
本研究结果显示,膀胱癌患者的骨转移部位主要集中在骨盆、脊柱等中轴骨。骨转移可引起局部骨痛、骨质疏松,严重时可导致病理性骨折、椎体塌陷或者肿瘤直接侵犯引起脊髓压迫症状,严重影响患者的生活质量及预期寿命[1-5,8],尤其是发生中轴骨转移的患者,其预期生存期明显低于四肢骨及其他部位的骨转移[9]。因此探索有价值的预测或早期诊断骨转移的临床指标具有重要意义。
正常人体通过激素严格调控肾脏、肠道对钙离子的吸收和骨钙代谢水平,以维持血钙浓度的稳定[10]。Mihai[11]和Joeckel[12]等研究发现,高浓度的血钙可通过增强钙敏感受体表达,促进癌细胞迁移和扩散,促进肿瘤骨转移的发生。本研究发现,患者初次诊断为膀胱癌时的血钙浓度与后期发生骨转移的风险独立相关,具有潜在的预测价值,其截断值为2.55mmol/L,即初次诊断为膀胱癌的患者血钙浓度>2.55mmol/L时,后期发生骨转移的概率较高,而且初诊血钙浓度对预测膀胱癌后期骨转移的特异性(97.1%)最高。
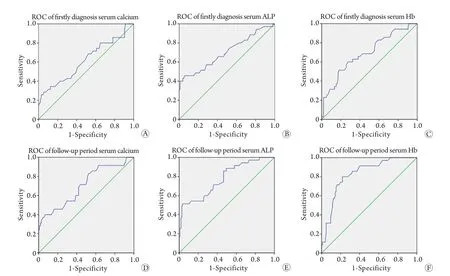
图1 血钙、ALP、Hb水平对膀胱癌骨转移的诊断价值Fig. 1 Diagnostic value of serum calcium, ALP and Hb level for bone metastasis of bladder cancer
ALP主要在肝脏和成骨细胞中合成,是评价肝脏和骨骼功能常用的生化指标[13]。有研究显示,血清总ALP水平能较好地代替骨特异性ALP,是预测恶性肿瘤骨转移的独立危险因素[14-15],且Wymenga等[15]研究发现新诊断或者正在接受治疗的前列腺癌患者ALP>90U/L时有必要密切监测骨扫描结果的动态变化。本研究发现,初诊膀胱癌时的ALP水平是预测后期发生骨转移的独立危险因素,其截断值为97U/L。
Kawai等[16]研究发现,Hb可促进癌细胞黏附到骨骼,是促进前列腺骨转移的重要因素。本研究发现初诊膀胱癌时患者Hb水平与后期发生骨转移独立相关,当Hb<101.5g/L时,能较准确地预测患者后期发生骨转移的风险,且初诊Hb水平预测膀胱癌骨转移的敏感性(51.4%)最高。
Michel等[17]认为肿瘤患者伴有高血钙、高ALP水平或严重贫血是行骨扫描监测骨转移的指征,且有研究发现血钙、ALP和Hb水平是判断恶性肿瘤是否合并骨转移有价值的风险因素[13,18-20]。本研究发现,膀胱癌患者后期随访时的血钙、ALP及Hb水平是其合并骨转移的独立危险因素,截断值分别为2.46mmol/L、112.5U/L、103.5g/L,即膀胱癌患者后期随访时若血钙>2.46mmol/L、ALP>112.5U/L、Hb<103.5g/L,则有必要行骨扫描检查判断是否伴有骨转移。
本研究探讨了血钙、ALP和Hb水平预测及诊断膀胱癌骨转移的临床价值,但是仍然存在一些局限性。首先,本研究为单中心研究,样本量较小,可能会影响分析结果的准确性。其次,本研究分析的因素有限,对肿瘤标志物、肿瘤分级、肿瘤大小和其他生化指标等未进行分析。下一步将开展多中心、大样本量研究,同时纳入更多的指标,以进一步论证本研究结果。
综上所述,膀胱癌患者血钙、ALP及Hb水平对预测和诊断骨转移有一定的临床价值。初次诊断为膀胱癌的患者,其血钙>2.55mmol/L、ALP>97U/L、Hb<101.5g/L可预测后期发生骨转移的风险,膀胱癌后期随访时血钙>2.46mmol/L、ALP>112.5U/L、Hb<103.5g/L是判断患者是否合并骨转移的风险因素,可为临床早期诊断和早期治疗骨转移提供帮助,从而改善患者的生存质量,延长生存时间。
[1]Leeming DJ, Koizumi M, Byrjalsen I,et al. The relative use of eight collagenous and noncollagenous markers for diagnosis of skeletal metastases in breast, prostate, or lung cancer patients[J].Cancer Epidemiol Biomarkers Prev, 2006, 15(1): 32-38.
[2]Wood SL, Brown JE. Skeletal metastasis in renal cell carcinoma:current and future management options[J]. Cancer Treat Rev,2012, 38(4): 284-291.
[3]Chen SC, Kuo PL. Bone metastasis from renal cell carcinoma[M]. Int J Mol Sci, 2016, 17(6): E987.
[4]Xu Y, Xu XH, Tian H. Application value of radionuclide bone scintigraphy and measurements of serum prostate-specific antigen, alkaline phosphatase and bone-specific alkaline phosphatase in diagnosis of bone metastasis in prostate cancer patients[J]. West China Med J, 2010, 25(7): 1294-1296. [徐颖,徐晓辉, 田华. 放射性核素骨显像和血清前列腺特异抗原、碱性磷酸酶、骨特异性碱性磷酸酶测定在前列腺癌骨转移诊断中的应用价值[J]. 华西医学, 2010, 25(7): 1294-1296.]
[5]Tang Q, Zhao H, Jia R,et al. Correlation of the bone turnover markers BAP and β-CTX with bone metastasis progress in lung cancer patients [J]. Chin J Lung Cancer, 2013, 16(3): 144-147.[唐琼, 赵辉, 贾锐, 等. BAP和β-CTX与肺癌骨转移进展程度的相关性[J]. 中国肺癌杂志, 2013, 16(3): 144-147.]
[6]Lin JM, Liu JM, Zhou Y,et al. Risk factors and characteristics of prostate cancer bone metastases[J]. Med J Chin PLA, 2017,42(8): 707-711. [林军明, 刘家明, 周扬, 等. 前列腺癌骨转移的特点及其相关危险因素分析[J]. 解放军医学杂志, 2017,42(8): 707-711.]
[7]Xu RS, He WG, Mei Y,et al. Clinical study on89SrCl2combined with99Tc-MDP in the treatment for bone metastases from prostate cancer[J]. J Logist Univ PAP (Med Sci), 2016, 25(9):731-734. [徐蓉生, 何文果, 梅艳, 等.89SrCl2联合99Tc-MDP治疗50例前列腺癌骨转移的临床研究[J]. 武警后勤学院学报(医学版), 2016, 25(9): 731-734.]
[8]Bienz M, Saad F. Management of bone metastases in prostate cancer: a review[J]. Curr Opin Support Palliat Care, 2015, 9(3):261-267.
[9]Kume H, Kakutani S, Yamada Y,et al. Prognostic factors for renal cell carcinoma with bone metastasis: who are the long-term survivors?[J]. J Urol, 2011, 185(5): 1611-1614.
[10]Saylor PJ, Armstrong AJ, Fizazi K,et al. New and emerging therapies for bone metastases in genitourinary cancers[J]. Eur Urol, 2013, 63(2): 309-320.
[11]Mihai R, Stevens J, McKinney C,et al. Expression of the calcium receptor in human breast cancer -- A potential new marker predicting the risk of bone metastases[J]. Eur J Surg Oncol,2006, 32(5): 511-515.
[12]Joeckel E, Haber T, Prawitt D,et al. High calcium concentration in bones promotes bone metastasis in renal cell carcinomas expressing calcium-sensing receptor[J]. Mol Cancer, 2014, 13:42.
[13]Sonpavde G, Pond GR, Berry WR,et al. Serum alkaline phosphatase changes predict survival independent of PSA changes in men with castration-resistant prostate cancer and bone metastasis receiving chemotherapy[J]. Urol Oncol, 2012,30(5): 607-613.
[14]Lim SM, Kim YN, Park KH,et al. Bone alkaline phosphatase as a surrogate marker of bone metastasis in gastric cancer patients[J].BMC Cancer, 2016, 16: 385.
[15]Wymenga LF, Boomsma JH, Groenier K,et al. Routine bone scans in patients with prostate cancer related to serum prostatespecific antigen and alkaline phosphatase[J]. BJU Int, 2001,88(3): 226-230.
[16]Kawai N, Kunimatsu M, Tozawa K,et al. Human prostate cancer cells adhere specifically to hemoglobin: a possible role in bonespecific metastasis[J]. Cancer Lett, 2001, 171(2): 201-207.
[17]Michel F, Soler M, Imhof E,et al. Initial staging of non-small cell lung cancer: value of routine radioisotope scanning[J]. Thorax,1991, 46(7): 469-473.
[18]Voorzanger-Rousselot N, Juillet F, Mareau E,et al. Association of 12 serum biochemical markers of angiogenesis, tumour invasion and bone turnover with bone metastases from breast cancer: a crossectional and longitudinal evaluation[J]. Br J Cancer, 2006,95(4): 506-514.
[19]Mercadante S, Gebbia V, Marrazzo A,et al. Anaemia in cancer:pathophysiology and treatment[J]. Cancer Treat Rev, 2000,26(4): 3033-11.
[20]Yildiz I, Sen F, Kilic L,et al. Prognostic factors associated with the response to sunitinib in patients with metastatic renal cell carcinoma[J]. Curr Oncol, 2013, 20(6): 546-553.

