假单胞菌HC5对马铃薯晚疫病菌的抑制作用研究
张艳萍,令利军,赵 瑛,厚毅清
(1.甘肃省农业科学院生物技术研究所,甘肃 兰州 730070;2.西北师范大学生命科学学院,甘肃兰州 730070)
马铃薯晚疫病是由致病疫霉[Phytophthora infestans(Mont.)de Bary]引起的一种毁灭性的病害,严重影响着马铃薯的产量和品质[1-2]。目前,马铃薯晚疫病防治主要包括化学防治、抗病育种等[3]。随着科学技术不断发展进步,利用生物种间关系、种内关系,调节有害生物种群密度的生物防治手段越来越受到人们的重视,这种生物防治措施具有安全、有效和无污染等特点,与保护生态环境和社会协调发展的要求相吻合[4]。
我们从土壤中分离得到1株对马铃薯晚疫病菌具有良好抑制作用的假单胞菌,并命名为HC5。假单胞菌在自然界分布广泛,种类繁多,是植物根际土壤周围起生物防治功能的主要细菌类群[5]。目前,关于假单胞菌的应用研究有了大量的报道[6-12],它们可以产藤黄绿脓素(pyoluteorin,Plt)、吡咯菌素(pyrrolnitrin,Prn)、1-羧基吩嗪(phenazine-lcaboxylic acid,PCA) 等多种抗生素,对多种病菌具有拮抗作用[13],涉及领域包括用于农业生物防治、植物生长调节、环境保护和医药开发等[14-16]。我们从假单胞菌HC5发酵液对马铃薯晚疫病菌的抑制能力和HC5发酵液在不同温度、pH以及紫外线照射时间下对马铃薯晚疫病菌抑制的稳定性方面进行了研究,以期为菌株HC5在马铃薯晚疫病菌防治方面的应用推广提供参考依据。
1 材料与方法
1.1 供试材料
供试菌株HC5从土样中分离筛选获得。供试马铃薯晚疫病菌由甘肃省农业科学院植物保护研究所提供。
1.2 培养基
试验所用的培养基为黑麦西红柿培养基(HX):黑麦60 g、西红柿汁100mL、碳酸钙0.4 g、琼脂15 g,加水至1 L。发酵用培养液为液体牛肉膏蛋白胨培养基(NA):牛肉浸膏3 g、蛋白胨10 g、氯化钠5 g,加水至1 L,pH 7.0。
1.3 菌株HC5对马铃薯晚疫病菌的拮抗测定
采用皿内涂布法、平板对峙法和胞外分泌物平板渗透法分别研究,并用抑菌率评价菌株HC5对马铃薯晚疫病菌的抑制能力。抑菌率=[(对照菌落半径-处理菌落半径)/对照菌落半径]×100%。
1.3.1 皿内涂布法 将制备好的HC5菌株发酵菌液50 μL均匀涂布在直径为9cm的HX平板中,随后在平板中央接入直径为0.5cm的马铃薯晚疫病菌饼,20℃左右黑暗培养10 d,测量病原菌的菌落半径,计算抑菌率。取50 μL的无菌培养液涂布于HX平板中,接种病原菌块为对照。试验重复3次。
1.3.2 平板对峙法 在直径为9cm的HX平板中心接种直径为0.5cm的马铃薯病原菌饼,20℃左右黑暗培养7 d后,在距中央2.5cm处接入浸有菌株HC5发酵菌液、直径为5mm的滤纸圆片,20℃左右黑暗继续培养。设接种无菌培养液的处理为对照,试验重复3次。10 d后测量病原菌的菌落半径,计算抑菌率。
1.3.3 平板渗透法 将菌株HC5在液体NA培养基上振荡培养2~3d,180 r/min,28℃。发酵后的菌液离心去除菌丝,12 000 r/min,10min。取上清液,用0.22 μm无菌过滤器过滤,获得胞外分泌物原液。将分泌物原液按1∶10的比例加入到HX培养基中,混匀制成平板。然后将直径0.5cm的马铃薯病原菌饼接种于中央,20℃左右黑暗培养10d。设加入无菌培养液到HX培养基中制成的平板,接入病原菌饼的为对照,试验重复3次。10 d后测量病原菌的菌落半径,计算抑菌率。
1.4 菌株HC5对马铃薯晚疫病菌抑制稳定性的测定
采用平板渗透法进行菌株HC5胞外分泌物对马铃薯晚疫病菌抑制作用稳定性研究。设加入无菌培养液到培养基中制成的平板,接入病原菌饼的为对照1;加入不经过各项处理的胞外分泌物到培养基中制成的平板,接入病原菌饼的为对照2。
1.4.1 不同温度处理后的抑制作用 将菌株HC5的胞外分泌物在40℃、50℃、60℃、70℃、80℃、90℃、100℃温度条件下分别处理10min、20min、30min后,加入培养基中进行试验测定,每处理均重复3次。
1.4.2 不同pH处理后的抑制作用 将菌株HC5的胞外分泌物用1MNaOH或1MHCl调整到处理所需的pH:3.0、5.0、7.0、9.0、11.0,分别处理2 h、3 h、4 h后,再用1MNaOH或1MHCl调整到pH为7.0,随后加入培养基中进行试验测定,每处理均重复3次。
1.4.3 紫外线处理后的抑制作用 将菌株HC5的胞外分泌物在紫外灯下20cm处照射30min、60min、90min、120min、150min后,加入培养基中进行试验测定,每处理均重复3次。
2 结果与分析
2.1 菌株HC5对马铃薯晚疫病菌的拮抗效果
采用皿内涂布法、平板对峙法和胞外分泌物平板渗透法分别评价了菌株HC5对马铃薯晚疫病菌的抑制能力,结果显示,菌株HC5对马铃薯晚疫病菌有很强的抑制作用。如图1,接入菌株HC5后,马铃薯晚疫病原菌几乎不生长,抑菌率基本都在100%。

图1 不同方法菌株HC5对马铃薯晚疫病菌的抑制效果
2.2 菌株HC5对马铃薯晚疫病菌抑制的稳定性
2.2.1 不同温度处理对抑制作用的影响 如图2所示,菌株HC5胞外分泌物在40℃和50℃下处理10min、20min、30min,对马铃薯晚疫病菌依然有较好的抑制作用,马铃薯晚疫病菌几乎不生长;从60℃开始到100℃,对马铃薯晚疫病菌的抑制作用就受到影响,不论是10min的短时间处理还是30min的长时间处理,均破坏了抑制作用,马铃薯晚疫病菌生长状态和对照无差别。
2.2.2 不同pH处理对抑制作用的影响 如图3所示,菌株HC5胞外分泌物在pH 5.0~11.0处理下,对马铃薯晚疫病菌的抑制作用没有影响,马铃薯晚疫病菌受到抑制,几乎不生长;在pH 3.0处理下,对马铃薯晚疫病菌的抑制作用有影响,破坏了抑制作用,马铃薯晚疫病菌生长正常。

图2 不同温度处理对抑制作用的影响

图3 不同pH处理对抑制作用的影响
2.2.3 紫外线处理对抑制作用的影响 如图4所示,菌株HC5胞外分泌物在紫外线下照射,不论是30min的短时间处理还是120min的长时间处理,对马铃薯晚疫病菌的抑制作用均没有影响,依然有较好的抑制作用,马铃薯晚疫病菌几乎不生长。
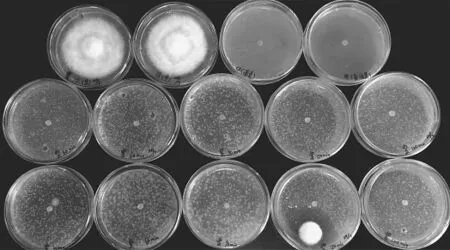
图4 紫外线处理对抑制作用的影响
3 小结与讨论
为了丰富马铃薯晚疫病的生物防治资源数据库,我们从土壤中分离筛选,获得了对马铃薯晚疫病菌具有较强拮抗作用的假单胞菌HC5。采用皿内涂布法、平板对峙法和平板渗透法分别评价了HC5菌株发酵液对马铃薯晚疫病菌的抑制能力。结果显示,不同方法下,菌株HC5发酵液对马铃薯晚疫病菌均具有较强的抑制作用。采用平板渗透法进一步研究了菌株HC5发酵液在不同温度、pH以及紫外线照射时间对马铃薯晚疫病菌抑制的稳定性,结果显示,菌株HC5发酵液在温度50℃以下,pH 5~11,紫外线照射120min均对马铃薯晚疫病菌具有抑制作用,表现出的耐受稳定性较强,具有应用潜力。
国外对马铃薯晚疫病生物防治的研究较早。Filippov已将Pseudomonas putida和Bacillus subtilis应用于马铃薯晚疫病的防治中[17]。Jindal K等测试了从叶表面分离得到的6种真菌对P.infestans有抑制作用[18]。近年来,国内在生防菌防治晚疫病方面也有一些报道。中国农业科学院生物防治所杨怀文等[19]报道嗜线虫致病杆菌发酵液对P.in-festans有一定的抑制作用;王树桐[20-22]研究了88种中草药的抑菌活性,并进一步研究了知母提取物对致病疫霉抑菌作用及抑菌机制;蒋继志等[23-24]研究发现,8种真菌发酵液和大蒜、洋葱、丁香等植物离体组织及其提取物对马铃薯晚疫病病菌也都有强烈抑制作用。可见微生物群已经可以作为寻找和研制马铃薯晚疫病生物拮抗制剂的重要资源。
本研究通过拮抗性实验表明,HC5的发酵液中可能分泌有某些抗生素而抑制植物病原菌的生长,具体是什么物质还有待进一步研究。在本研究中,该菌表现具有较强的耐高温和耐碱等特点,受环境的影响较小,防效比较稳定,这一结果为后期将其应用于生物农药研发奠定了一定基础。
[1]ZHU J,ZHANG Z,YANG Z.General research methods on pathogen of potato late blight(Phytophthora infestans)[J].Journal of Agricultural University of Hebei,2001,24(2):132-134.
[2]DUNCAN J.Phytophthora-an abiding threat to our crops[J].Microbiology today,1999,26:114-117.
[3]李 杨.黑附球菌XF1菌株对马铃薯晚疫病的生防作用[D].保定:河北农业大学,2010.
[4]惠娜娜,李继平,李青青,等.甘肃马铃薯晚疫病病菌交配型及对甲霜灵的敏感性[J].甘肃农业科技,2010(10):8-11.
[5]WELLER D M,RAAIJMAKERS J M,GARDENER B B,et al.Microbial populations responsible for specific soil suppressiveness to plant pathogens[J].Annual Review of Phytopathology,2002,40(1):309-348.
[6]张 亚,苏 品,刘双清,等.拮抗假单胞菌SU8对几种植物病原真菌的抑制作用[J].农药,2013,52(12):917-920.
[7]郭 丛,杨金广,申莉莉,等.一株对TMV具有显著拮抗活性的恶臭假单胞菌的筛选与鉴定[J].华南农业大学学报,2011,32(3):57-60.
[8]谯天敏,张 静,赵 芳,等.铜绿假单胞菌发酵条件优化及抗菌物质研究[J].南京林业大学学报(自然科学版),2014,38(5):45-50.
[9]王秋君,常志州,王光飞,等.铜绿假单胞菌结合生物熏蒸防控辣椒疫病的效果[J].江苏农业学报,2015,31(2):290-297.
[10]张望月,高 健,张 超,等.五种假单胞菌的分离鉴定及其生物活性[J].微生物学报,2013,53(9):957-965.
[11]李守萍,程玉娥,唐 明,等.油松菌根促生细菌——荧光假单胞菌的分离与鉴定[J].西北植物学报,2009,29(10):2103-2108.
[12]郝晓娟,刘 波,谢关林,等.铜绿假单胞菌FJAT一346对番茄枯萎病的生防作用[J].山西农业大学学报:自然科学版,2011,31(1):39-43.
[13]蓝希钳,周泽扬,胡军华,等.假单孢菌20#-5菌株YFP对马铃薯晚疫病菌的抑制作用[J].植物保护学报,2003,30:300-304.
[14]SANTOYO G,OROZCO-MOSQUEDA MDC,GOVINDAPPAM.Mechanisms of biocontrol and plant growthpromoting activity in soil bacterial species of Bacillus and Pseudomonas:a review[J].Biocontrol Science and Technology,2012,22(8): 855-872.
[15]GIRI K,RAI JPN.Biodegradation of endosulfan isomers in broth culture and soil microcosm by Pseudomonas fluorescens isolated from soil[J].International Journal of Environmental Studies, 2012,69(5):729-742.
[16]CHARYULU E M,SEKARAN G,RAJAKUMAR G S,et al.Antimicrobial activity of secondary metabolite from marine isolate,Pseudomonas sp.against gram positive and negative bacteria including MRSA[J].Indian Journal of Experimental Biology,2009,47(12):964-968.
[17]FILIPPOV A,KUZNETSOVA M.Different influence of some biofungicides on dynamics of potato plant susceptibilitytoPhytophthora(Mont.)deBary[J].Mikologiya I Fitopatologiya,1994,28(4):64-69.
[18]JINDAL K,SING H,MADHU M,et al.Biological control of Phytophthora infestans on potato[J].Indian Journal of Plant Pathology,1988,6(1):59-62.
[19]杨怀文,张志铭,杨秀芬,等.嗜线虫致病杆菌代谢物对马铃薯晚疫病的抑制作用[J].中国生物防治, 2000,16(3):111-113.
[20]王树桐,宋风平,胡同乐,等.知母提取物诱导马铃薯植株抗晚疫病作用机制初探[J].植物保护,2009(4):34-38.
[21]王树桐,曹克强,胡同乐,等.知母提取物对马铃薯晚疫病菌的抑制作用及防病效果[J].植物病理学报,2006,36(3):267-272.
[22]王树桐,王晓燕,刘均玲,等.对马铃薯晚疫病菌(Phytophthora infestans)有杀菌毒性的中草药的筛选[J]. 河北农业大学学报,2001,24(1):101-107.
[23]蒋继志,赵丽坤,史 娟,等.几种真菌发酵液对致病疫霉的抑制作用[J].微生物学通报,2001,28(2): 55-59.
[24]蒋继志,史 娟,赵丽坤,等.几种植物提取物诱导马铃薯对致病疫霉的抗性[J].植物病理学报,2001(2):144-151.

