SPECT-CT结合传统影像学对软骨黏液样纤维瘤的评价
软骨黏液样纤维瘤(chondromyxoid fibroma,CMF)是一种少见的发生于成软骨结缔组织的良性骨骼系统肿瘤,占所有骨肿瘤的1.04%[1],临床症状以局部肿胀、疼痛为主,缺乏特异性,且国内外文献对本病报道甚少,误诊率较高。本文回顾性分析河南省洛阳正骨医院2002年3月至2016年12月经手术病理证实的11例CMF的影像学资料,着重对SPECT-CT及传统影像学表现进行文献复习并探讨其意义。
1 资料与方法
1.1 一般资料 11例中,男6例,女5例;年龄8~58岁,中位年龄21.1岁;长管状骨9例(81.82%),均未跨骨骺,其中胫骨4例(44.44%)(远端2例,近端2例),股骨远端3例(33.33%),肱骨近端1例(11.11%),腓骨远端1例(11.11%);髂骨1例(11.11%);腰椎棘突1例(11.11%)。病程3个月~8年,病灶大小2.1cm ×2.3cm~8.7×4.5 cm。
1.2 仪器与方法 11例均行X线平片检查,9例行CT检查,4例行MRI平扫加增强扫描,3例行SPECTCT检查。X线检查使用锐科公司生产的500MAX线机常规投照。CT检查采用Siemens Symbia True point SPECT-CT仪同机6层螺旋CT对X线显示病灶进行三维重建。MRI扫描采用Philips 3 T MRI仪,行SE T1WI及FSE T2WI脂肪抑制序列横断位、矢状位扫描;增强扫描采用高压注射器经肘静脉快速注射对比剂Gd-DTPA,剂量0.1 mmol/kg体质量,流率3.0 mL/ s,行冠状位、矢状位、横断位SE T1WI扫描。SPECTCT检查首先采用Symbia-T6对病灶行SPECT及同机CT的断层扫描,后使用本机自带软件进行图像融合形成SPECT-CT图像。
1.3 图像分析 由2位影像诊断主任医师采用双盲法逐一对患者的X线、CT、MRI及SPECT-CT影像资料总结、分析,意见不一致时经协商决定。
2 结果
2.1 X线及CT表现 11例中X线平片示10例出现偏心性、溶骨性、膨胀性骨质破坏,其中1例单囊样改变可见明显骨质缺损区(图1a),9例多囊样改变(图2a)且其中1例病灶似皂泡样改变曾被误诊为骨巨细胞瘤;10例均为单发,病灶周围均有硬化边,未见明显钙化影。余1例未见明显异常(图3a)。9例CT检查示病灶外缘均为粗细不等骨嵴呈波浪样改变伴病灶周边硬化,边界清晰,5例病理骨折伴不同程度突出骨皮质的软组织肿块,2例病灶内见少量斑点状钙化影(图2b)。所有病变处均无骨膜反应、长管状骨均未累及骨骺。
2.2 MRI表现 4例中1例T1WI呈等信号(与肌肉信号一致)(图1b);T2WI脂肪抑制序列呈高信号伴周围骨髓及软组织水肿(图1c);增强扫描病灶内部轻度均匀强化,病灶包膜中度强化(图1d)。3例T1WI呈等夹杂散在低信号;T2WI脂肪抑制序列呈混杂信号,其中1例病灶周围骨髓及软组织水肿,增强扫描3例明显不均匀强化(图2c)。4例病灶周边硬化边在T1WI及T2WI脂肪抑制序列均为低信号,软组织肿块与周边组织边界清晰。
2.3 SPECT-CT表现 3例病灶核素均呈异常浓聚,浓聚面积均大于病变范围,周边浓聚明显,中心稀疏或缺如,呈环形浓聚(图3b)。

图1 男,11岁,右腓骨下段软骨黏液样纤维瘤 图1a X线平片示右腓骨下段明显局部骨质缺损伴硬化边 图1b T1WI横断位示软组织肿块突出骨皮质外呈等信号 图1c T2WI脂肪抑制像示软组织肿块呈均匀高信号伴骨髓、软组织水肿,病灶周围波浪状低信号为骨质硬化边图1d 冠状位T1WI增强扫描病灶中心轻度均匀强化,边缘中度强化 图2 女,8岁,
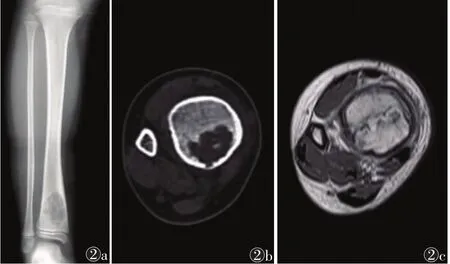
图2 女,8岁,右胫骨下段软骨黏液样纤维瘤 图2a X线平片示右胫骨下段病灶多囊样改变伴轻度硬化边图2b CT示病灶外缘呈波浪样改变伴硬化,中心散在高密度钙化影 图2c 横断位T1WI增强扫描呈不均匀强化,突出骨皮质的软组织肿块与周围组织边界清晰

图3 男,58岁,腰椎L3棘突软骨黏液样纤维瘤 图3a X线平片未见明显异常图3b SPECT-CT示L3棘突局部骨质缺损,病灶边缘异常核素浓聚,中心核素浓聚缺如
3 讨论
3.1 CMF概述 CMF起源于形成软骨结缔组织中的间叶细胞,该细胞具有分化为软骨细胞、纤维细胞等的能力,CMF并非直接由软骨细胞形成,Jaffe和Lichtenstein于1948年根据该肿瘤内部含有软骨、黏液、纤维组织成分首先提出并命名其为CMF。2013年WHO骨肿瘤分类标准中将CMF定性为部分具有侵袭性的肿瘤。近年来国外学者[2-3]开展对CMF细胞遗传学的研究表明,CMF发病可能与基因有关,尤其是与第6对染色体长臂变异有关,该对染色体携带骨形态发生蛋白BMP6、胶原蛋白(COL9A1、COL10A1)、重组人胰岛素样生长因子-2(IGF2)参与正常软骨的形成。CMF好发于10~30岁,无种族、性别差异,男性稍多于女性,本组10~30岁8例,最小8岁,最大58岁,男6例,女5例,与文献[1]报道一致。CMF的发病部位中,长骨占46.9%,其中,胫骨占55.4%、股骨占19.2%、腓骨占10.8%、桡骨占3.1%;骶骨、脊椎、颅骨等少见[4]。本研究长骨9例(81.82%),其中胫骨4例(44.44%),股骨3例(33.33%),肱骨1例(11.11%),腓骨1例(11.11%),与文献有差异,考虑与本研究样本量较小有关。镜检示:丰富的软骨样及黏液样细胞基质中散在分布着由星形细胞或梭形细胞形成的小叶状结构。软骨、黏液、纤维样成分以不同比例存在,晚期可出现钙化影,由于软骨发生钙化需相当长时间,因此少见钙化,其钙化率仅10%[5]。
3.2 影像学表现 CMF多发生于长骨干骺端,病变为单囊或多囊,呈圆形或椭圆形的偏心性、溶骨性、透光性、膨胀性骨质破坏,伴硬化边及粗细不等的骨嵴分隔,其外缘呈波浪样改变,一般不累及骨骺且无骨膜反应。本组11例中10例X线平片呈边界清楚的偏心性、溶骨性、膨胀性骨质破坏,均伴病灶边缘骨质硬化,未见明显钙化影;余1例未见明显异常。该病X线平片的钙化发现率仅1.5%~3%[6],CT因其高密度分辨力可发现X线未发现的钙化点,能更清晰地显示骨皮质情况、硬化边及病灶内部结构。文献[7]报道CMF少见骨质破坏及软组织肿块,本组9例行CT检查,其中5例骨皮质断裂并软组织肿块突出,与文献不符。笔者认为软组织肿块是否突出与病变时期有关,病变早期以骨皮质受侵蚀为主,随病程进展,骨皮质破坏严重、变薄甚至断裂,病变内软组织突出皮质外。该特点还需大样本研究证实。T1WI多呈低信号,T2WI及压脂序列可为高信号,但多为混杂信号,其信号主要受软骨、黏液、纤维三者的比例影响,黏液及软骨在T1WI呈低信号,T2WI及压脂序列为高信号,纤维及钙化成分在T2WI多呈等或低信号,若软组织肿块内有出血,MRI信号根据出血时期的不同而有差异。MRI增强扫描呈异常明显均匀或不均匀强化。
SPECT-CT检查将功能影像学与解剖影像学有机结合,实现优势互补,弥补核素骨显像的缺点,提高了对骨病的诊断准确率[8]。SPECT-CT可判断病灶成熟程度,为临床选择合理手术治疗时机及术后康复锻炼提供可靠依据。当病灶边缘微骨折处于修复状态或肿块刺激周围组织产生炎症时,则成骨活跃,病变处血流增加,SPECT-CT检查出现异常核素浓聚提示病变处于活动期;CMF处于稳定期时,SPECT-CT示病灶轻度均匀核素浓聚或无核素浓聚,此期可行手术治疗,但仅行搔刮术局部复发率高达80%[9],更可靠的方式是整体切除病灶并植入同种异体骨或人造骨[10]。本组3例行SPECT-CT检查者,均在稳定期行病灶整体切除并植骨术,术后给予锝亚甲基二磷酸盐(云克)治疗,定期复查SPECT-CT,2次局部骨显像剂无增加或全身骨显像未见新发病灶可作为该病稳定、无复发的可靠指标。随访观察,3例中最长病程8年,至今未复发。
3.3 鉴别诊断 本病需与骨巨细胞瘤、软骨母细胞瘤、软骨肉瘤鉴别:①骨巨细胞瘤,好发于20~40岁愈合后的骨骺部,儿童及少年少见,典型病变为皂泡样改变,骨性间隔较CMF细,骨破坏区与正常骨边界清楚、无硬化边、无钙化,肿瘤有横向生长的倾向,最大经线常与骨干垂直;②软骨母细胞瘤,好发于20岁左右青少年的骨骺处,呈偏心性、轻度膨胀性生长,可见硬化边,典型表现为窗格样钙化,病灶周围炎性反应及软组织肿块多见;③软骨肉瘤,肿瘤体积大,增长快,与周围组织边界不清,无硬化边,呈浸润性生长,常伴局部肿瘤液化、坏死,而CMF病灶边界清楚,有硬化带,软骨及黏液基质内少见液化。
总之,CMF虽发病率低,但随病程进展其影像学表现具一定的特点,X线、CT、MRI及SPECT-CT检查各有优势,X线检查以其简便、经济的优势成为骨病诊断最基础的检查方法,能对中晚期骨质破坏明显的CMF提供重要信息,但X线检查在显示结构复杂、骨质重叠病变时不如CT,常规CT扫描结合图像后处理可清楚显示病变内部结构、有无皮质断裂、细小钙化、骨膜反应,测量病灶范围及密度值。MRI软组织分辨力高,可显示病灶软组织肿块与邻近骨质的关系及水肿范围,但对细小钙化、骨皮质破坏情况远不如CT。SPECT-CT根据浓聚特点可提示CMF成熟程度,对手术时机的选择、何时进行康复锻炼、治疗及预后判断具有重要意义。
[1]Morris LG,Rihani J,Lebowitz RA,et al.Chondromyxoid fibroma of sphenoid sinus with unusual calcifications:case report with literature review[J].Head Neck Pathol,2009,3:169-173.
[2]Smith CA,Magenis RE,Himoe E,et al.Chondromyxoid fibroma of the nasal cavity with an interstitial insertion between chromosomes 6 and 19[J].Cancer Genet Cytogenet,2006,171:97-100.
[3]Yaghi NK,Demonte F.Chondromyxoid fibroma of the skull base and calvarium:surgical management and literature review[J].J Neurol Surg,2016,77:e23-e34.
[4]Wu CT,Inwards CY,O’Laughlin S,et al.Chondromyxoid fibroma of bone:a clinicopathologic review of 278 cases[J].Hum Pathol,1998,29:438-446.
[5]Castle JT,Kernig ML.Chondromyxoid fibroma of the ethmoid sinus[J].Neuroradiology,2011,5:261-264.
[6]马玉峰,柳祥庭,刘继联,等.表现特殊的软骨粘液样纤维瘤[J].临床放射学杂志,1993,12(6):375-376.
[7]Fomete B,Adeosun OO,Awelimobor DI,et al.Recurrent pleomorphic adenoma of the upper lip:case report and review of the literature[J].Nige J Med,2015,24:277-280.
[8]张一洪,石洪成,顾宇参,等.99Tcm-MDP SPECT/CT骨显像对脊柱良恶性病变的鉴别诊断[J].中华核医学与分子影像杂志,2011,31(3):164-168.
[9]Damle RP,Suryawanshi KH,Dravid NV.Extradigital glomus tumour in synovium of knee joint:a rare case report[J].Int J Health Sci,2013,3:75-79.
[10]Nagaraj S.Chondromyxoid fibroma of calcaneum--a case report[J].Biomedscidirect Public,2014,5:3926-3928.

