慢性乙型肝炎及其合并脂肪肝患者各级纤维化声触诊组织量化技术测值的对比研究
常建东,郭争捷,陈小燕,张艳平,许梅娜
(福建省厦门市中医院超声科,福建 厦门 361009)
脂肪肝是各种原因引起的肝细胞内脂肪蓄积过多,脂质储存量达肝湿重5%以上,或显微镜下肝组织切片单位面积30%以上肝细胞内存有脂滴的一种疾病。脂肪肝程度的逐渐加重可导致肝纤维化甚至肝硬化[1]。慢性乙型肝炎(乙肝)合并脂肪肝时,肝硬化和肝细胞癌等相关疾病发生率会大大增加[2]。因此,准确诊断肝纤维化程度对慢性乙肝合并脂肪肝患者的病情评估及治疗尤为重要。声触诊组织量化技术(virtual touch quantification,VTQ)是通过测定肝脏硬度从而间接诊断肝纤维化的方法。本文旨在探讨慢性乙肝合并脂肪肝时剪切波速度值有无变化。
1 资料与方法
1.1 一般资料 收集2010年3月至2011年4月在我院行肝脏穿刺的乙肝(未合并脂肪肝)患者 311例(研究组),其中男233例,女78例;年龄 3~62岁,平均(32.8±10.2)岁。同时收集2014年11月至2016年12月我院行肝脏穿刺的乙肝合并脂肪肝患者311例(对照组),其中男269例,女42例;年龄9~68岁,平均(35.48±9.94)岁。脂肪肝程度5%~80%(依据肝细胞脂肪变性占所获取肝组织标本量的范围)。根据肝纤维化病理分级,将2组肝纤维化程度分为S0~S4级。
1.2 仪器与方法 使用Siemens S2000超声设备,探头频率4.5~2.0 MHz,可行VTQ。对临床诊断乙肝及超声诊断脂肪肝患者行肝脏剪切波速度测量,测量位置选择肝右叶,测量时患者屏住呼吸,测量区域不能包含肝内管状结构(血管及胆管)。
1.3 统计学方法 应用SPSS 19.0统计软件。乙肝及乙肝合并脂肪肝患者各级纤维化的剪切波速度值比较均行独立样本t检验。以P<0.05为差异有统计学意义。乙肝患者无S0级,2组未行S0级的比较。
2 结果
乙肝311例中,S1级161例,S2级66例,S3级39例,S4级45例;乙肝合并脂肪肝311例中,S0级7例,S1级203例,S2级58例,S3级28例,S4级15例。2组S1~S4级的剪切波速度均值比较见表1。
2组肝脏纤维化S1级比较结果,Levene检验F=16.835,P=0.000,方差不齐(方差不相等),t检验P=0.370;S2级比较,Levene检验F=0.053,P=0.818,方差齐性(方差相等),t检验P=0.690;S3级比较,Levene检验F=0.124,P=0.726,方差齐性(方差相等),t检验 P=0.744;S4级比较,Levene检验 F=0.030,P=0.863,方差齐性(方差相等),t检验P=0.289。由此可见,乙肝与乙肝合并脂肪肝患者同级别纤维化分期的剪切波速度测值差异均无统计学意义(均P>0.05)。
表1 2组各级肝纤维化剪切波速度值对比(v/m·s-1,±s)
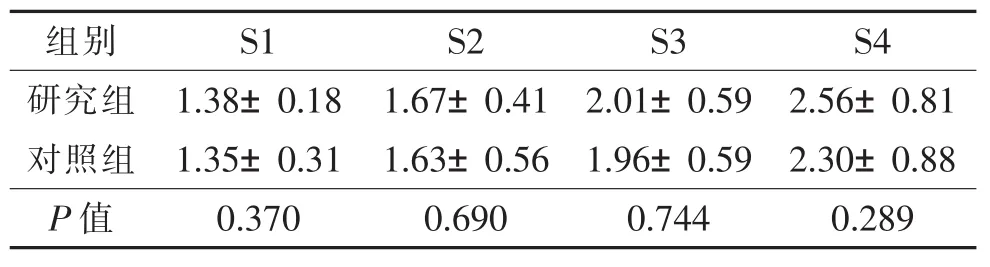
表1 2组各级肝纤维化剪切波速度值对比(v/m·s-1,±s)
?
3 讨论
病毒性肝炎和非酒精性脂肪性肝病(NAFLD)是我国成人慢性肝病的两大病因,其中全球50%的慢性乙肝携带者在我国。无明显饮酒者肝细胞内过量三酰甘油的蓄积超过肝重的5%称为NAFLD,NAFLD在我国发达地区发病率已达15%[3],主要与肥胖有关,且有低龄化趋势,病变可逐步发展为非酒精性肝炎、纤维化、肝硬化,导致持续性肝细胞损伤的主要原因是三酰甘油在肝细胞中超负荷的氧化应激。肥胖、糖尿病、代谢综合征及酒精滥用均可增加慢性乙肝患者肝硬化和肝癌的发病率[3]。慢性乙肝的主要机制是乙型肝炎病毒(HBV)感染引起的肝损伤和胰岛素抵抗,主要与机体免疫反应及炎症因子水平有关[4]。细胞内信号传导通过炎症因子的介导,导致肝细胞、脂肪细胞、肌肉细胞等胰岛素敏感细胞内的胰岛素受体底物1的丝氨酸磷酸化,使酪氨酸磷酸化受抑制,导致胰岛素信号传导受阻,从而诱发胰岛素抵抗,使肝脂肪酸摄取增加和转运障碍,最终导致脂肪酸水平升高[5-6]。
肝纤维化的形成主要是由于肝星状细胞(贮脂细胞)激活,细胞外间质成分生成过多,降解相对不足,在肝内大量沉积所致[7]。各种不同病因的慢性肝脏疾病,如不能及时诊断与治疗,可发展成为肝纤维化甚至肝硬化。除肝硬化期病理不可逆外,其他各期均有可逆性[8]。因此,早期明确诊断肝纤维化尤为重要,其诊断主要靠病理组织学活检,但由于肝活检有创,患者不易接受,限制了应用。近几年,超声弹性成像逐渐应用于临床,诊断效果接近病理诊断,优于实验室血清标志物检查,已成为目前诊断肝纤维化的常用检查方法之一[9-12],其中 VTQ操作简单、无创伤、重复性强、准确率高,可作为诊断肝纤维化的新方法。
VTQ是指通过探头将脉冲推进到组织或器官内的指定位置,使目标组织局部产生微小形变,应用探测技术检测组织形变而产生的横向剪切波传导速度,传导速度即可反映被测组织的软硬度。VTQ可显示清晰图像,避免测量到肝内血管、胆管等组织,且可行多点、多次测量。研究[13-14]表明肝脏纤维化是影响肝脏硬度的主要病理基础。
总之,本研究显示,乙肝患者与乙肝合并脂肪肝患者同级别肝纤维化分期的剪切波速度值差异均无统计学意义,表明脂肪变性对乙肝患者剪切波速度值无明显影响。
[1]李汉英,袁莉芳,董常峰,等.超声组织定征对均匀性脂肪肝分度的测量研究[J].中国超声诊断杂志,2005,6(4):261-263.
[2]王松贤,武俊,魏素云.慢性乙型肝炎合并脂肪肝252例临床与病理学分析[J].实用肝脏病杂志,2012,15(3):255-256.
[3]范建高,曾德民.脂肪性肝病[M].2版.北京:人民卫生出版社,2013:83-85.
[4]Kondo Y,Shimosegawa T.Effects of various soluble factors on the immunopathogenesis of HBV infection[J].Nihon Rinsho,2015,73:S414-S418.
[5]时德仁,东传凌,陆立,等.肝硬化时糖代谢紊乱与肝细胞胰岛素受体及胰腺细胞HBV DNA表达的关系[J].中华实验和临床病理学杂志,2003,17(4):372-375.
[6]Koroglu E,Canbakan B,Atay K,et al.Role of oxidative stress and insulin resistance in disease severity of non-alcoholic fatty liver disease[J].Turk J Gastroenterol,2016,27:361-366.
[7]孙自勤,王要军.新肝脏病学[M].济南:山东科学技术出版社,2002:310.
[8]Bonis PA,Friedman SL,Kaplan MM.Is liver fibrosis reversible?[J]. N Engl J Med,2001,344:452-454.
[9]Castera L,Winnock M,Pambrun E,et al.Comparison of transient elastography (FibroScan),FibroTest,APRI and two algorithms combining these non-invasive tests for liver fibrosis staging in HIV/HCV coinfected patients:ANRS CO13 HEPAVIH and FIBROSTIC collaboration[J].HIV Med,2014,15:30-39.
[10]Li SM,Li GX,Fu DM,et al.Liver fibrosis evaluation by ARFI and APRI in chronic hepatitis C[J].World J Gastroenterol,2014,20:9528-9533.
[11]Tada T,Kumada T,Toyoda H,et al.Utility of real-time shear wave elastography for assessing liver fibrosis in patients with chronic hepatitis C infection without cirrhosis:comparison of liver fibrosis indices[J].Hepatol Res,2015,45:440-447.
[12]Tamaki N,Kurosaki M,Matsuda S,et al.Prospective comparison of real-time tissue elastography and serum fibrosis markers for the estimation of liver fibrosis in chronic hepatitis C patients[J].Hepatol Res,2014,44:105-114.
[13]Yeshua H,Oren R.Noninvasive assessment of liver fibrosis[J]. Ann Transplant,2008,13:5.
[14]Ziol M,Handra-Luca A,Kettaneh A,et al.Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C[J].Hepatology,2005,41:48.

