36例复发胶质母细胞瘤再治疗患者临床资料分析
张溢华,王 昊,曾 实,欧阳庆,贺绪智,易 良,许民辉,徐伦山
(第三军医大学大坪医院野战外科研究所神经外科,重庆 400042)
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是WHO Ⅳ级星形细胞瘤在成人原发性脑肿瘤中最常见的类型[1]。新诊断的GBM在神经导航、功能定位、术中荧光和术中成像等先进技术辅助下的手术切除安全性和完整性逐步提高,随后同步放化疗联合替莫唑胺后6个月的辅助治疗,但规范化治疗后复发率仍高,GBM患者的平均生存时间为(29.40±5.18)个月[3]。手术治疗是影响首次诊断的GBM患者预后的重要因素[4]。然而,肿瘤复发患者手术治疗的效果仍不清楚,笔者对本院收治的36例多次手术治疗的复发GBM患者临床特点进行分析,探讨影响患者预后及肿瘤后续治疗的疗效,分析再次手术及其他治疗方法意义。
1 资料与方法
1.1一般资料 选取本院2008年3月至2014年3月收治因以头痛、反应迟钝、癫痫发作、言语不畅、肌力下降等颅内压增高及神经功能缺失症状再次就诊的GBM患者36例为研究对象。纳入标准:KPS评分大于或等于70分、肿瘤位置在非功能区(额叶14例,颞叶10例,顶叶7例,枕叶5例)。首次病理确诊后采取规范化治疗方案[5]的有18例,非规范化治疗18例。36例复发GBM患者中,男23例,女13例,年龄25~68 岁,平均(42.54±3.53)岁,首次手术后无症状进展期为1~17月。平均无症状进展期:规范化治疗组(9.610±4.877)月,非规范化治疗组(6.440±4.551)月;平均总体生存期:规范化治疗组(15.110±5.268)月,非规范化治疗组(12.610±5.952)月。肿瘤局限复发18例,其余为非局限复发18例[6-7];本组复发病例再次手术后复查全切11例,次全切13例,部分切除12例。
1.2方法
1.2.1影像学检查 手术前后均行磁共振成像(MRI)平扫+增强扫描,包括T2、FLAIR、DWI、PWI、MRS等MRI序列,排除同步放化疗者假性进展或放射性坏死的可能。术后一般在24~72 h内行MRI复查。根据术后MRI复查,切除程度分为:全切,瘤体及瘤体周围的异常信号区域MRI T1增强、T2、FLAIR异常信号全切除;次全切,术后MRI复查显示肿瘤T1增强消失,T2/FLAIR 异常信号部分残留;部分切除包括:术后MRI显示肿瘤T1增强消失,T2、FLAIR 异常信号前无明显变化;或肿瘤T1增强信号影仍有明显残留[8-9]。
1.2.2病理检查 在组织学检查基础上,检查O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子甲基化、染色体1p/19q杂合体缺失(1p/19qLOH)、异柠檬酸脱氢酶1(IDH1)基因、胶质纤维酸性蛋白(GFP)、Ki67和p53蛋白等分子生物学标志。
1.2.3治疗 新诊断的GBM患者分为规范化治疗组和非规范化治疗组。规范化治疗组方案为:最大范围的手术安全切除肿瘤,术后采用“STUPP方案”行替莫唑胺同步放疗及辅助化疗[2];其余为非规范化治疗方案。复发后采取如下治疗措施:(1)手术切除+立体定向放射治疗(γ刀);(2)手术+替莫唑胺化疗;(3)手术+γ刀+替莫唑胺化疗。
2 结 果
2.1无进展生存期单个因素分析 性别、切除程度、治疗方式及首次方案对无进展生存期影响,差异有统计学意义(P<0.05),见表1。
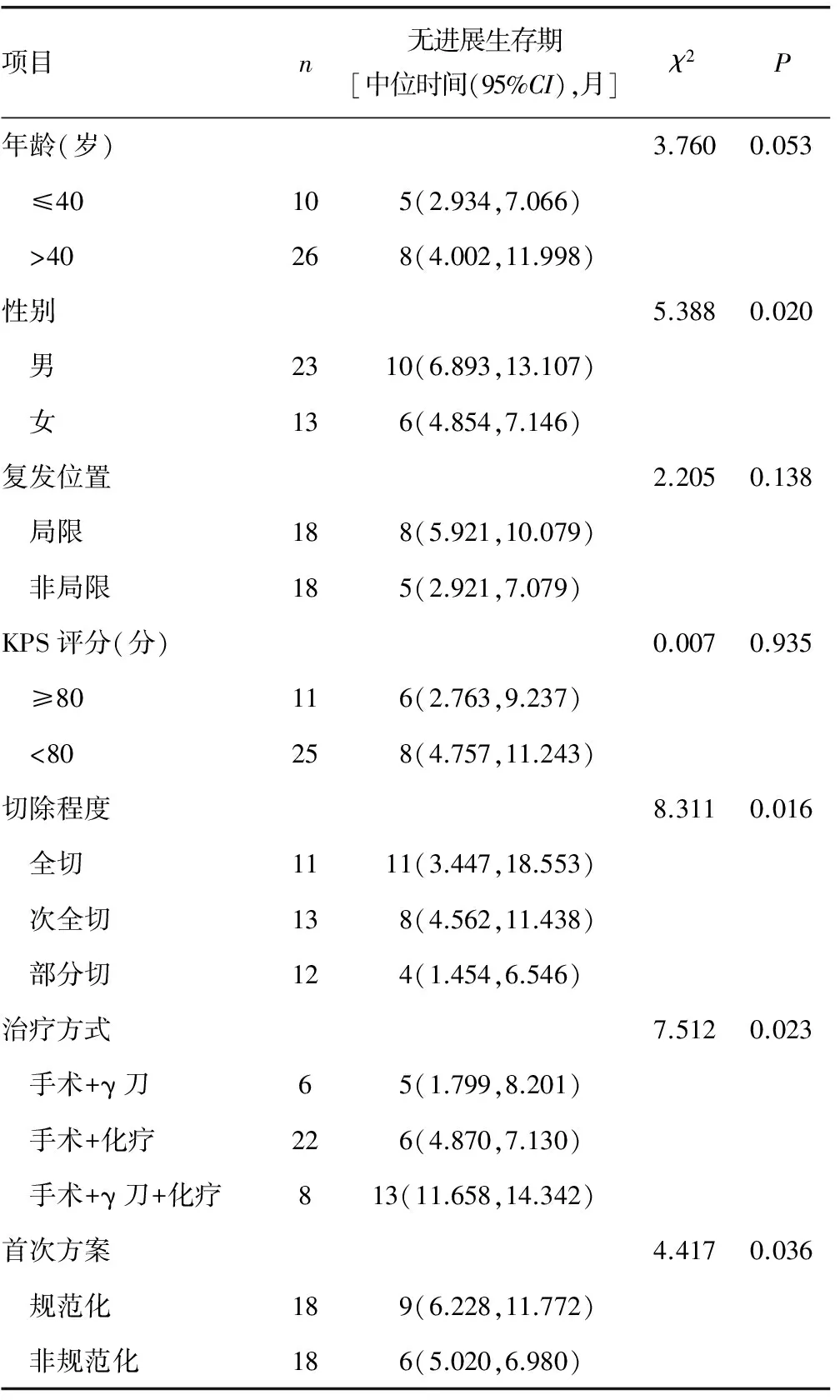
表1 无进展生存期单个因素分析结果
2.2无进展生存期多因素分析 KPS评分、切除程度、治疗方式对无进展生存期影响,差异有统计学意义(P<0.05),见表2。
2.3总生存期单个因素分析 切除程度对总生存期影响,差异有统计学意义(P<0.05),见表3。
2.4总生存期多因素分析 切除程度对总生存期影响,差异有统计学意义(P<0.05),风险比为2.236(1.365,3.663),见表4。
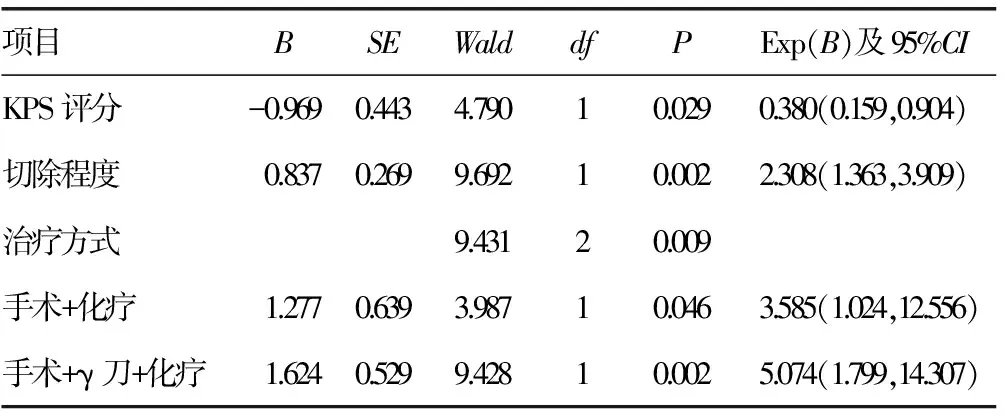
表2 无进展生存期多因素分析结果
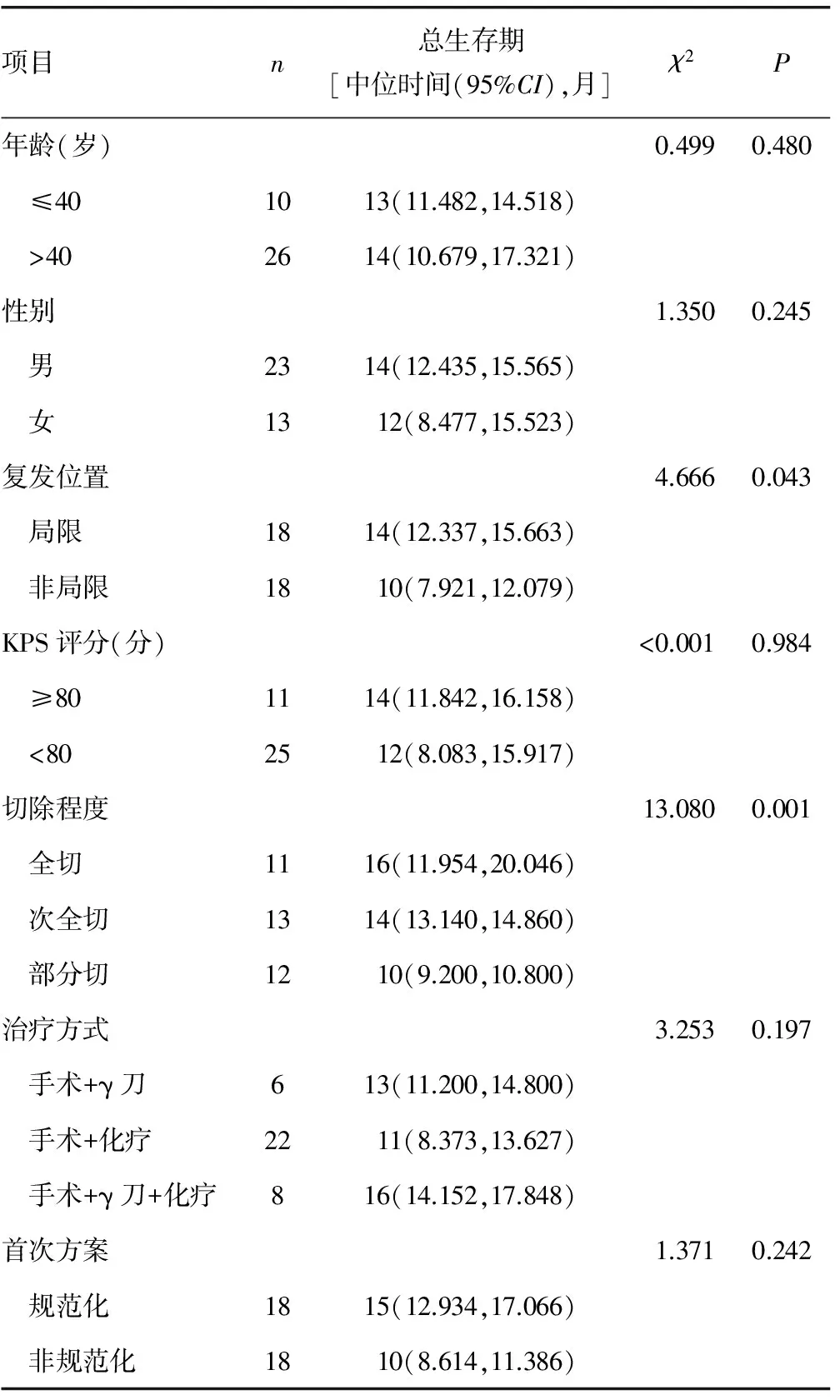
表3 总生存期单个因素分析结果

表4 总生存期多因素分析结果
3 讨 论
GBM是最常见的中枢神经系统恶性肿瘤,年发病约为4.8/10万人[10]。目前,GBM主要采取手术与放化疗联合的治疗方案,尽管实施了手术切除、放射及化学辅助治疗,但大多数GBM患者的生存时间小于1年[11],其复发率高是生存期短的主要原因。其复发后主要表现为肿瘤增大或(和)出现新的病灶,即局限复发、远处复发或随着脑脊液播散等[5]。
复发性GBM的预后除与年龄、KPS评分及肿瘤级别等有关外,切除程度、治疗方式均对无进展生存期具有影响(P<0.05)。另外,对于复发GBM治疗方案的选择也是一个重要因素。目前,复发性GBM的治疗缺乏最佳方案,文献报道再次手术后复发的中位生存期为6.602个月[12],也有研究结果显示复发患者KPS评分较高,提高肿瘤全切率患者生存期明显延长[13]。有证据表明,在提高安全性的基础上,扩大GBM的手术切除范围可能会显著改善生存[14-15],在复发患者全身情况允许条件下手术对于减轻肿瘤占位效应,治疗效果较为理想。对于本研究中肿瘤位于非功能区脑叶的复发患者,应做到保障神经功能下的全切,积极地切除瘤体及瘤体周围的异常信号区域;复发肿瘤位于功能区或向深部结构沿脑脊液播散者,在神经导航、荧光造影剂等先进技术辅助下手术尽最大可能切除肿瘤的同时要注重患者术后生活质量,本研究结果显示肿瘤局限复发者预后优于非局限复发者,手术切除程度也是影响患者生存时间的主要因素。虽然能借助各项先进技术使得肿瘤组织被最大化的切除,但由于GBM侵袭性生长的特性,即使在术后MRI复查提示:瘤体及瘤体周围在T1增强、T2、FLAIR异常信号区域消失,仍可能有肿瘤细胞残留,造成肿瘤复发。
放射治疗复发性GBM是否可提高生存期也存在争议。最初认为放射治疗可能存在脑实质损伤而禁止用于复发性疾病的治疗。BUTOWSKI等[16]研究认为,放射治疗可能是安全的并能提高复发性高级别星形细胞瘤患者的生存期。GUYOTAT等[17]研究表明,对于肿瘤复发后病灶较小,KPS评分较高的患者可行立体定向放射外科治疗作为姑息性治疗的选择,但BUTOWSKI等[16]研究结果显示,常规全脑放射治疗后再行立体定向放射外科治疗的方法增加15~24 Gy的放射剂量并不能改善GBM患者的生存率。什么时候该选择复发性GBM的再次放射治疗,SEYSTAHL等[18]研究建议在患者年龄适度、KPS评分较高或肿瘤体积较小的情况下可采用放射性治疗。
利用化学合成药物治疗复发性GBM受多方面因素的影响,如治疗标准的变化、纳入标准的差异及患者体质状况的异质性等。替莫唑胺是一种较为高效的化疗药物,常用于GBM的治疗。CAMPOS等[19]研究表明:放疗期间或者放疗后行替莫唑胺化疗可使GBM患者的中位生存期延长至14.6个月,而单纯放疗的中位生存期为12.1个月,并且毒性很小。为避免引起基因突变而导致治疗效果下降,替莫唑胺化疗时也应注意治疗周期和剂量。笔者对新确诊为GBM时初始治疗方案及复发后治疗措施的不同进行生存分析比较,得出本组中最优治疗方案为:新诊断患者采取标准治疗方案,即在头皮伤口拆线后2~3 d即开始放疗,剂量60 Gy,共30次持续6周,同步进行替莫唑胺化疗,口服75 mg/m2;同步放化疗后继续口服替莫唑胺化疗6个周期(每周期28 d,其中口服药物5 d,休息23 d)。
总之,影响复发性GBM患者的预后因素有很多,手术和放化疗仍然是治疗的主要方案,但由于肿瘤复发时生长部位及生物学特性不同,再次手术和放疗的效果尚有争议。可以明确的是,通过手术切除可再次明确病理分型,结合化疗药物、抗血管生成疗法及靶向生物免疫治疗,进一步优化 GBM的个体化治疗策略,对复发肿瘤仍位于非功能区有手术全切可能的病例,手术全切及综合治疗可改善患者的生活质量和部分患者的预后。
[1]MASON P,MAESTRO D,EISENSTAT D,et al.Canadian recommendations for the treatment of glioblastoma multiforme[J].Curr Oncol,2007,14(3):110-117.
[2]STUPP R,MASON W P,MJ V D B,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[3]LAWS R,PARNEY F,HUANG W,et al.Survival following surgery and prognostic factors for recently diagnosed malignant glioma:data from the glioma outcomes project[J].J Neurosurg,2003,99(3):467-473.
[4]NAVA F,TRAMACERE I,FITTIPALDO A,et al.Survival effect of first and second-line treatments for patients with primary glioblastoma:a cohort study from a prospective registry,1997-2010[J].Neuro Oncol,2014,16(5):719-727.
[5]《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断和治疗指南(2015)[J].中华医学杂志,2016,96(7):485-509.
[6]SONODA Y,SAITO R,KANAMORI M,et al.The association of subventricular zone involvement at recurrence with survival after repeat surgery in patients with recurrent glioblastoma[J].Neurol Med Chir(Tokyo),2014,54(4):302-309.
[7]DEORAH S,LYNCH C F,SIBENALLER Z A,et al.Trends in brain cancer incidence and survival in the united states:surveillance,epidemiology,and end results program,1973-2001[J].Neurosurg Focus,2006,20(4):E1.
[8]陈加贝,漆松涛,欧阳辉,等.影响胶质母细胞瘤患者预后的多因素分析[J].中华神经外科杂志,2015,31(1):48-53.
[9]MORSY A A,NG W H.Re-do craniotomy for recurrent glioblastoma[J].CNS Oncol,2015,4(2):55-57.
[10]BRANDES A A,BARTOLOTTI M,TOSONI A,et al.Patient outcomes following second surgery for recurrent glioblastoma[J].Future Oncol,2016,12(8):1039-1044.
[11]LI R,CHEN X C,YOU Y P,et al.Comprehensive portrait of recurrent glioblastoma multiforme in molecular and clinical characteristics[J].Oncotarget,2015,6(31):30968-30974.
[12]AZOULAY M,SANTOS F,SHENOUDA G,et al.Benefit of re-operation and salvage therapies for recurrent glioblastoma multiforme:results from a single institution[J].J Neurooncol,2017,132(3):419-426.
[13]MONTEMURRO N,PERRINI P,BLANCO M O,et al.Second surgery for recurrent glioblastoma:a concise overview of the current literature[J].Clin Neurol Neurosurg,2016,142:60-64.
[14]ARCHAVLIS E,TSELIS N,BIRN G,et al.Survival analysis of HDR brachytherapy versus reoperation versus temozolomide alone:a retrospective cohort analysis of recurrent glioblastoma multiforme[J].BMJ Open,2013,3(3):480-485.
[15]SOUHAMI L,SEIFERHELD W,BRACHMAN D,et al.Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme:report of radiation therapy oncology group 93-05 protocol[J].Int J Radiat Oncol Biol Phys,2004,60(3):853-860.
[16]BUTOWSKI N A,SNEED P K,CHANG S M.Diagnosis and treatment of recurrent high-grade astrocytoma[J].J Clin Oncol,2006,24(8):1273-1280.
[17]GUYOTAT J,SIGNORELLI F,FRAPPAZ D,et al.Is reoperation for recurrence of glioblastoma justified?[J].Oncol Rep,2000,7(4):899-904.
[18]SEYSTAHL K,WICK W,WELLER M.Therapeutic options in recurrent glioblastoma--an update[J].Crit Rev Oncol Hematol,2016,99(3):389-408.
[19]CAMPOS B,OLSEN L R,URUP T,et al.A comprehensive profile of recurrent glioblastoma[J].Oncogene,2016,35(45):5819-5825.

