首选碳青霉烯类药物经验性治疗恶性血液病伴粒细胞缺乏的疗效分析
石 琪,凌 云,张晓梅△
(1.江苏省常州市德安医院综合内科 213003;2.江苏省常州市第一人民医院血液科 213003)
随着放化疗、免疫抑制剂、激素及分子靶向治疗、造血干细胞移植等医疗技术的进展,恶性血液病患者的生存期有所延长,生存质量得到提高。但恶性血液病患者自身免疫力低,且放化疗、去甲基化等治疗后常合并不同程度的骨髓抑制,粒细胞缺乏时感染的发生率明显增高,约2%~28%[1-2],成为粒细胞缺乏患者最常见且最严重的并发症。感染往往无特异性,通常以发热为惟一表现,重症感染在很大程度上降低了治疗效果,影响预后。具有超广谱的碳青霉烯类抗生素常作为治疗严重感染的一线用药效果显著,去甲万古霉素亦作为覆盖革兰阳性菌的一线推荐治疗药物[3-9]。本研究回顾性分析316例粒细胞缺乏合并发热感染的恶性血液病患者的临床资料,拟为今后此类患者抗生素应用选择提供治疗依据。
1 资料与方法
1.1一般资料 选择常州市第一人民医院血液科2015年1月至2016年4月316例患者作为研究对象,均经病理学或细胞学确诊为恶性血液病,其中白血病262例,骨髓增生异常综合征23例,多发性骨髓瘤21例,再生障碍性贫血10例(所有病例均为接受化疗或骨髓移植前的预处理化疗后):中性粒细胞计数(ANC)<0.5 ×109/L,或预期在48 h后ANC<0.5 ×109/L;单次口温大于或等于38.3 ℃,或持续1 h体温大于或等于38.0 ℃,排除由疾病本身、药物、输血、移植物抗宿主病、结缔组织病等非感染性因素引起的发热[5]。所有患者无青霉素类、头孢类、碳青霉烯类、万古霉素过敏史,无心、肝、肾功能不全,无中枢神经系统疾病,女性患者不处于哺乳期及妊娠期。
1.2方法
1.2.1治疗方案 316例恶性血液病患者按治疗方案分成A组:头孢类抗生素/青霉素类(头孢地嗪/哌拉西林钠他唑巴坦钠)序贯碳青霉烯类(亚胺培南/美罗培南)和(或)去甲万古霉素治疗组(181例),根据2016版中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南为分A1高危组(54例),A2低危组(127例),两组均常规予头孢地嗪2 g,每12小时1次静脉滴注,或哌拉西林钠他唑巴坦钠4.5 g,每6小时1次静脉滴注,所有抗生素至少使用3 d以上,体温无下降或持续升高及临床症状加重视为临床无效,则更换为亚胺培南/美罗培南0.3 g,每8小时1次静脉滴注,和(或)去甲万古霉素80万单位 每12小时1次静脉滴注;B组(135例):碳青霉烯类经验性治疗组,其中又分B1组(72例)单用碳青霉烯类抗生素治疗组,予亚胺培南/美罗培南0.3 g,每8小时1次静脉滴注;B2组(63例):碳青霉烯类抗生素治疗过程中合并有革兰阳性菌感染的临床表现或病原学依据时联合去甲万古霉素治疗组(简称碳青霉烯类抗生素联合去甲万古霉素治疗组),予亚胺培南/美罗培南0.3 g,每8小时1次静脉滴注,治疗过程中发现有皮肤感染或明确的革兰阳性菌病原学依据(包括痰/咽拭子培养、血培养、肛周拭子培养等),加用去甲万古霉素80万单位,每12小时1次静脉滴注。所有患者上述抗生素方案在体温正常后续用3 d。在发热单次口腔稳定测定大于或等于38.3 ℃,或口温大于或等于38.0 ℃持续1 h,未使用抗生素前,留取血培养,C反应蛋白(C-reactive protein,CRP),痰、血、尿、局部病灶分泌物等标本按常规操作送检,并行胸部X射线/CT检查。抗生素使用过程中均定期复查血常规(每1~2天)、CRP(每2~5天)、其他生化检查(每4~7天)。完善血培养、痰/咽拭子培养、胸部X/CT,必要时行尿培养、肛周拭子培养检查,并定期复查直至转阴。如出现体温升高或临床症状加重,需多次留取标本培养。CRP检测方法采用的是免疫比浊测定法(透射)。
1.2.2疗效评价 参照卫生部制定的抗生素临床治疗标准分为4级,(1)治愈:临床症状、体征完全缓解,实验室及病原菌检查正常;(2)显效:临床症状、体征明显改善,至少有1项检查未恢复正常;(3)进步:临床症状、体征有所好转,但疗效不明显;(4)无效:用药3 d(72 h)但临床症状、体征无明显改善。
总有效率(%)=(治愈例数+显效例数)/总例数×100%
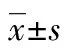
2 结 果
2.1基本资料比较 两组年龄、性别、诊断、粒细胞数值及持续时间之间差异无统计学意义(P>0.05),见表1。

表1 两组恶性血液病粒缺合并发热感染患者的基本情况
2.2化疗及预处理方案的影响比较 白血病、骨髓增生异常综合征、多发性骨髓瘤入选病例均行化疗或预处理方案,其方案不同,骨髓抑制情况有所不同,依据化疗或预处理方案的不同分为9个亚组分析。无论哪种化疗或预处理方案,B组抗生素使用平均时间显著缩短,两组抗生素使用平均时间比较,差异有统计学意义(P<0.05),见图1。
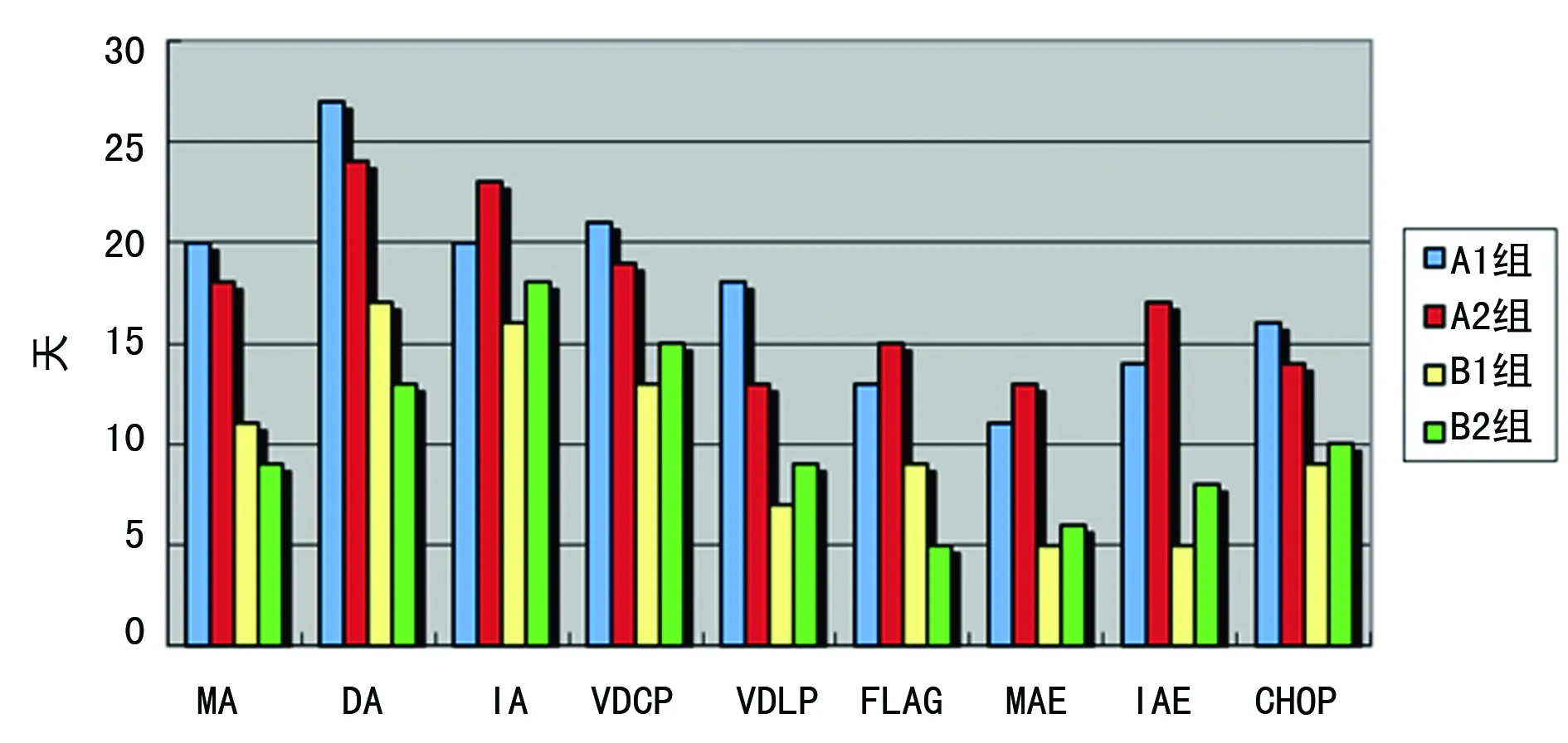
MA:米托蒽醌+阿糖胞苷;DA:柔红霉素+阿糖胞苷;IA:去甲氧柔红霉素+阿糖胞苷;VDCP:长春新碱+柔红霉素+环磷酰胺+泼尼松;VDLP:长春新碱+柔红霉素+左旋门冬酰胺酶+泼尼松;FLAG:氟达拉滨+阿糖胞苷+重组人粒细胞集落刺激因子;MAE:米托蒽醌+阿糖胞苷+依托泊苷(VP-16):IAE:去甲氧柔红霉素+阿糖胞苷+VP-16;CHOP:环磷酰胺+阿霉素+长春新碱+泼尼松
图1两组化疗或预处理方案抗生素使用总时间比较
2.3感染部位比较 从统计结果上来看,感染病原灶以呼吸道感染最多。感染种类分为革兰阳性菌(G+)、革兰阴性菌(G-)两类,见表2。

表2 316例恶性血液病粒缺合并发热感染患者感染部位及感染种类分析(n)
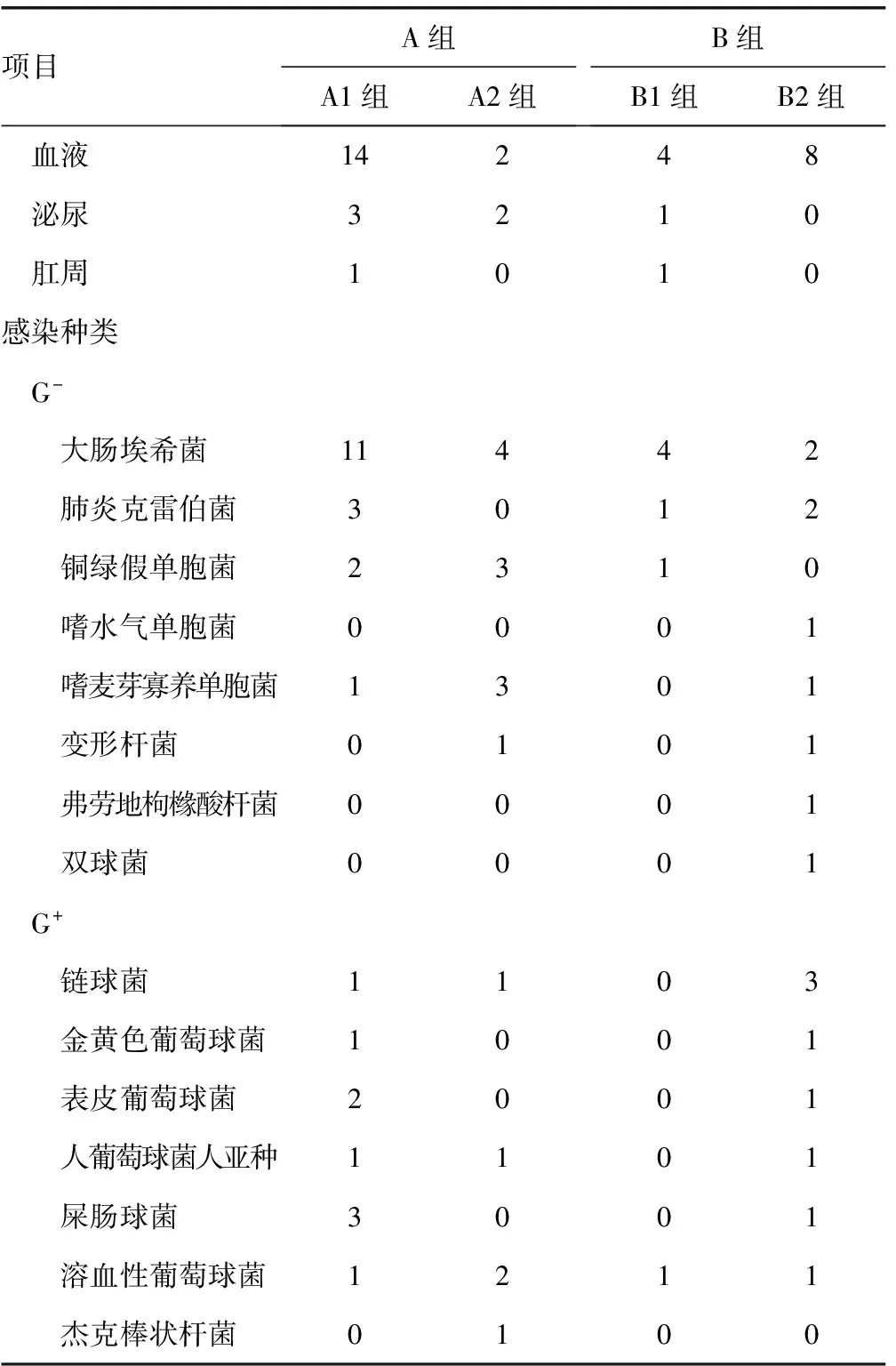
续表2 316例恶性血液病粒缺合并发热感染患者感染部位及感染种类分析(n)
2.4抗生素疗效比较 A1组有效率88.98%,A2组有效率90.74%,A组总有效率89.50%,B1组有效率93.06%,B2组有效率93.65%,B组总有效率93.33%,两组差异无统计学意义(χ2=0.97,P>0.05)。而A1组抗生素使用平均时间为(26.03±8.24)d,A2组抗生素使用平均时间为(21.29±7.43)d,A组抗生素使用总平均时间为(25.31±9.42)d,B1组抗生素使用平均时间为(13.67±3.71)d,B2组抗生素使用平均时间为(20.33±6.82)d,B组抗生素使用总平均时间为(14.09±6.27)d,A1高危组抗生素使用平均时间较B组抗生素使用平均时间明显延长,B组抗生素使用总平均时间较A组显著缩短。
3 讨 论
恶性血液病患者化疗、激素、免疫抑制剂使用密集,强度较大,骨髓抑制明显,粒细胞缺乏时间长,常合并发热感染,通常症状和体征不典型,病情发展迅速,易导致严重感染,感染相关致死率可达11.0%~36.0%[10-11],经常难以早期发现病原菌及病原灶,根据2016年美国感染病学会(IDSA)联合美国医疗保健流行病学学会(SHEA)起草发布的实施抗生素管理方案(ASPs),此时应及早运用广谱抗生素经验性治疗。
CRP作为一种由肝脏在急性时相合成的反应蛋白,它虽然是炎症及其他不同刺激物的非特异性蛋白,但是对于器官性疾病的刷选,鉴别细菌感染还是病毒感染,监测疾病的活动情况和严重性、观察治疗效果有很好的指导作用,特别是对抗生素的合理应用有提示性作用。尤其对于粒细胞缺乏合并发热的血液病患者,血常规不能及时有效的反应感染情况,而CRP与感染的严重程度呈正相关,故此时可考虑使用CRP作为监控感染控制的实验室指标之一。
据相关文献报道,粒细胞缺乏合并发热感染的化疗或预处理患者首次血培养阳性率仅4.9%,在我国粒细胞缺乏伴发热的患者中G-占全部细菌总数的54.0%,与国外的报道基本一致[4,19]。碳青霉烯类抗生素对G-及绝大多数G+均有良好的抗菌作用,且不良反应较小[12-13]。结合国内外研究报道,粒细胞缺乏伴发热的血液病患者致病菌中G+占22.0%~53.2%,呈上升趋势,其主要致病菌也以葡萄球菌属向肠球菌转变,而去甲万古霉素对耐甲氧西林的葡萄球菌属、链球菌,尤其是肠球菌属有较强的抗菌活性,不良反应轻微[14-18]。本研究按照不同病种分析,A、B两组方案的有效率差异无统计学意义(P>0.05),但B方案中抗生素使用总平均时间较A组显著缩短,与有关报道结果相符[19],其中A1高危组抗生素平均时间较B组抗生素使用总平均时间延长更明显。所以,对于恶性血液病粒细胞缺乏合并发热感染的患者,尤其属于高危组人群,首选碳青霉烯类经验性治疗能有效控制感染,明显缩短感染时间,降低医疗费用,节约医疗资源,疗效优于传统序贯抗感染治疗,是一线治疗中极其有效的用药选择。
[1]BHARDWAJ A S,NAVADA S C.Management of chemotherapy-induced neutropenic fever[J].Hosp Pract,2013,41(1):96-108.
[2]OZTOPRAK N,PISKIN N,AYDEMIR H,et al.Piperacillin-tazobactam versus carbapenem therapy with and without amikacin as empirical treatment of febrile neutropenia in cancer patients:results of an open randomized trial at a university hospital[J].Jpn J Clin Oncol,2010,40(8):761-767.
[3]中华医学会血液学分会,中国医师协会血液科医师分会.中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2016年版)[J].中华血液学杂志.2016,37(5):353-359.
[4]周璨,王婧,苏强等.两种碳青霉烯类抗生素对粒缺肿瘤患者伴感染治疗的Meta分析[J].中国抗生素杂志,2014,39(7):544-548.
[5]HUGHE W T,ARMSTRONG D,BODEY G P,et al.2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer[J].Clin Infect Dis,2002,34(4):730-751.
[6]HAMIDAH A,RIZAL A M,NORDIAH A J,et al.Piperacillin-tazobactam plus amikacin as an initial empirical therapy of febrile neutropenia in paediatric cancer patients[J].Singapore Med J,2008,49(1):26-30.
[7]VANDERCAM B,GERAIN J,HUMBLET Y,et al.Meropenem versus ceftazidime as empirical monotherapy for febrile neutropenic cancer patients[J].Ann Hematol,2000,79:152-157.
[8]SEREFHANOGLU K,ERSOY Y,SEREFHANOGLU S,et al.Clinical experience with three combination regimens for the treatment of high-risk febrile neutropenia[J].Ann Acad Med Singapore,2006,35(1):11-16.
[9]梁晓华.恶性血液疾病化疗后中性粒细胞减少时感染的诊断和治疗[J].中国抗感染化疗杂志,2003,3(1):58-60.
[10]赵君操,张文周,许青霞.2007-2009年肿瘤医院感染病原菌分布及其耐药性调查分析[J].中华医院感染学杂志,2001,21(15):3272-3274.
[11]KRUSE B D,UNTERER S,HORLACHER K,et al.Feline panleukopenia-different course of disease in cats younger than versus older than 6 mouths of age? [J].Tierarztl Prax Ausg K Kleintiere Heimtiere,2011,39(4):237-242.
[12]WISPLINGHOFF H,SEIFERT H,WENZEL R P,et al.Current trends in the epidemiology of nosocomial bloodstream infections in patients with hematological malignancies and solid neoplasms in hospitals in the United States[J].Clin Infet Dis,2003,36(9):1103-1110.
[13]NIITSUMA K,SAITOH M,KOJIMABARA M,et al.Antimicrobial susceptibility of pseudomonas aeruginosa isolated in fukushima prefecture[J].Jpn J Antibiot,2001,54:79-87.
[14]李家泰,李耘,王进.中国医院和社区获得性感染革兰阳性球菌耐药性监测研究[J].中华医学杂志,2003,83:365-374.
[15]NESHER L,ROLSTON K V.The current spectrum infection in cancer patients with chemotherapy related neutropenia[J].Infection,2014,42(1):5-13.
[16]孟凡义,扶云碧,徐兵,等.国产与进口盐酸万古霉素经验性治疗恶性血液病合并感染的比较[J].中华血液学杂志,2005,26:756-757.
[17]卢锡京,黄晓军,沈志祥,等.头孢哌酮/舒巴坦联合阿米卡星与亚胺培南/西司他丁经验性治疗中性粒细胞缺乏发热患者的对照研究[J].中华医院感染学杂志,2007,17(7):874-877.
[18]朱骏,周一飞,白海涛,等.中性粒细胞缺乏伴发热患者临床分离菌的分布及药敏分析[J].中国感染与化疗杂志,2016,16(3):241-246.
[19]段连宁,纪树荃,曹晋桂,等.联合应用抗生素对中性粒细胞减少期感染的经验性治疗[J].中华医院感染学杂志,2006,16(1):79-82.

